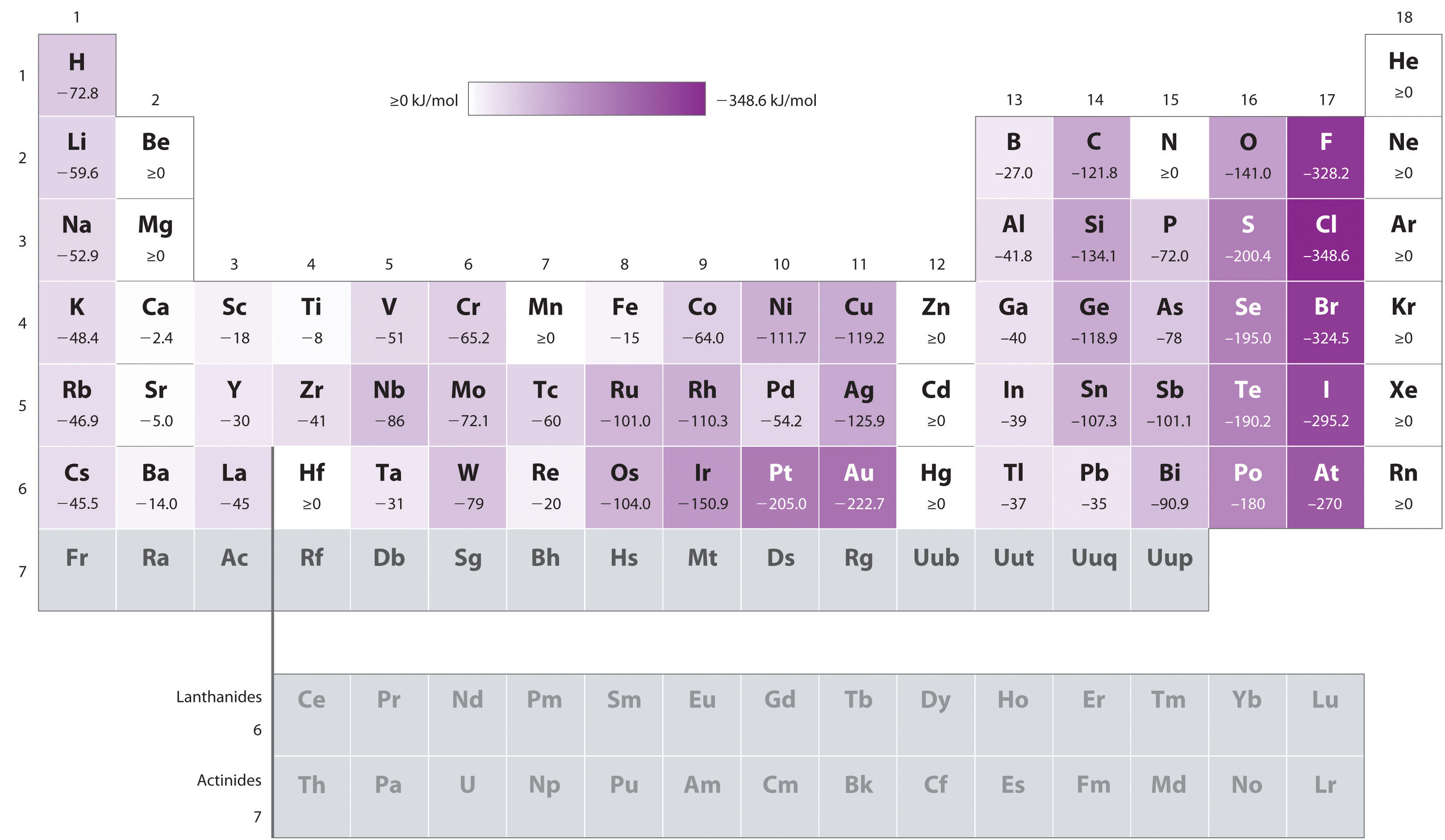
Atomy s největší poloměry, které mají nejnižší ionizační energie (afinitu pro jejich vlastní valenční elektrony), mají také nejnižší afinitu pro přidaný elektron. Existují však dvě hlavní výjimky z tohoto trendu:
- elektronové afinity prvků B až F v druhé řadě periodické tabulky, jsou méně negativní, než ty prvky, hned pod nimi ve třetí řadě., Zdá se, že zvýšené elektron–elektron repulsions zkušený elektrony omezeny na relativně malé 2p orbitaly překonat zvýšenou elektron–jádro atrakcí v krátké jaderné vzdálenosti. Fluor má proto nižší afinitu k přidanému elektronu než chlor. V důsledku toho mají prvky třetího řádku (n = 3) nejvíce negativní elektronové afinity. Dále po sloupci se přitažlivost přidaného elektronu snižuje, protože elektron vstupuje do orbitalu vzdálenějšího od jádra., Odpuzování elektronů a elektronů se také snižuje, protože valenční elektrony zabírají větší objem prostoru. Tyto účinky mají tendenci se navzájem rušit, takže změny v elektronové afinitě v rodině jsou mnohem menší než změny ionizační energie.
- elektronové afinity kovů alkalických zemin se stávají negativnějšími od Be po Ba. Energie separace mezi naplněné ns2 a prázdné np slupek klesá s rostoucím n, tak, že vzniku aniontu z těžších prvků se stává energeticky výhodnější.,
rovnice pro druhý a vyšší elektronové afinity jsou obdobné jako pro druhé a vyšší ionizační energie,
\
\
Jak jsme viděli, první elektronová afinita může být větší než nebo rovno nule, nebo negativní, v závislosti na elektronové konfiguraci atomu. V kontrastu, druhý elektronová afinita je vždy pozitivní, protože zvýšené elektron–elektron repulsions v dianion jsou mnohem větší, než přitažlivost jádra pro další elektrony., Například, první elektronová afinita kyslíku je -141 kJ/mol, ale druhý elektronová afinita je +744 kJ/mol:
\
\
Tak vznik plynných oxidů (\(O^{2−}\)) iontu je energeticky poměrně nepříznivé (odhad přidáním obou krocích):
\
Zatímco první elektronová afinita může být negativní, pozitivní nebo nulový, druhý elektronové afinity jsou vždy pozitivní.,
Pokud je energie nutná k formě, a to jak kladně nabité kationty a monoatomární polyanionty, proč iontové sloučeniny, jako jsou \(MgO\), \(Na_2S\) a \(Na_3P\) podobě? Klíčovým faktorem při tvorbě stabilních iontových sloučenin jsou příznivé elektrostatické interakce mezi kationty a anionty v krystalické soli.
Například \(\PageIndex{1}\): Kontrastní Elektronové Afinity Sb, Se a Te
na Základě jejich pozice v periodické tabulce, který ze Sb, Se, nebo Te by jsi předvídat, že mají nejvíce negativní elektronovou afinitu?,
daný: tři prvky
požádal o: prvek s nejvíce negativní elektronovou afinitou
strategie:
- vyhledejte prvky v periodické tabulce. Použijte trendy v elektron afinities jít dolů sloupec pro prvky ve stejné skupině. Podobně použijte trendy v elektronových afinitách zleva doprava pro prvky ve stejném řádku.
- umístěte prvky do pořadí a nejprve uveďte prvek s nejvíce negativní elektronovou afinitou.,
Řešení:
víme, že elektronové afinity stane méně negativní, že jde dolů sloupci (s výjimkou abnormálně nízké elektronové afinity prvků druhé řadě), takže můžeme předpokládat, že elektronová afinita se je více negativní než Te. Víme také, že elektronové afinity se více negativní zleva doprava po řadě, a to, že skupina 15 prvků mají hodnoty, které jsou méně negativní, než se očekávalo., Protože Sb se nachází vlevo od Te a patří do skupiny 15, předpovídáme, že elektronová afinita Te je zápornější než afinita Sb. Celkové pořadí je Se < Te < Sb, tak Se má nejvíce negativní elektronovou afinitu mezi třemi prvky.