nejprve musíte znát počet valenčních elektronů. Můžete to udělat (1) nakreslením konfigurace elektronů na prvek nebo (2) konzultováním periodické tabulky.,
Pokud jste se rozhodli nakreslit elektronovou konfiguraci na prvek, bude mít něco jako toto:
#N# (atomové číslo = 7) : #1s^2# #barva (červená) (2s^2)# #barva (červená) (2p^3)# (5 nejvzdálenější elektrony)
#O# (atomové číslo = 8) : #1s^2# #barva (červená) (2s^2)# #barva (červená) (2p^4)# (6 nejvzdálenější elektrony)
Pokud jste se rozhodli poradit se svým periodické tabulky, všimněte si, že #N# patří do Skupiny 5A, zatímco #O# patří do Skupiny 6A. Skupina číslo označuje počet nejvzdálenější elektrony.,
nyní, když znáte počet valenčních elektronů na prvek, musíte vypočítat celkové valenční elektrony pro iont #NO_3^“ -1″#.
5 +(3 x 6) = 23 elektronů
ale protože celá molekula má náboj -1, musíte to také přidat. Takže celkový počet valenčních elektronů je 24.
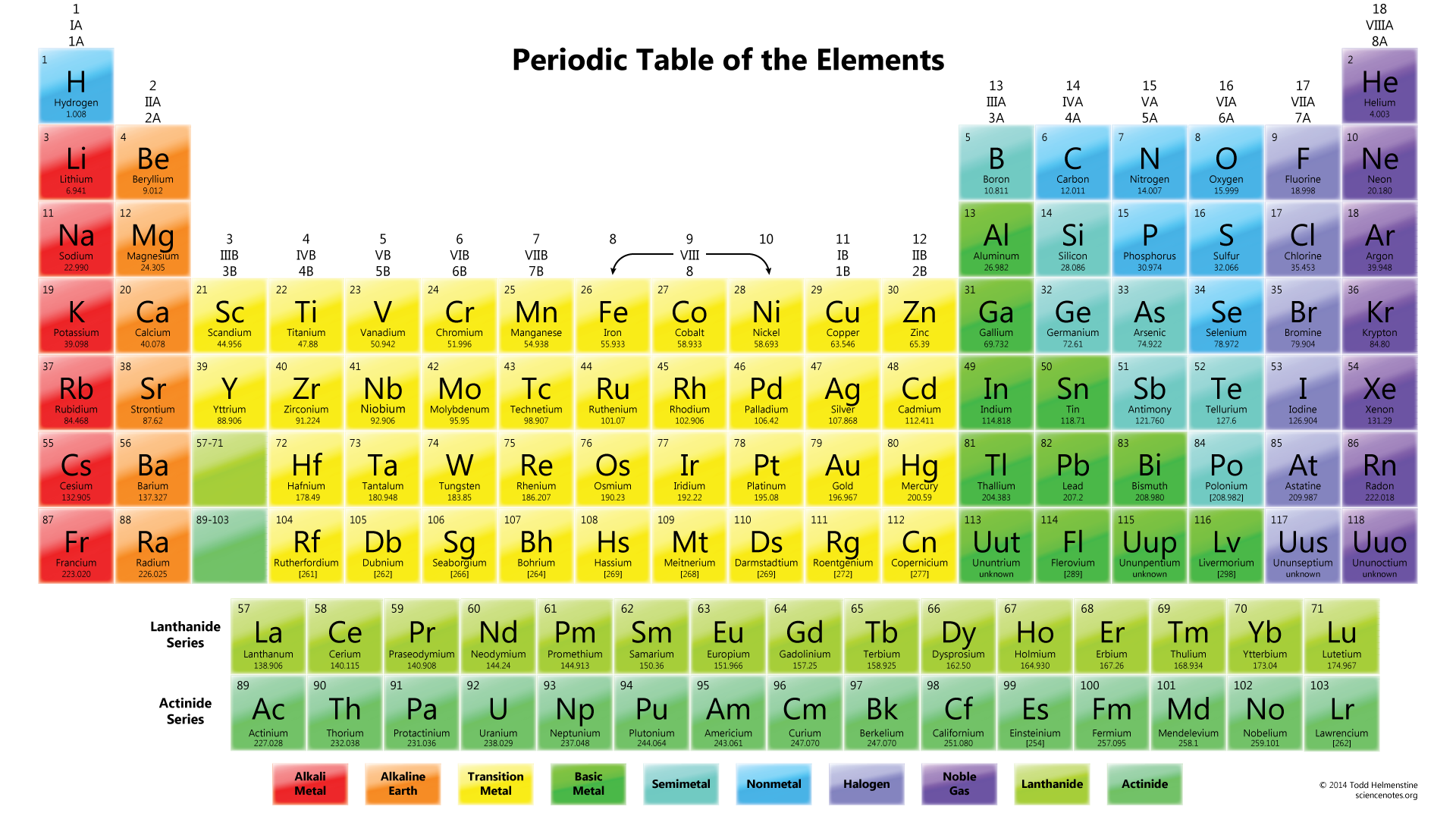
Další věc, kterou musíte udělat, je kreslit. Obvykle je prvním prvkem chemického vzorce centrální atom. V tomto případě je atom #N# obklopen třemi atomy # O#.,
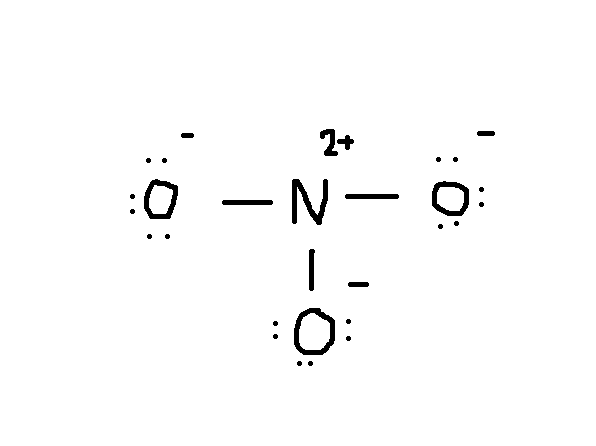
Všimněte si, že osamělý pár elektronů z #O# je také zahrnut v diagramu. Pokud počítáte celkový počet elektronů na výše uvedeném výkresu, je to již 24 elektronů (jedna čára se počítá jako 2 elektrony). Tento výkres však porušil pravidlo oktetu, protože centrální atom má místo správného čísla 8 pouze 6 elektronů. Tak co dělat?
přidat další vazbu, ale kde?,
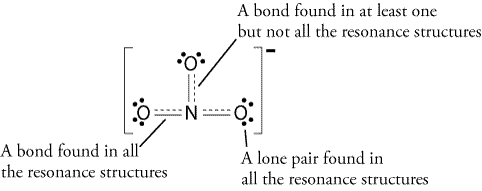
Proto, rezonanční struktura bude vypadat takto: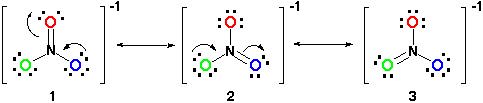
Všechny rezonanční struktury jsou správné, protože to vyplývá octet pravidlo a všichni mají celkem 24 elektronů. Stačí si uvědomit, že jediným pohybem vazby je vazba pi (#pi#) nebo laicky řečeno dvojná vazba a jeden z elektronových párů z # o # atom.