Cíle Vzdělávání
- Porovnat bodové mutace a posunovými mutacemi
- Popsat rozdíly mezi missense, nonsense, a tiché mutace
- Popsat rozdíly mezi světlými a tmavými opravy
- Vysvětluje, jak různé mutageny působí
- Vysvětlete, proč Ames test může být použit k detekci karcinogeny
- Analyzovat sekvence DNA, a identifikovat příklady typů mutací
mutace dědičné změny v sekvenci DNA organismu., Výsledný organismus, nazývaný mutant, může mít rozpoznatelnou změnu fenotypu ve srovnání s divokým typem, což je fenotyp nejčastěji pozorovaný v přírodě. Změna sekvence DNA je udělena mRNA transkripcí a může vést ke změněné sekvenci aminokyselin v proteinu při překladu. Protože proteiny provádějí převážnou většinu buněčných funkcí, může změna sekvence aminokyselin v proteinu vést ke změněnému fenotypu pro buňku a organismus.,
Účinky Mutací na Sekvenci DNA
Existuje několik typů mutací, které jsou klasifikovány podle toho, jak molekula DNA je změněna. Jeden typ, nazývaný bodová mutace, ovlivňuje jednu základnu a nejčastěji se vyskytuje,když je jedna báze nahrazena nebo nahrazena jinou. Mutace také vyplývají z přidání jedné nebo více bází, známých jako vložení, nebo odstranění jedné nebo více bází, známých jako delece.
Přemýšlejte o tom
- jaký typ mutace nastane, když má gen ve své sekvenci o dva méně nukleotidů?,
účinky mutací na proteinovou strukturu a funkci
bodové mutace mohou mít širokou škálu účinků na funkci bílkovin (Obrázek 1). V důsledku degenerace genetického kódu bude bodová mutace běžně vést k tomu, že stejná aminokyselina bude začleněna do výsledného polypeptidu navzdory změně sekvence. Tato změna by neměla žádný vliv na strukturu proteinu, a proto se nazývá tichá mutace. Mutace missense vede k tomu, že do výsledného polypeptidu je začleněna jiná aminokyselina., Účinek mutace missense závisí na tom, jak chemicky odlišná je nová aminokyselina od aminokyseliny divokého typu. Důležité je také umístění změněné aminokyseliny v proteinu. Například pokud je změněná aminokyselina součástí aktivního místa enzymu, může být účinek mutace missense významný. Mnoho mutací missense vede k proteinům, které jsou stále funkční, alespoň do určité míry. Někdy mohou být účinky mutací missense patrné pouze za určitých podmínek prostředí; takové mutace missense se nazývají podmíněné mutace., Zřídka může být prospěšná mutace missense. Za správných podmínek prostředí může tento typ mutace poskytnout organismu, který ho má selektivní výhodu. Další typ bodové mutace, nazývaná nesmyslná mutace, převádí kodon kódující aminokyselinu (smyslový kodon) na stop kodon (nesmyslný kodon). Nesmysl mutace vyústí v syntézu proteinů, které jsou kratší než divoký typ a obvykle není funkční.
odstranění a vložení také způsobují různé účinky., Protože kodony jsou trojice nukleotidů, inserce nebo delece v skupiny tří nukleotidů mohou vést k vložení nebo vymazání jednoho nebo více aminokyselin, a nesmí způsobovat významné účinky na výsledný protein je funkčnost. Nicméně, posunovými mutacemi, způsobené inzercí nebo delecí několika nukleotidů, které nejsou násobkem tří jsou velmi problematické, protože posun ve čtení, rám výsledky (Obrázek 1). Protože ribozomy čtou mRNA v trojitých kodonech, mutace frameshift mohou změnit každou aminokyselinu po bodu mutace., Nový čtecí rámeček může také obsahovat stop kodon před koncem kódovací sekvence. V důsledku toho jsou proteiny vyrobené z genů obsahujících mutace frameshift téměř vždy nefunkční.
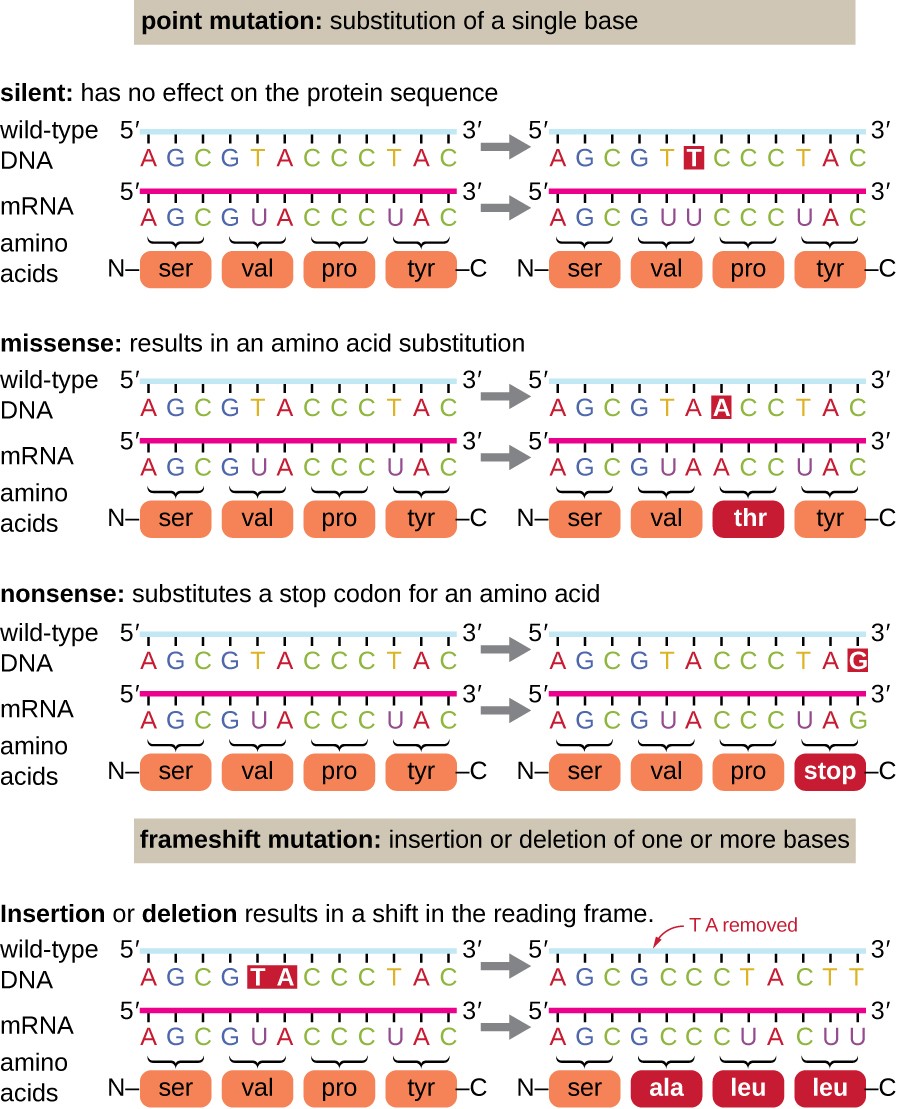
Obrázek 1. Klikněte pro větší obrázek. Mutace mohou vést ke změnám v proteinové sekvenci kódované DNA.
- Jaké jsou důvody, proč nukleotidové změny v genu pro protein nemusí mít žádný vliv na fenotyp, že gen?,
- Je možné pro vložení tří nukleotidů spolu po páté nukleotidů v protein-kódující gen pro produkci proteinu, který je kratší než normální? Jak nebo jak ne?
Prospěšné Mutace
Od první případ infekce virem lidské imunodeficience (HIV) byl zaznamenán v roce 1981, téměř 40 milionů lidí zemřelo od infekce HIV, virus, který způsobuje syndrom získané imunodeficience (AIDS)., Virus se zaměřuje na pomocné T buňky, které hrají klíčovou roli při přemostění vrozené a adaptivní imunitní odpovědi, infikování a zabíjení buněk normálně zapojených do reakce těla na infekci. Neexistuje žádný lék na infekci HIV, ale bylo vyvinuto mnoho léků, které zpomalují nebo blokují progresi viru. I když jednotlivci po celém světě mohou být napadeny, nejvyšší prevalence u lidí 15-49 let je v Subsaharské Africe, kde téměř jeden člověk z 20 je napaden, což představuje více než 70% infekcí na celém světě (Obrázek 2)., Bohužel je to také část světa, kde nejvíce chybí preventivní strategie a léky k léčbě infekce.

Obrázek 2. HIV je v subsaharské Africe velmi rozšířený, ale jeho prevalence je v některých jiných částech světa poměrně nízká.
v posledních letech vzbudil vědecký zájem objev několika jedinců ze severní Evropy, kteří jsou rezistentní vůči infekci HIV. V roce 1998 americký genetik Stephen J., O ‚ Brien v National Institutes of Health (NIH) a jeho kolegové zveřejnili výsledky své genetické analýzy více než 4 000 jedinců. Tyto uvedly, že mnoho jedinců Euroasijského původu (až 14%, v některých etnických skupin) mít vypuštění mutace CCR5-delta 32, v genu kódování CCR5. CCR5 je coreceptor nalezený na povrchu T buněk, který je nezbytný pro mnoho kmenů viru pro vstup do hostitelské buňky. Mutace vede k produkci receptoru, na který se HIV nemůže účinně vázat, a tak blokuje vstup viru., Lidé homozygotní pro tuto mutaci výrazně snížili náchylnost k infekci HIV a ti, kteří jsou heterozygotní, mají také určitou ochranu před infekcí.
To není jasné, proč lidé v severní Evropského původu, konkrétně, nesou tuto mutaci, ale jeho výskyt se zdá být nejvyšší v severní Evropě a postupně klesá v populaci jako jeden se pohybuje na jih. Výzkum ukazuje, že mutace byla přítomna od doby, kdy se objevil HIV, a mohla být vybrána v evropských populacích v důsledku expozice moru nebo neštovicím., Tato mutace může chránit jednotlivce před morem (způsobené bakterií Yersinia pestis) a neštovice (způsobené viru varioly), protože tento receptor může být také zapojen v těchto onemocnění. Věk této mutace je otázkou debaty, ale odhady naznačují, že se objevil mezi lety 1875 až 225 před lety a mohl být rozšířen ze severní Evropy prostřednictvím vikingských invazí.
toto vzrušující zjištění vedlo k novým cestám ve výzkumu HIV, včetně hledání léků, které blokují vazbu CCR5 na HIV u jedinců, kteří mutaci postrádají., I když DNA testy k určení, který jedinci nesou CCR5-δ 32 mutace je možné, tam jsou dokumentovány případy jedinci homozygotní pro tuto mutaci nákazy HIV. Z tohoto důvodu není Testování DNA na mutaci úředníky veřejného zdraví široce doporučováno, aby nepodporovalo rizikové chování u těch, kteří mutaci nesou. Nicméně inhibice vazby HIV na CCR5 je i nadále platnou strategií pro vývoj lékových terapií pro osoby infikované HIV.,
příčiny mutací
chyby v procesu replikace DNA mohou způsobit spontánní mutace. Chybovost DNA polymerázy je jedna nesprávná báze na miliardu párů bází replikovaných. Expozice mutagenům může způsobit indukované mutace, což jsou různé typy chemických látek nebo záření (Tabulka 1). Expozice mutagenu může zvýšit rychlost mutace více než 1000krát. Mutageny jsou často také karcinogeny, látky, které způsobují rakovinu. Nicméně, zatímco téměř všechny karcinogeny jsou mutagenní, ne všechny mutageny jsou nutně karcinogeny.,
| Tabulka 1., to AT base pair | Point | |||
|---|---|---|---|---|
| Intercalating agents | ||||
| Acridine orange, ethidium bromide, polycyclic aromatic hydrocarbons | Distorts double helix, creates unusual spacing between nucleotides | Introduces small deletions and insertions | Frameshift | |
| Ionizing radiation | ||||
| X-rays, γ-rays | Forms hydroxyl radicals | Causes single- and double-strand DNA breaks | Repair mechanisms may introduce mutations | |
| X-rays, γ-rays | Modifies bases (e.,g., deaminating C až U) | Převádí GC až NA pár bází | ||
| Neionizujícím zářením | ||||
| Uv | Formy pyrimidinu (obvykle thymin) dimery | Způsobí, že replikace DNA chyb | Posunovými nebo bod | |
Chemické Mutageny
Různé typy chemických mutagenů komunikovat přímo s DNA, a to buď tím, že působí jako nukleosidové analogy nebo změnou nukleotidové báze., Chemické látky zvané nukleosidové analogy jsou strukturně podobné normálním nukleotidovým bázím a mohou být během replikace začleněny do DNA (obrázek 3). Tyto základní analogy indukují mutace, protože často mají různá pravidla párování bází než báze, které nahrazují. Jiné chemické mutageny mohou modifikovat normální dna báze, což má za následek různá pravidla párování bází. Například kyselina dusná deaminuje cytosin a přeměňuje ji na uracil. Uracil se pak spáruje s adeninem v následném kole replikace, což vede k přeměně základního páru GC na dvojici AT., Kyselina dusná také deaminuje adenin na hypoxanthin, který se bází s cytosinem místo thyminu, což vede k přeměně páru TA báze na páru bází CG.

obrázek 3. Klikněte pro větší obrázek. (a) 2-aminopurine nukleosidovými (2AP) strukturálně je nukleosidový analog, aby adenin, nukleosidů, vzhledem k tomu, 5-bromouracil (5BU) je nukleosidový analog na thymin nukleosidů. 2AP základní páry s C, převedení at základního páru na GC základní pár po několika kolech replikace., 5BU páry s G, převod AT základní pár na GC základní pár po několika kolech replikace. (b) kyselina dusitá je jiný typ chemický mutagen, který upravuje již existující bází, nukleosidů, jako je C vyrábět U, která párů bází s. A. Tato chemická změna, jak je znázorněno zde, výsledky v konverzi CG párů bází na TA základní dvojici.
chemické mutageny známé jako interkalující činidla fungují odlišně., Tyto molekuly snímek mezi naskládané dusíkatých bází dvoušroubovice DNA, narušení molekuly a vytváří atypické odstupy mezi nukleotidových párů bází (Obrázek 4). Výsledkem je, že během replikace DNA může DNA polymeráza buď přeskočit replikaci několika nukleotidů (vytvoření delece), nebo vložit další nukleotidy (vytvoření vložení). Buď výsledek může vést k mutaci frameshift. Spalovací produkty, jako jsou polycyklické aromatické uhlovodíky jsou zvláště nebezpečné intercalating látky, které mohou vést k mutaci, způsobené nádory., Interkalující činidla ethidiumbromid a akridinový pomeranč se běžně používají v laboratoři k barvení DNA pro vizualizaci a jsou potenciálními mutageny.

obrázek 4. Intercalating agentů, jako jsou akridin, zavést atypické odstupy mezi párů bází, což vede k DNA polymeráza zavedení buď o smazání nebo vložení, což vede k potenciální posunovými mutacemi.
záření
vystavení ionizujícímu nebo neionizujícímu záření může každý vyvolat mutace v DNA, i když různými mechanismy., Silné ionizující záření, jako jsou rentgenové záření a gama paprsky, může způsobit jednovláknové a dvojvláknové přestávky v páteři DNA tvorbou hydroxylových radikálů při radiační expozici (obrázek 5). Ionizující záření může také modifikovat báze; například deaminace cytosinu na uracil, analogická působení kyseliny dusné. Ionizující záření se používá k zabíjení mikrobů ke sterilizaci zdravotnických prostředků a potravin, protože jeho dramatické nespecifický efekt na poškození DNA, proteinů a dalších buněčných komponent (viz Použití Fyzikální Metody pro Kontrolu Mikroorganismů).,
Neionizujícím záření, jako je ultrafialové světlo, není dost energický zahájit tyto typy chemické změny. Nicméně, neionizujícím záření může vyvolat tvorbu dimeru mezi dvou sousedních pyrimidinových bází, běžně dva thymines, v nukleotidové pramen. Během tvorby thyminového dimeru se dva sousední thyminy kovalentně spojují a pokud jsou ponechány neopravené, replikace DNA i transkripce jsou v tomto bodě zastaveny. DNA polymeráza může pokračovat a replikovat dimer nesprávně, což může vést k frameshift nebo bodové mutace.,

obrázek 5. (a) Ionizující záření může vést ke vzniku jednořetězcové a dvouřetězcové zlomy v cukr-fosfátové páteři DNA, stejně jako modifikace bází (není zobrazeno). (b) Neionizujícím záření, jako je ultrafialové světlo může vést k tvorbě dimerů thyminu, který může zastavit replikaci a transkripci a zavést posunovými nebo bodové mutace.
Přemýšlejte o tom
- jak základní analog zavádí mutaci?,
- jak interkalující látka zavádí mutaci?
- jaký typ mutagenu způsobuje tyminové dimery?
Oprava DNA
proces replikace DNA je vysoce přesný, ale chyby mohou nastat spontánně nebo mohou být vyvolány mutageny. Neopravené chyby mohou vést k vážným následkům fenotypu. Buňky vyvinuly několik opravných mechanismů, aby minimalizovaly počet mutací, které přetrvávají.,
korektura
většina chyb zavedených během replikace DNA je okamžitě opravena většinou DNA polymeráz pomocí funkce zvané korektura. Při korektuře čte DNA polymeráza nově přidanou základnu a zajišťuje, že se před přidáním dalšího doplňuje s odpovídající základnou v řetězci šablon. Pokud byla přidána nesprávná báze, enzym provede řez pro uvolnění nesprávného nukleotidu a přidá se nová báze.,
Oprava nesouladu
některé chyby zavedené během replikace jsou opraveny krátce po přesunutí replikačního zařízení. Tento mechanismus se nazývá Oprava nesouladu. Enzymy zapojené do tohoto mechanismu rozpoznávají nesprávně přidaný nukleotid, vylučují jej a nahrazují správným základem. Jedním z příkladů je oprava nesouladu v e.coli. DNA je hemimethylovaná. To znamená, že rodičovský pramen je methylován, zatímco nově syntetizovaný dceřiný pramen není. Trvá několik minut, než je nový pramen methylován., Proteiny Mutl, MutL a MutH se váží na hemimethylované místo, kde se nachází nesprávný nukleotid. MutH řeže nemethylovaný pramen (nový pramen). Exonukleáza odstraní část pramene (včetně nesprávného nukleotidu). Vzniklá mezera je pak vyplněna DNA pol III a ligázou.
Opravy Dimery Thyminu
Protože výroba dimery thyminu je běžné (mnoho organismů nemůže se zabránilo ultrafialové světlo), mechanismy se vyvinuly na opravu těchto lézí., Při opravě excize nukleotidů (nazývané také oprava tmy) enzymy odstraní pyrimidinový dimer a nahradí jej správnými nukleotidy (obrázek 6). U E. coli je DNA skenována enzymovým komplexem. Pokud je zkreslení v double helix je zjištěno, že byl představen pyrimidinových dimerů, enzym komplex řezy cukr-fosfát páteř několika základen proti proudu a po proudu dimer, a segmentu DNA mezi těmito dvěma kusy, je potom enzymaticky odstraněna. DNA pol i nahrazuje chybějící nukleotidy správnými a DNA ligáza utěsňuje mezeru v páteři cukru a fosfátu.,
přímá Oprava (nazývaná také oprava světla) tyminových dimerů probíhá procesem fotoreaktivace za přítomnosti viditelného světla. Enzym zvaný fotolyáza rozpoznává zkreslení ve spirále DNA způsobené thyminovým dimerem a váže se na dimer. Pak, v přítomnosti viditelného světla, photolyase enzymu změní konformaci a rozpadá na dimery thyminu, což umožňuje thymines, aby znovu správně základní pár s adenines na komplementární pramen., Fotoreaktivace se zdá být přítomna ve všech organismech, s výjimkou placentárních savců, včetně lidí. Photoreactivation je zvláště důležité pro organismy chronicky vystavena ultrafialovému záření, jako jsou rostliny, fotosyntetické bakterie, řasy a korály, aby se zabránilo hromadění mutací způsobené thymin dimer formace.

obrázek 6. Klikněte pro větší obrázek. Bakterie mají dva mechanismy pro opravu tyminových dimerů., (a) při opravě excize nukleotidů enzymový komplex rozpozná zkreslení komplexu DNA kolem thyminového dimeru a odřízne a odstraní poškozený řetězec DNA. Správné nukleotidy jsou nahrazeny DNA pol I a nukleotidový pramen je utěsněn dna ligázou. (b) V photoreactivation, enzym photolyase váže na dimer thyminu a, v přítomnosti viditelného světla, rozpadne dimer, obnovení základní párování thymines s doplňkovými adenines na protilehlé řetězce DNA.,
Přemýšlejte o tom
- během opravy nesouladu, jak enzym rozpozná, který je nový a který je starý pramen?
- jak interkalující látka zavádí mutaci?
- jaký typ mutace opravuje fotolyáza?
identifikace bakteriálních mutantů
jedna běžná technika používaná k identifikaci bakteriálních mutantů se nazývá replika pokovování., Tato technika se používá k detekci nutriční mutanty, tzv. auxotrophs, které mají mutaci v genu kódujícího enzym v biosyntéze cesta z konkrétní živiny, jako jsou aminokyseliny. V důsledku toho, zatímco buňky divokého typu si zachovávají schopnost normálně růst na médiu postrádajícím specifickou živinu, auxotrofy nejsou schopny růst na takovém médiu. Během replica plating (Obrázek 7), populace bakteriálních buněk je mutagenized a pak á jako jednotlivé buňky na komplexní nutričně kompletní talíř a nechá se vyrůst do kolonií., Buňky z těchto kolonií jsou odstraněny z této hlavní desky, často pomocí sterilního sametu. Tento samet, obsahující buňky, se pak lisuje ve stejné orientaci na desky různých médií. Alespoň jedna deska by měla být také nutričně kompletní, aby se zajistilo, že buňky jsou správně přenášeny mezi deskami. Ostatní desky postrádají specifické živiny, což výzkumníkovi umožňuje objevit různé auxotrofické mutanty neschopné produkovat specifické živiny. Buňky z odpovídající kolonie na nutričně kompletní desce mohou být použity k obnovení mutantu pro další studium.,

Obrázek 7. Identifikace auxotrofních mutantů, jako jsou histidin auxotrofy, se provádí pomocí repliky pokovování. Po mutageneze, kolonií, které rostou na nutričně kompletní médium, ale ne na střední chybí histidin jsou označeny jako histidin auxotrophs.
- Proč jsou buňky naneseny na nutričně kompletní talíř navíc k nezdravému desky při pohledu na mutant?,
Ames Test
Ames test, vyvinutý Bruce Ames (1928–), v 1970, je metoda, která využívá bakterie pro rychlé, levné promítání karcinogenní potenciál nových chemických sloučenin. Test měří míru mutace spojenou s expozicí sloučenině, což, pokud je zvýšená, může naznačovat, že expozice této sloučenině je spojena s větším rizikem rakoviny., Ames test využívá jako testovací organismus kmen Salmonella typhimurium, který je histidin auxotroph, nemůže syntetizovat své vlastní histidin, protože mutace v esenciálních genů potřebných pro jeho syntézu. Po vystavení potenciální mutagen, tyto bakterie jsou pozlacené na střední chybí histidin, a počet mutací získá schopnost syntetizovat histidin je zaznamenán a ve srovnání s počtem těchto mutanty, které vznikají v nepřítomnosti potenciálním mutagenem (Obrázek 8)., Chemikálie, které jsou mutagenní, přinesou v amesově testu více mutantů s obnovenou syntézou histidinu. Protože mnoho chemikálií není přímo mutagenní, ale je metabolizováno na mutagenní formy jaterními enzymy, extrakt z jaterních jater potkanů je běžně zahrnut na začátku tohoto experimentu, aby napodoboval metabolismus jater. Po Amesově testu se provádí, sloučeniny identifikovány jako mutagenní jsou dále testovány na jejich potenciální karcinogenní vlastnosti pomocí jiných modelů, včetně zvířecích modelů, jako jsou myši a krysy.
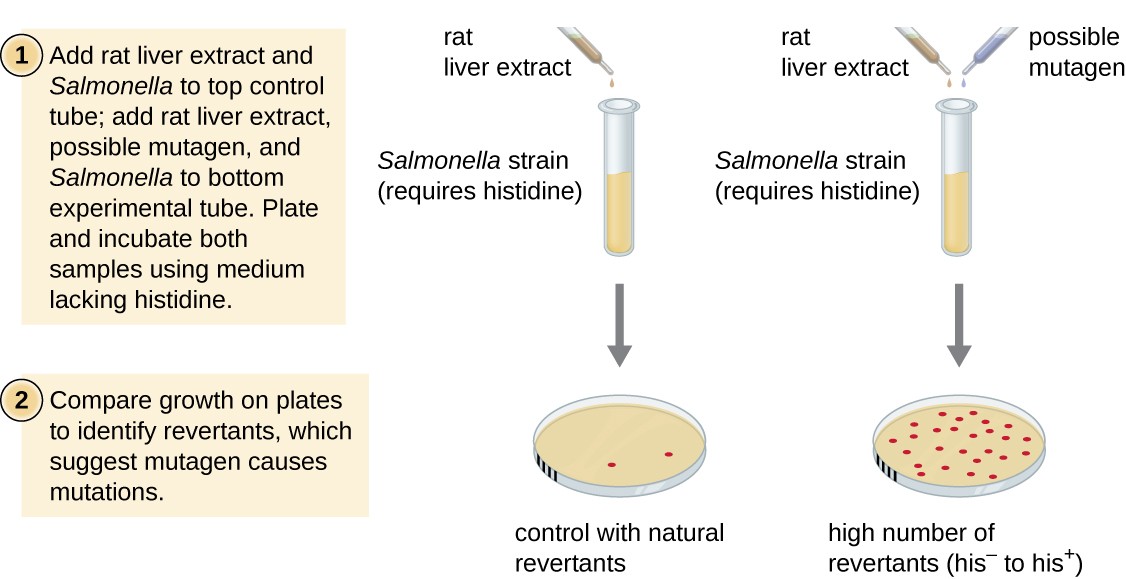
Obrázek 8., Amesův test se používá k identifikaci mutagenních, potenciálně karcinogenních chemikálií. Jako testovací kmen se používá auxotroph Salmonella histidin, vystavený potenciálnímu mutagenu / karcinogenu. Počet reverzních mutantů schopných růst v nepřítomnosti dodaného histidinu se počítá a porovnává se s počtem přirozených reverzních mutantů, které vznikají v nepřítomnosti potenciálního mutagenu.
- Jaké mutace se používá jako indikátor rychlost mutace v Amesově testu?
- proč může test Ames fungovat jako test karcinogenity?,
klíčové pojmy a souhrn
- mutace je dědičná změna DNA. Mutace může vést ke změně aminokyselinové sekvence proteinu, což může ovlivnit jeho funkci.
- bodová mutace ovlivňuje jeden základní pár. Bodová mutace může způsobit, že tichá mutace-li mRNA kodonu kódy pro stejnou aminokyselinu, missense mutace, pokud mRNA kodon kóduje jinou aminokyselinu, nebo nesmyslné mutace-li mRNA kodonu stává stop kodonu.,
- Missense mutace mohou zachovat funkci, v závislosti na chemii nové aminokyseliny a její umístění v proteinu. Nesmyslné mutace produkují zkrácené a často nefunkční proteiny.
- mutace frameshift je výsledkem vložení nebo delece řady nukleotidů, které nejsou násobkem tří. Změna čtecího rámce mění každou aminokyselinu po bodu mutace a vede k nefunkčnímu proteinu.
- spontánní mutace se vyskytují prostřednictvím chyb replikace DNA, zatímco indukované mutace se vyskytují vystavením mutagenu.,
- mutagenní látky jsou často karcinogenní, ale ne vždy. Téměř všechny karcinogeny jsou však mutagenní.
- chemické mutageny zahrnují základní analogy a chemikálie, které modifikují stávající báze. V obou případech jsou mutace zavedeny po několika kolech replikace DNA.
- ionizující záření, jako jsou rentgenové záření a γ-paprsky, vede k rozbití fosfodiesterové páteře DNA a může také chemicky modifikovat báze, aby změnila pravidla párování bází.,
- Neionizujícím záření, jako je ultrafialové světlo může zavést pyrimidinu (thymin) dimery, které jsou během replikace DNA a transkripce, může zavést posunovými nebo bodové mutace.
- buňky mají mechanismy k opravě přirozeně se vyskytujících mutací. DNA polymeráza má korekturační aktivitu. Oprava nesouladu je proces opravy nesprávně začleněných bází po dokončení replikace DNA.
- pyrimidinové dimery lze také opravit., V nukleotidové excizní opravy (tmavě opravy), enzymy rozpoznat narušení zavedené pyrimidinových dimerů a nahradit poškozený pramen se správnou bází, pomocí nepoškozené DNA jako šablonu. Bakterie a jiné organismy mohou také použít přímou opravu,při které enzym fotolyázy v přítomnosti viditelného světla odděluje pyrimidiny.
- porovnáním růstu na kompletní desce a nedostatečného růstu na médiích, které postrádají specifické živiny, lze identifikovat specifické mutanty se ztrátou funkce zvané auxotrofy.,
- amesův test je levná metoda, která používá auxotrofické bakterie k měření mutagenity chemické sloučeniny. Mutagenita je ukazatelem karcinogenního potenciálu.
Multiple Choice
která z následujících možností je změna sekvence, která vede k vytvoření stop kodonu?
- missense mutace
- nesmysl mutace
- silent mutace
- smazání mutace
tvorba pyrimidinových dimerů vyplývá z následujících výsledků?
- spontánní chyby v DNA polymeráza
- ozáření gama zářením
- vystavení ultrafialovému záření
- vystavení intercalating agenti
který z následujících je příkladem mutace frameshift?
- vymazání kodon
- missense mutace
- silent mutace
- smazání jednoho nukleotidu
Který z následujících typu opravy DNA, ve které dimery thyminu jsou přímo v členění podle enzymu photolyase?,
- přímé opravy
- nukleotidové excizní opravy
- nesoulad opravy
- korektury
který z následujících údajů týkajících se testu Ames je pravdivý?
- používá se k identifikaci nově vzniklých auxotrofních mutantů.
- používá se k identifikaci mutantů s obnovenou biosyntetickou aktivitou.
- používá se k identifikaci spontánních mutantů.,
- používá se k identifikaci mutantů bez fotoreaktivační aktivity.
Vyplnit Prázdné
chemický mutagen, který je strukturálně podobný nukleotidů, ale má různé párování bází pravidel se nazývá ________.,
enzym používaný při opravě světla k rozdělení thyminových dimerů se nazývá ________.
fenotyp organismu, který je nejčastěji pozorován v přírodě, se nazývá ________.,
True/False
karcinogeny jsou typicky mutagenní.
Proč je více pravděpodobné, že inserce nebo delece bude více škodlivé pro buňky než bodové mutace?,
proč si myslíte, že test Ames je vhodnější než použití zvířecích modelů k screeningu chemických sloučenin pro mutagenitu?
kritické myšlení
níže je několik sekvencí DNA, které jsou mutovány ve srovnání se sekvencí divokého typu: 3′-T A C T G A C T G A C G A T C-5′. Představte si, že každý z nich je část molekuly DNA, která se oddělila v rámci přípravy na transkripci, takže vidíte pouze vlákno šablony., Vytvořit komplementární DNA sekvence (ukazuje na 5′ a 3′ konce) pro každý mutované sekvence DNA, pak přepsat (s uvedením 5′ a 3′ konce) šablony pramenů, a přeložit mRNA molekul pomocí genetického kódu, záznam výsledné sekvence aminokyselin (s uvedením N a C termini). Jaký typ mutace je každý?,>
Komplementární DNA sekvence:
mRNA sekvence přepisována ze šablony:
aminokyselinové sekvence peptidu:
Typ mutace:
Komplementární DNA sekvence:
mRNA sekvence přepisována ze šablony:
aminokyselinové sekvence peptidu:
Typ mutace: