V předchozím příspěvku jsme představili ortho- ,para – a meta – ředitelé v elektrofilní aromatické substituce. Předtím jsme se zabývali mechanismem elektrofilní aromatické substituce a ukázali jsme, že mechanismus probíhá přes karbokační meziprodukt.,
Dnes, budeme uvázat tyto dva pojmy dohromady, a snaží se ukázat, že to, zda substituent je ortho-, a para – nebo meta – ředitel závisí na tom, jak substituent ovlivňuje stabilitu karbokation intermediate.
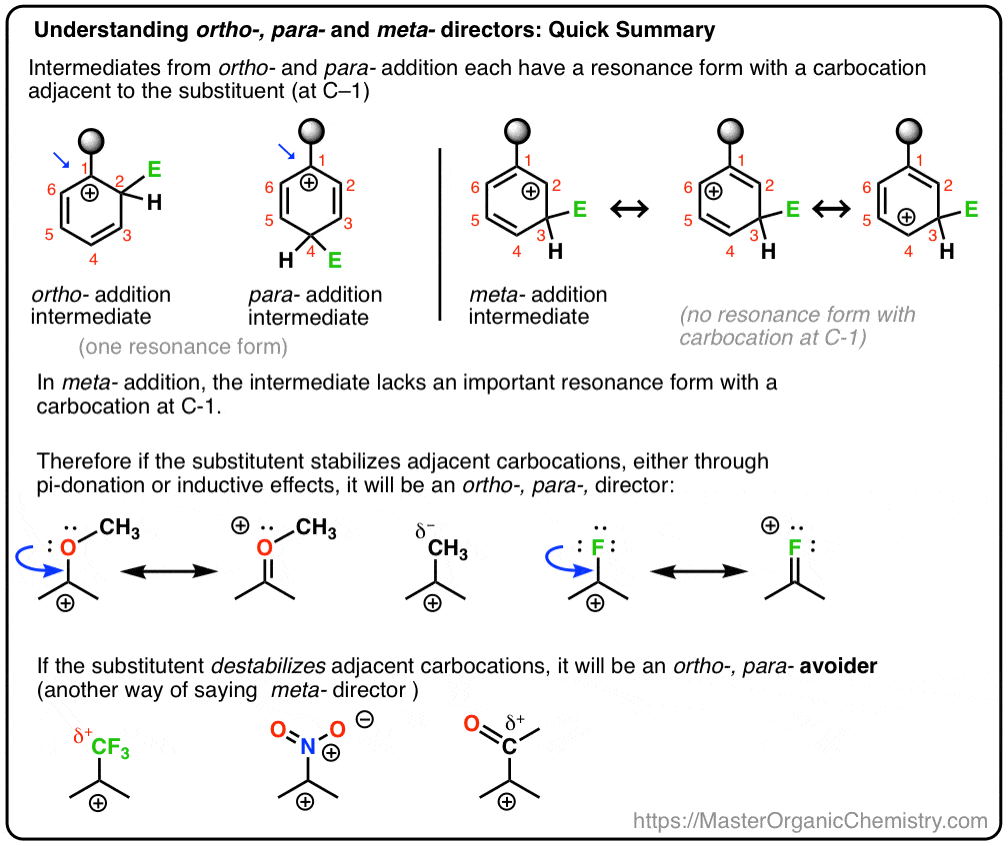
a také uvidíme, proč by Alternativní název pro meta-director mohl být „Orto -, para-avoider“. : – )
Obsah
- Carbocations Jsou Stabilizovány Tím, že Sousední Atomy S Osamělé Páry
- Případová Studie #1: ortho-,a para – Ředitel (OCH3)
- Ano, Kyslík Je Elektronegativní., Ale Darování Jeho Osamělého Páru Víc, Než To Vynahradí!
- diagram reakce a energie pro případovou studii Orto Para
- #2: meta-director (CF3).
- to, čemu říkáme „meta-ředitelé“, jsou spíše jako“Orto -, para– Avoiders“
- schéma reakční energie pro Meta – Director
- tak proč jsou halogeny Orto -, Para – Directors?
- poznámky
- Kvíz sami!,
- (Pokročilé) Odkazy a Další Čtení
Carbocations Jsou Stabilizovány Tím, že Sousední Atomy S Osamělé Páry
řekněme, že zpátky do které faktory zvyšují stabilitu carbocations.
karbokace jsou elektronově chudé druhy se šesti elektrony v jejich valenční skořápce. Takže jakýkoli substituent, který může darovat elektronovou hustotu směrem k karbokaci, se stabilizuje. To zahrnuje:
- substituenty uvolňující elektrony, které mohou působit jako “ sigma-dárci „(např., mnoho alkyl skupin, které darovat elektronové hustoty prostřednictvím indukční účinky )
- sousední atomy s osamělé páry, které mohou působit jako „pi dárců“ na karbokation
- přilehlých C–C pi dluhopisů, které mohou stabilizovat karbokation prostřednictvím poplatek přemístění výroby („rezonanční stabilizace“, jinými slovy).
a faktory, které destabilizují karbokace?
- jakýkoli substituent, který odstraňuje elektronovou hustotu z karbokace, jako jsou silné skupiny odebírající elektron.
takže tady je rychlý kvíz., Vzhledem k výše uvedenému všemu, která ze dvou níže uvedených karbokací bude stabilnější?
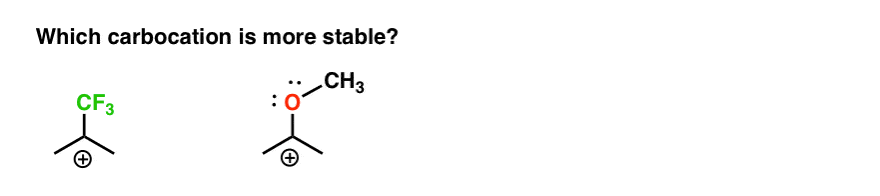
Pokud na tuto otázku můžete dobře odpovědět, jste většinou cestou k pochopení rozdílu mezi Orto-, para – a meta – řediteli.
podívejme se na dvě případové studie. Podíváme se na generickou elektrofilní aromatickou substituční reakci benzenu s ortho -, para-režisérem (methoxybenzenem) a prozkoumáme meziprodukty, které jsou získány útokem na pozicích Orto, meta a para., Pak provedeme stejné cvičení s meta-režisérem (trifluormethylbenzen).
v tomto procesu doufáme, že pochopíme, proč methoxybenzen upřednostňuje ortho– a para-produkty, zatímco trifluormethylbenzen upřednostňuje meta-produkt.
Případová studie #1: ortho -, para-Director (OCH3)
elektrofilní aromatická substituce methoxybenzenu má tendenci dávat Orto – a para – produkty s velmi malým meta- ., Tady je to, co se děje v nitridace, například:
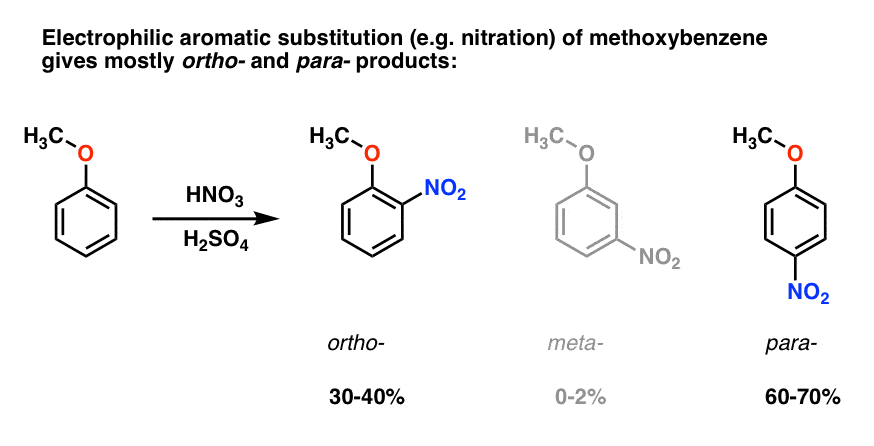
para – produktu dominuje (60-70%), s ortho – blízko za sebou (30-40%) a jen stopy meta– .
proč?
3. Ano, Kyslík Je Elektronegativní. Ale Darování Jeho Osamělého Páru Víc, Než To Vynahradí!
zde je cesta vedoucí k Orto-produktu., Jsme zlomit C–C pi pouto a vytvořit nový C–E dluhopisů (kde E je určen k představují obecný elektrofilem), generování rezonance-stabilizovaný karbokation,
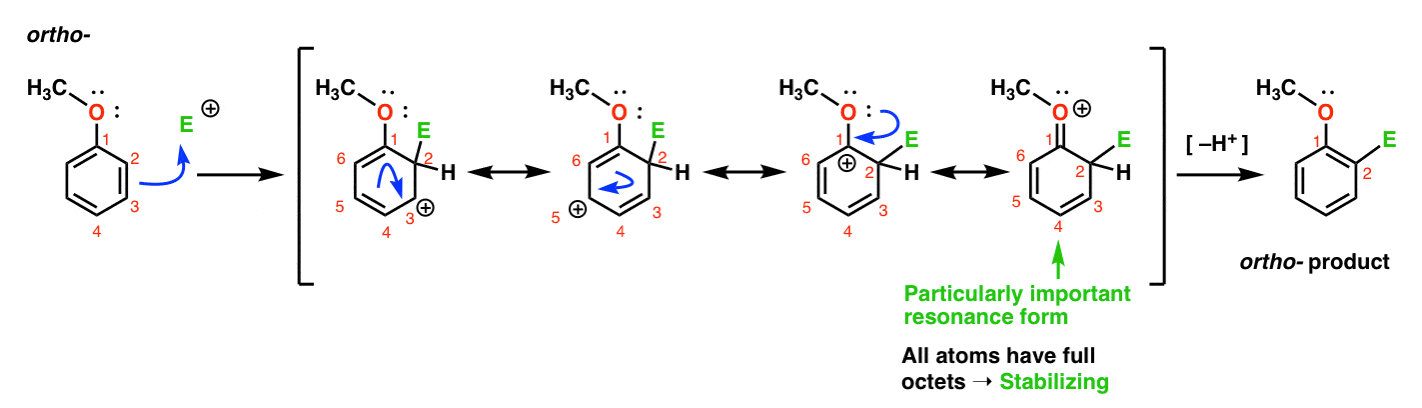
podíváte-Li se pozorně, měli byste si uvědomit, že můžeme tvořit čtyři rezonanční formy . Tři z nich nesou plné karbokace (na C1, C3 a C5), ale je to čtvrtá – rezonanční Forma, kde je vazba C=O pi – což je zvláště důležité. Proč? V této rezonanční formě mají všechny atomy uhlíku plný oktet elektronů., To proto, že kyslík přímo vázané na prsten můžete darovat osamělý pár přilehlých karbokation, které tvoří pi vazbu. Toto je příklad daru pi.
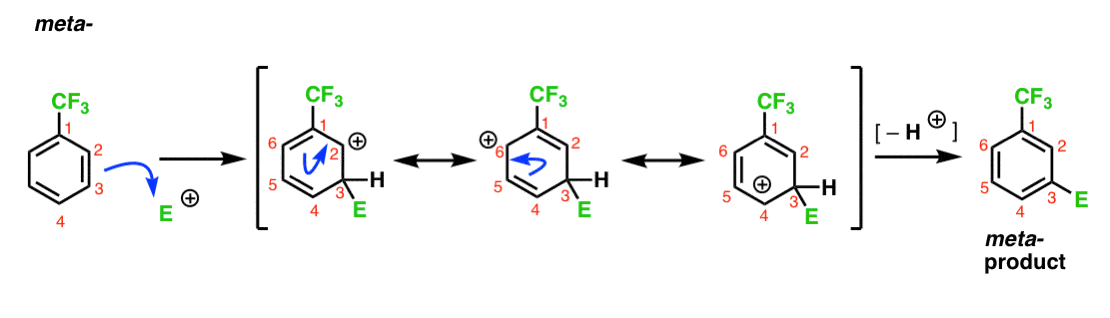
zde je cesta k útoku elektrofilu v meta-poloze. Všimněte si rozdílu!
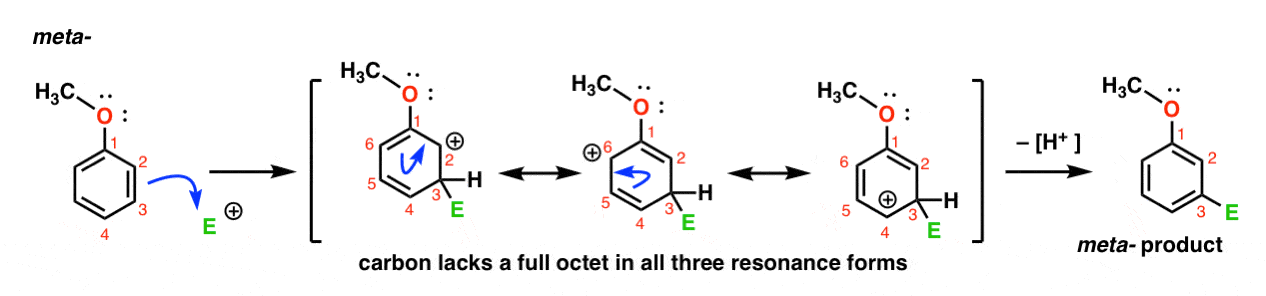
Útok elektrofilem na C-3 výsledky v karbokation, který může být delokalizována přes rezonance C2, C4 a C6. Neexistuje však způsob, jak „přesunout“ karbokaci na C1, což znamená, že neexistuje rozumná rezonanční Forma, kde všechny atomy mají plné oktety.,
To je meta – karbokation intermediate mnohem méně stabilní než ortho – karbokation intermediate.
a Konečně, tady je reakce vedoucí k para – produkt:
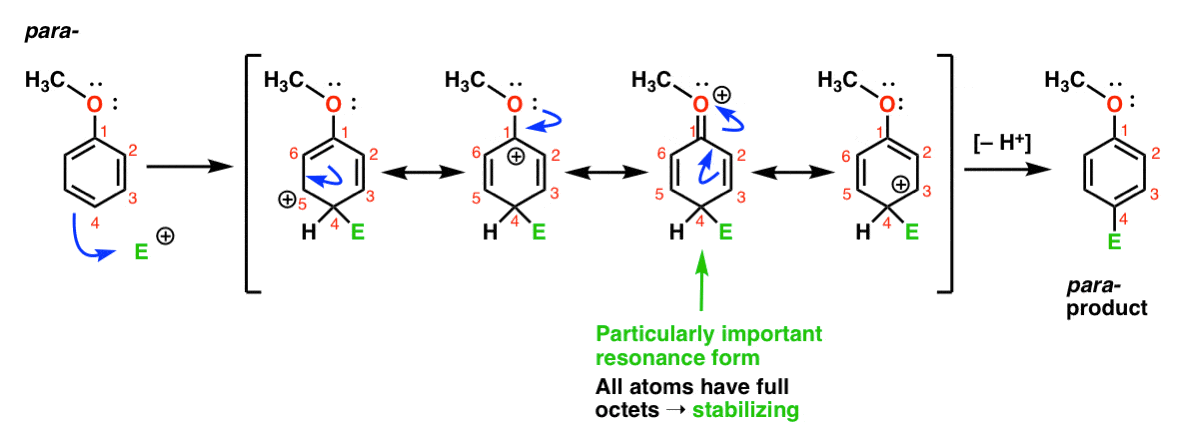
Zde můžeme opět čerpat rezonance formy s carbocations na C1, C3 a C5, stejně jako čtvrtá rezonance podobě, kde je připojen atom kyslíku daruje elektron pair na karbokation na C1, což v plné octet na uhlíku. To je situace v podstatě stejná jako ortho-intermediate.,
takže analýzou rezonančních forem (a označte mé slovo, můžete být požádáni, abyste v blízké budoucnosti udělali totéž na testu) vidíme, že mezilehlé karbokace vyplývající z Orto – a para– sčítání jsou podstatně stabilnější než meziprodukt z meta– sčítání.
to vysvětluje, proč dominují Orto – a para – produkty a meta-produkt je menší.
může být užitečné si to představit nakreslením diagramu reakční energie.
4., Schéma reakce a energie pro Ortho Para Director
přechodový stav vedoucí k produktům Orto – a para – sčítání je mnohem nižší než energie meta -.
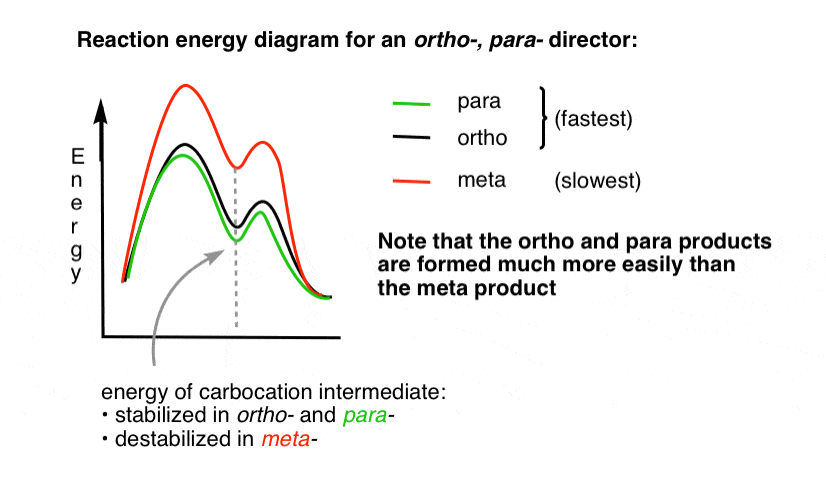
Jedna otázka – proč si myslíte, že para – by mohla být upřednostňována (např. 60%-70% výnos pro para– produkt nitridace, výše, oproti 30-40% pro ortho-) i když tam jsou dva ortho – polohách a pouze jeden para- ?
Přemýšlejte o tom na minutu a my to vyřešíme níže.
5. Případová studie č. 2: meta-ředitel (CF3).
takže co CF3?, Proč dává meta-produkty? Udělejme stejný typ analýzy.
zde je cesta vedoucí k Orto-produktu. Stejně jako u výše uvedeného ortho – intermediátu můžeme nakreslit tři rezonanční formy, které umístí karbokaci na C1, C3 a C5.
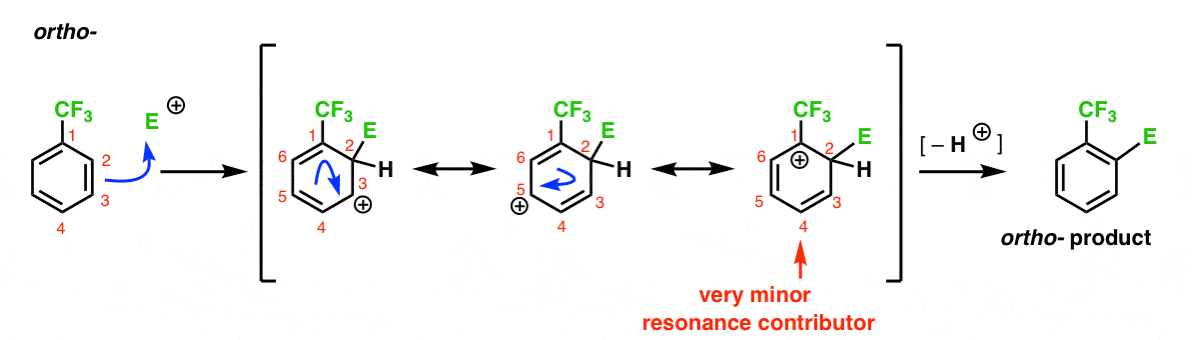
takže co se v tomto případě liší?
to, co se liší, je přítomnost silné skupiny pro odběr elektronů (CF3) na C1, což zcela mění míčovou hru.
jak jsme již řekli, karbokace jsou destabilizovány sousedy, kteří odebírají elektronovou hustotu., Proto bychom očekávali, že to bude velmi malý rezonanční přispěvatel, s výsledkem, že kladný náboj je delokalizován pouze nad C3 a C5.
poznamenali jsme, že CF3 je meta-ředitel. Je rozumné si myslet, že na metě je něco– to je zvláště stabilní. Analýzou meziproduktu pro meta– produkt níže vidíte proč?
Hmmm. Neexistuje žádný meziprodukt, kde uhlík má plný oktet. Neexistují žádné zvláště stabilní rezonanční formy.
je to trochu „meh“, že?
6., To, čemu říkáme „meta– ředitelé“, je spíše jako „Orto -, para– Avoiders“
Na druhé straně neexistují žádné zvláště nestabilní rezonanční formy. Protože kladný náboj je lokalizován na C2, C4 a C6, situaci, kdy kladný náboj je přímo sousedí s elektron-odnímání CF3 skupiny je třeba se vyhnout. A kladný náboj je tak pěkně delokalizován v celém kruhu, na rozdíl od výše uvedené ortho situace.
takže je to“ méně špatný “ meziprodukt než ortho -.,
nakonec má para-intermediate stejný problém jako Orto- ; meziprodukt s kladným nábojem na C1, přiléhající k CF3.
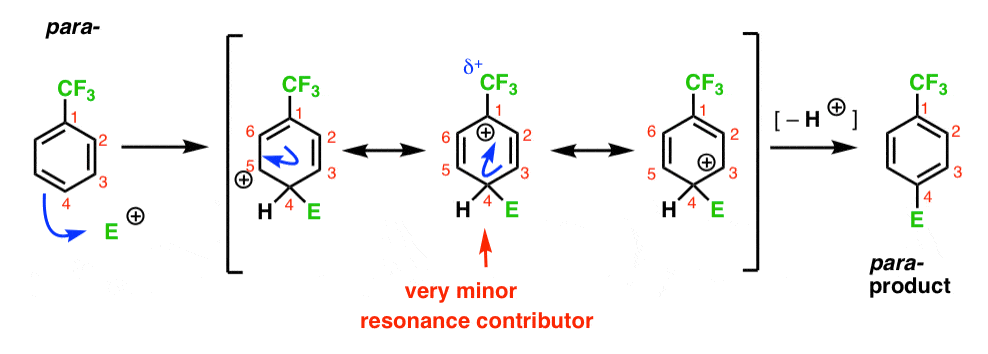
To má za následek pouze dvě důležité rezonance forem, což vede k méně delokalizována (a tedy méně stabilní) karbokation intermediate.
Sečteno a podtrženo: meziprodukt meta-karbokace je stabilnější než ortho– nebo para-meziprodukty.
ale není to proto, že substituent sám má nějaký stabilizační účinek na Meta-meziprodukt. .,
řekl bych, že je užitečnější myslet na meta – jako méně nestabilní než ortho– a para -.
tímto způsobem není tolik, že CF3 je meta-ředitel, natolik, že je to “ ortho -, para-avoider. „
7. Schéma reakční energie pro Meta-Director
zde je náčrt diagramu reakční energie:
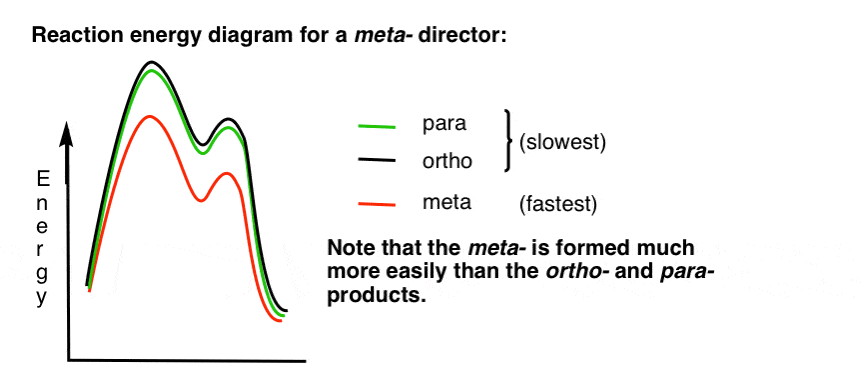
v pořádku.
zpět na naši původní otázku. Která karbokace je tedy stabilnější?,
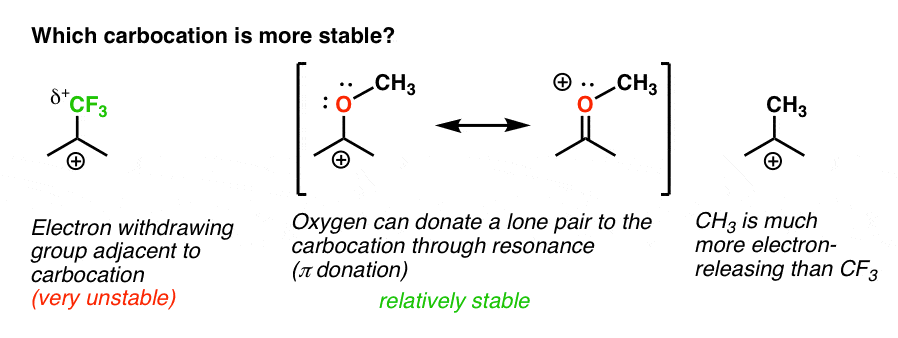
Jasně, karbokation s přilehlým kyslíku nesoucí osamělý pár je daleko více stabilní než karbokation přiléhající k elektron-zrušení skupiny jako CF3.
a to zahrnuje rozdíl mezi ortho -, para-režisérem jako OCH3 a meta-režisérem jako CF3.
stojí za zmínku, že většina alkylových skupin (například CH3 ) postrádá osamělý pár, ale stále jsou Orto-, para – ředitelé., To je konzistentní se vším, co jsme se naučili předtím, než o tom, jak alkylové skupiny jsou obvykle stabilizaci pro carbocations – připomeňme, že karbokation stabilitě se obecně zvyšuje s substituce
Tak o těch para– produkty…
Proč jsou para – výrobky vyráběné ve větší míře než ortho- ?
odpověď je sterická překážka.
útok na para pozici je méně zatížen substituentem než útok na ortho-pozice jsou.
tak proč jsou halogeny Orto -, Para-ředitelé?
to nám ponechává poněkud ošemetný příklad halogenů.,
proč jsou fluor, chlor, brom a jód Orto-, para – ředitelé, i když deaktivují skupiny?
odpověď by neměla být překvapením, pokud jste sledovali, ale necháme to až do dalšího příspěvku, protože tento je již dostatečně dlouhý.
Další příspěvek: proč jsou halogeny Orto -, para-ředitelé?
poznámky
Poznámka 1. Je správnější říci, že dominují Orto – a para-produkty, protože přechodové stavy vedoucí k těmto produktům mají nižší energii než energie samotných meziproduktů., Koneckonců je to energie přechodových stavů, která určuje aktivační bariéru, a tedy reakční rychlost.
Poznámka 2. Nebo hyperkonjugace, které se většina učebnic (s pozoruhodnou výjimkou Maitland Jones) obecně vyhýbá.
Kvíz sami!,/div>
 Klikněte na Flip
Klikněte na Flip

 Klikněte na Flip
Klikněte na Flip 
 Klikněte na Flip
Klikněte na Flip 
 Klikněte na Flip
Klikněte na Flip 
(Pokročilé) Odkazy a Další Čtení
- A., F. Holleman, Die direkte Einführung von Substituenten in den Benzolkern
Rec. Trave. Chime. Pays-Bas 1910, 12, 455-456
DOI: 10.1002/recl.19100291205
A. F Holleman z roku 1910 uvedl, že Orto–para orientace je spojena s aktivací a meta orientací s deaktivací. - – povaha střídavého účinku v uhlíkových řetězcích. Část XXIII. Anomální orientace halogeny, a jeho vliv na problém z ortho–para poměr, v aromatické substituce.
Christopher Kelk Ingold a Karel Cyril Norrey Vass
J. Chem. SOC. 1928, 417-425
DOI: 10.,1039 / JR9280000417
tento článek popisuje režijní efekty v 1,2-dihalobenzenes. - Některá pozorování týkající se stérické překážky a vlivy substituentů v ortho : para poměr v aromatické substituce.
P. B. D. de la Mare
J. Chem. SOC. 1949, 2871-2874
DOI: 10.1039/JR9490002871
V této knize, de la Mare popisuje různé faktory, které mohou účet za převahou para nad ortho selektivita, po rozdělení výnosu z ortho produktu o 2 (protože tam jsou 2 ortho pozicích, ale pouze 1 para pozici v primární deriváty benzenu)., - objemové účinky alkylových skupin v aromatických sloučeninách. Část v. monosulfonace P-cymene
R. J. W. Le Fèvre
J. Chem. SOC. 1934, 1501-1502
DOI: 10.1039/JR9340001501
V p-cymen, hlavní výrobek získaný při elektrofilní sulfonace je 2-produkt (ortho pro methylovou skupinu), pravděpodobně v důsledku sterics. - Efekty Alkylových Skupin v Elektrofilní Dodatky a Substituce
COHN, H. HUGHES, E., JONES, M. a PEELING, M. G.
Příroda 1952, 169, 291
DOI: 1038/169291a0
Tento dokument obsahuje data, porovnání nitridace t-butylbenzene a toluen., T-butylbenzene je mnohem více p-režie než toluen (79.5% para pro t-butylbenzene vs. 40% para pro toluen), což je pravděpodobně způsobeno sterics (ortho přístup je blokován objemnější t-butylová skupina). - distribuce izomerů v Mononitraci Ethyl-a Isopropylbenzenu. Další Důkazy pro Stérické Efekt v Izomer Distribuce
Herbert C. Browna a W. Hallam Bonner
Journal of the American Chemical Society 1954, 76 (2), 605-606
DOI: 10.,1021/ja01631a084
Tabulka II, v této knize ukazuje, že ortho výrobek získaný z nitridace z monoalkylbenzenes klesá alkylové skupiny, čím je větší (např. t-butylbenzene výnosy velmi trochu ortho produktu při nitraci oproti toluenu). - – povaha střídavého účinku v uhlíkových řetězcích. Část XXII. Pokus dále definovat pravděpodobný mechanismus orientace v aromatické substituce.
Christopher Kelk Ingold a Florencie Ruth Shaw
J. Chem. SOC. 1927, 2918-2926
DOI: 10.,1039/JR9270002918
rané papíru vlivný Fyzikální Chemik, Profesor C. K. Ingold, s tím, že halogenobenzenes jsou indukčně elektron-odnímání ale současně rezonance-stabilizuje. - anomální reaktivita Fluorbenzenu v elektrofilní aromatické substituci a souvisejících jevech
Joel Rosenthal a David I., Schuster
Journal of Chemical Education 2003, 80 (6), 679
DOI: 1021/ed080p679
velmi zajímavá kniha, vhodná pro zvídavé školáky, a popisuje něco, co většina procvičování organických chemiků bude vědět, empiricky – fluorobenzene je téměř stejně reaktivní jako je benzen v EAS nebo Friedel-Crafts reakce, které je neintuitivní, když jeden se domnívá, elektronické efekty! - organická chemie
n. Haworth, C. K. Ingold, T. A. Henry
Ann. Rep. Prog. Chem. 1926, 23, 74-185
DOI: 10.1039/AR9262300074
rané papíru diskutovat režie účinky v EAS. Pp., 136 a 137 obsahují údaje, které zobrazují tok elektronů. Pg. 140 pojednává o meta-směru, který se vyskytuje z „opačných“ důvodů jako o/p-směr alkylovými skupinami.