jak prvky vzájemně interagují, závisí na tom, jak jsou jejich elektrony uspořádány a kolik otvorů pro elektrony existuje v nejvzdálenější oblasti, kde jsou elektrony přítomny v atomu. Elektrony existují na energetických úrovních, které tvoří skořápky kolem jádra. Nejbližší skořápka může pojmout až dva elektrony. Nejbližší skořápka k jádru je vždy vyplněna jako první, než může být vyplněna jakákoli jiná skořápka. Vodík má jeden elektron; proto má pouze jedno místo obsazené v nejnižším plášti., Helium má dva elektrony; proto může zcela naplnit nejnižší skořápku svými dvěma elektrony. Pokud se podíváte na periodickou tabulku, uvidíte, že vodík a helium jsou jedinými dvěma prvky v první řadě. Je to proto, že mají pouze elektrony ve své první skořápce. Vodík a helium jsou jediné dva prvky, které mají nejnižší skořápku a žádné jiné skořápky.
druhá a třetí energetická hladina může pojmout až osm elektronů. Osm elektronů je uspořádáno ve čtyřech párech a jedna pozice v každém páru je naplněna elektronem před dokončením všech párů.,
při opětovném pohledu na periodickou tabulku (obrázek 1) si všimnete, že existuje sedm řádků. Tyto řádky odpovídají počtu skořápek, které mají prvky v tomto řádku. Prvky v určitém řádku mají rostoucí počet elektronů, protože sloupce postupují zleva doprava. Ačkoli každý prvek má stejný počet skořápek, ne všechny skořápky jsou zcela naplněny elektrony. Pokud se podíváte na druhou řadu periodické tabulky, najdete lithium (Li), beryllium (Be), Bor (B), uhlík (C), dusík (N), kyslík (o), fluor (F) a neon (Ne)., Všechny mají elektrony, které zabírají pouze první a druhou skořápku. Lithium má pouze jeden elektron ve své vnější slupce, berylium má dva elektrony, bor má tři, a tak dále, dokud celý plášť je vyplněn s osmi elektrony, jako je tomu v případě neon.
ne všechny prvky mají dostatek elektronů k vyplnění svých nejvzdálenějších skořápek, ale atom je nejstabilnější, když jsou vyplněny všechny polohy elektronů v nejvzdálenějším plášti., Protože z těchto volných pracovních míst v nejvzdálenějších skořápky, vidíme vznik chemické vazby, nebo interakce mezi dvěma nebo více stejných nebo různých prvků, které vedou k tvorbě molekul. Pro dosažení větší stability, atomy, bude mít tendenci zcela naplnit jejich vnější skořápky a se váže s jinými prvky k dosažení tohoto cíle prostřednictvím sdílení elektronů, přijetím elektronů od druhého atomu, nebo darovat elektrony jinému atomu., Protože nejvzdálenější skořápky prvků s nízkými atomovými čísly (až do vápníku, s atomovým číslem 20) mohou pojmout osm elektronů, označuje se to jako oktetové pravidlo. Prvek může darovat, přijímat nebo sdílet elektrony s jinými prvky, aby naplnil svůj vnější plášť a splnil pravidlo oktetu.
když atom neobsahuje stejný počet protonů a elektronů, nazývá se iont. Protože počet elektronů se nerovná počtu protonů, každý iont má čistý náboj. Pozitivní ionty jsou tvořeny ztrátou elektronů a nazývají se kationty., Záporné ionty jsou tvořeny získáním elektronů a nazývají se anionty.
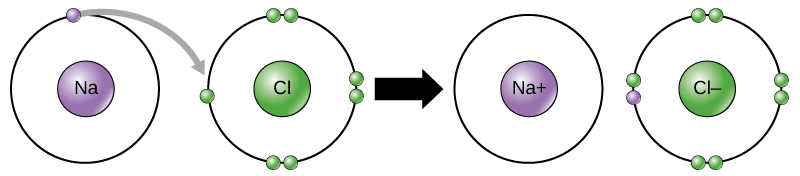
například sodík má ve svém nejvzdálenějším plášti pouze jeden elektron. To trvá méně energie pro sodík darovat, že jeden elektron, než to přijmout sedm více elektronů vyplnit vnějšího pláště. Pokud sodík ztratí elektron, má nyní 11 protonů a pouze 10 elektronů, takže má celkový náboj +1. Nyní se nazývá iont sodíku.
atom chloru má ve svém vnějším plášti sedm elektronů. Opět je energeticky účinnější, aby chlor získal jeden elektron, než aby ztratil sedm., Proto má tendenci získat elektron k vytvoření iontu se 17 protony a 18 elektrony, což mu dává čistý negativní (-1) náboj. Nyní se nazývá chloridový iont. Tento pohyb elektronů z jednoho prvku do druhého se označuje jako přenos elektronů. Jak ukazuje obrázek 1, atom sodíku (Na) má ve svém nejvzdálenějším plášti pouze jeden elektron, zatímco atom chloru (Cl) má ve svém nejvzdálenějším plášti sedm elektronů. Atom sodíku daruje svůj jeden elektron k vyprázdnění skořápky a atom chloru přijme tento elektron, aby naplnil svůj obal a stal se chloridem., Oba ionty NYNÍ splňují pravidlo oktetu a mají úplné nejvzdálenější skořápky. Protože počet elektronů již není roven počtu protonů, každý je nyní iontem a má náboj + 1 (sodík) nebo -1 (chlorid).

Iontové Vazby
k Dispozici jsou čtyři typy dluhopisů nebo interakce: iontové, kovalentní, vodíkové vazby a van der Waalsovy interakce. Iontové a kovalentní vazby jsou silné interakce, které vyžadují větší energetický vstup, aby se rozpadly. Když prvek daruje elektron ze svého vnějšího pláště, jako ve výše uvedeném příkladu atomu sodíku, vytvoří se pozitivní iont (Obrázek 2). Prvek přijímající elektron je nyní záporně nabitý., Protože kladné a záporné náboje přitahují, tyto ionty zůstávají spolu a tvoří iontovou vazbu nebo vazbu mezi ionty. Prvky se spojují s elektronem z jednoho prvku, který zůstává převážně s druhým prvkem. Když se na + a CL-ionty kombinují a produkují NaCl, elektron z atomu sodíku zůstává s ostatními sedmi z atomu chloru a ionty sodíku a chloridu se navzájem přitahují v mřížce iontů s čistým nulovým nábojem.,
Kovalentní Vazby
Další typ silné chemické vazby mezi dvěma nebo více atomy je kovalentní vazba. Tyto vazby se tvoří, když je elektron sdílen mezi dvěma prvky a jsou nejsilnější a nejběžnější formou chemické vazby v živých organismech. Kovalentní vazby se tvoří mezi prvky, které tvoří biologické molekuly v našich buňkách., Na rozdíl od iontových vazeb se kovalentní vazby nerozdělují ve vodě.
zajímavé je, že chemici a biologové měří pevnost vazby různými způsoby. Chemici měří absolutní sílu pouto (teoretická síla), zatímco biologové jsou více zajímají o to, jak se bond chová v biologickém systému, který je obvykle vodné (water-based). Ve vodě se iontové vazby rozpadají mnohem snadněji než kovalentní vazby, takže biologové by řekli, že jsou slabší než kovalentní vazby. Když se podíváte do učebnice chemie, uvidíte něco jiného., To je skvělý příklad toho, jak stejné informace mohou vést k různým odpovědím v závislosti na perspektivě, ze které je prohlížíte.
atomy vodíku a kyslíku, které se kombinují za vzniku molekul vody, jsou spojeny kovalentními vazbami. Elektron z atomu vodíku rozděluje svůj čas mezi vnější plášť atomu vodíku a neúplný vnější plášť atomu kyslíku. K úplnému vyplnění vnějšího pláště atomu kyslíku jsou zapotřebí dva elektrony ze dvou atomů vodíku, tedy Index „2“ v H2O., Elektrony jsou sdíleny mezi atomy a dělí jejich čas mezi nimi, aby „vyplnily“ vnější plášť každého z nich. Toto sdílení je nižší energetický stav pro všechny zapojené atomy, než kdyby existovaly, aniž by byly naplněny jejich vnější skořápky.
existují dva typy kovalentních vazeb: polární a nepolární. Nepolární kovalentní vazby se tvoří mezi dvěma atomy stejného prvku nebo mezi různými prvky, které sdílejí elektrony rovnoměrně. Například atom kyslíku se může spojit s jiným atomem kyslíku, aby naplnil své vnější skořápky., Tato asociace je nepolární, protože elektrony budou rovnoměrně rozděleny mezi každý atom kyslíku. Mezi těmito dvěma atomy kyslíku se tvoří dvě kovalentní vazby, protože kyslík vyžaduje dva sdílené elektrony k vyplnění jeho nejvzdálenějšího pláště. Atomy dusíku budou tvořit tři kovalentní vazby (také nazýván triple kovalentní) mezi dvěma atomy dusíku, protože každý atom dusíku potřebuje tři elektrony naplnit své nejvzdálenější vrstvě. Další příklad nepolární kovalentní vazby se nachází v molekule metanu (CH4). Atom uhlíku má ve svém nejvzdálenějším plášti čtyři elektrony a potřebuje další čtyři, aby ho naplnil., Získává tyto čtyři ze čtyř atomů vodíku, každý atom poskytuje jeden. Všechny tyto prvky sdílejí elektrony rovnoměrně a vytvářejí čtyři nepolární kovalentní vazby (obrázek 3).
v polární kovalentní vazbě tráví elektrony sdílené atomy více času blíže k jednomu jádru než k druhému jádru. Vzhledem k nerovnoměrnému rozložení elektronů mezi různými jádry se vyvíjí mírně pozitivní (δ+) nebo mírně negativní (δ–) náboj. Kovalentní vazby mezi atomy vodíku a kyslíku ve vodě jsou polární kovalentní vazby., Sdílené elektrony tráví více času v blízkosti kyslíkového jádra, což mu dává malý negativní náboj, než tráví v blízkosti vodíkových jader, což dává těmto molekulám malý pozitivní náboj.

Vodíkové Vazby
Iontové a kovalentní vazby jsou pevné vazby, které vyžadují značnou energii, aby zlomit. Ne všechny vazby mezi prvky jsou však iontové nebo kovalentní vazby. Mohou se také tvořit slabší vazby. Jedná se o atrakce, které se vyskytují mezi pozitivními a negativními poplatky, které nevyžadují mnoho energie k přerušení. Dvě slabé vazby, které se často vyskytují, jsou vodíkové vazby a van der Waalsovy interakce. Tyto vazby vedou k jedinečným vlastnostem vody a jedinečným strukturám DNA a bílkovin.,
když se vytvoří polární kovalentní vazby obsahující atom vodíku, má atom vodíku v této vazbě mírně kladný náboj. Je to proto, že sdílený elektron je tažen silněji směrem k druhému prvku a od jádra vodíku. Protože atom vodíku je mírně pozitivní (δ+), bude přitahován k sousedním negativním částečným nábojům (δ–). Když se to stane, slabé interakce dochází mezi δ+ náboj atomu vodíku jedné molekuly a δ– poplatek z jiné molekuly. Tato interakce se nazývá vodíková vazba., Tento typ vazby je běžný; například kapalná povaha vody je způsobena vodíkovými vazbami mezi molekulami vody (obrázek 4). Vodíkové vazby dávají vodě jedinečné vlastnosti, které udržují život. Pokud by to nebylo pro vodíkové lepení, voda by byla spíše plynem než kapalinou při pokojové teplotě.

Vodíkové vazby tvoří mezi různými molekulami a ne vždy musí obsahovat molekuly vody. Atomy vodíku v polárních vazbách v jakékoli molekule mohou tvořit vazby s jinými sousedními molekulami. Například vodíkové vazby drží pohromadě dva dlouhé prameny DNA dát molekuly DNA jeho charakteristické dvouřetězcové struktury. Vodíkové vazby jsou také zodpovědné za některé z trojrozměrné struktury proteinů.,
van der Waals interakce
jako vodíkové vazby, van der Waals interakce jsou slabé atrakce nebo interakce mezi molekulami. Vyskytují se mezi polárními, kovalentně vázanými atomy v různých molekulách. Některé z těchto slabých atrakcí jsou způsobeny dočasnými částečnými náboji vytvořenými, když se elektrony pohybují kolem jádra. Tyto slabé interakce mezi molekulami jsou důležité v biologických systémech.