Úvod
leukémie z Vlasatých buněk (HCL) je B-buněk lymfoidní neoplázie. HCL se liší od jiných novotvarů B-buněk kvůli jeho morfologickým, imunofenotypickým a molekulárním charakteristikám. Jeho hlavní charakteristikou je akumulace monoklonálních B buněk s výstupky podobnými vlasům na povrchu, které se nacházejí hlavně v periferní krvi, kostní dřeni a slezině. To bylo popsáno v roce 1958 Bournoncle et al. Říkali tomu však leukemická retikuloendotelióza.,1 termín „chlupaté buňky“ byl vytvořen v roce 1996 Schrek et al.2 Dnes je klasifikován Světovou zdravotnickou organizací jako B-buněčný non-Hodgkinův lymfom.3
definice
HCL je vzácná, chronická, lymfoproliferativní porucha B-buněk. Jeho hlavními charakteristikami jsou cytoplazmatické prodloužení, které dávají buňkám chlupatý aspekt.
etiologie
ačkoli existují různé studie, které ukazují souvislost mezi expozicí určitým činidlům a HCL, její etiologie nebyla jasně stanovena, což lze vysvětlit kvůli nízkému výskytu., Mezi látky, které se ukázaly jako pozitivní spojení, patří: expozice pesticidům, 4 herbicidy, minerální oleje, práce jako tesař nebo farmář.4-7 nedávno bylo popsáno pozitivní spojení s velikostí, 5 zatímco kouření má inverzní sdružení, zejména u mužů.8 specifický mechanismus, který poskytuje ochranu, není znám; přesto bylo navrženo kouření ke snížení závažnosti zánětlivých mechanismů9 a že nikotin indukuje apoptózu v lymfocytech.10
epidemiologie
HCL představuje 2-3% všech leukémií. V USA je hlášeno 600 nových případů ročně (3 .,2 případy na milion obyvatel). Střední věk při diagnóze je 52 let a je častější u mužů než u žen, s poměrem 4: 1; s vyšším výskytem v bílé populaci, zejména u Židů Ashkenazi.3 v Mexiku představuje HCL 1, 12% všech leukémií. Na severu země však představuje až 1,83%, podobně jako informace z USA 11,12
Fyziopatologie
HCL je chronická lymfoproliferativní porucha B-buněk. Jeho buňky však nemají vzhled žádné subpopulace B-buněk a jeho původ byl otázkou debaty., Analýza genů proměnných oblastí imunoglobulinů (Ig) je nástroj používaný k objevování klonálního původu lymfoidních buněk.13 Ve více než 85% případů, jsme schopni najít somatické mutace ve variabilních oblastí Ig genů HCL buňky,14,15, což je známkou toho, že buňky podílející se prošly germinální centrum nebo periferní lymfoidní orgány.16 přibližně 40% HCL buněk koexprimuje více Ig izotypů souvisejících s klonálně.17
Důkazy naznačují původ post zárodečných center v paměťových B-buněk, vzhledem k jejich genomové exprese profil.,18,19 původ paměťových B-buněk je kompatibilní s nedostatkem HCL chromozomální reciproční translokace.20 Absence CD27 je typická pro HCL. To představuje bod proti hypotéze jeho původu v paměťových B-buňkách.21 byly však pozorovány negativní B-buňky paměti CD27.22 vzhledem k tomu, že postižení lymfatických uzlin je vzácné, bylo navrženo, že buňka původu HCL je pravděpodobně umístěna v kostní dřeni nebo slezině, protože to jsou obvykle postižená místa. HCL buňky vykazují expresní profil podobný okrajové zóně sleziny.,23
charakteristický vzhled HCL je způsoben expresí beta-aktinu, která je polymerizována na F-aktin, který se nachází v kortikálním cytoskeletu.24 PP52 přítomný, který je specifický pro leukocyty, souvisí s F-aktin a je zodpovědný za přináší podporu pro vlasy-jako projekce.25 na druhé straně sekvenování genů HCL nedávno identifikovalo přítomnost mutace BRAF v600e téměř u každého pacienta s onemocněním, který chybí u jiných B-buněčných lymfoidních malignit.Mutace 26,27 BRAF aktivují cestu MAPK a podporují růst, přežití a diferenciaci buněk HCL.,28
klinická prezentace a laboratorní nálezy
klinický průběh onemocnění je indolentní. Většina pacientů obvykle vykazuje slabost a únavu jako převládající příznaky během nástupu onemocnění.29 někdy dochází k opakovaným infekcím v anamnéze. Výsledky fisického vyšetření jsou: splenomegalie u 96%, hepatomegalie u 58% a lymfadenopatie u pouze 35%. Tyto zduřené lymfatické uzliny jsou zřídka pozorovány na periferii; nicméně jsou obecně přítomny v břiše a detekovány zobrazovacími studiemi.,30
V pokročilé fázi onemocnění jsme schopni najít bolest v superior levém kvadrantu, infekce, horečka, krvácení a/nebo hubnutí. To je však neobvyklé kvůli dostupnosti a účinnosti léčby.30,31 klinické projevy jsou produktem akumulace chlupatých buněk ve slezině, játrech a kostní dřeni (Tabulka 1).32
klinické projevy.,
| Slezina | Játra | Kostní dřeně | Lymfatických uzlin |
|---|---|---|---|
| buňky se hromadí v červené buničiny a atrofii bílé dužiny. Později tvoří takzvané „pseudo-sinusoidy“ nahrazením endotelových buněk červené buničiny zesílenými cévními kanály, což přispívá k anémii. | zde se hromadí v jaterních sinusoidech i v portálním traktu., V posledně jmenovaném je fibróza způsobena bohatou kyselinou hyaluronovou, která stimuluje chlupaté buňky k produkci fibronektinu s odpovídající fibrózou. | v této oblasti dochází k rozsáhlé produkci fibrózy a potlačení hematopoézy. Klíčovým faktorem je interakce chlupatý buněk s kyselinou hyaluronovou extracelulární matrix, generování fibroblastický růstové faktory (FGF) a stimuluje maligní buňky produkují a vylučují fibronektinu. | obecně chybí onemocnění. Nedostatek receptorů pro vstup chlupatých buněk., |
Respect to lab studies, it is frequent to observe anemia in 85%, thrombocytopenia in 60.80% and leukopenia in 60% due to hypersplenism and bone marrow infiltration.30
Differential diagnosis
HCL must be differentiated from other indolent lymphoid malignancies such as prolymphocytic leukemia, splenic marginal zone lymphoma, mantle cell lymphoma and HCL variant (HCL-v)., Poslední, kdo se vyskytuje v 10% případů s mediánem věku 70 let, a to navzdory podobnosti s klasickým trichocelulární leukémie, oni se rozcházejí v nepřítomnosti CD25 a CD123 immunophenotypic značky. Dalším způsobem diferenciální diagnostiky je nedostatečná reakce na standardní léčbu HCL a neexistence mutací genu BRAF v600f.30
diagnostické metody
diagnóza HCL se běžně provádí biopsií a aspirací kostní dřeně v kombinaci s imunofenotypickou charakterizací průtokovou cytometrií.,33 je důležité zdůraznit, že tato patologie je obvykle sub-diagnostikována a vyžaduje klinické podezření a použití správné technologie k řešení tohoto problému. Jak již bylo uvedeno, většina pacientů (70-90%) přítomna pancytopenie, leukopenie (
×109/L), anémie (g/dL), neutropenie (×109/L), monocytopenie (×109/L) a trombocytopenie (×109/L). Pouze mezi 10% a 20% představuje mírnou leukocytózu (>10×109/L). Pacienti s HCL vykazují zvýšené hladiny IL-2R (CD25) v séru, které korelují se stupněm aktivity onemocnění.,34 další testy, které je třeba vzít v úvahu při diagnostice, jsou hladiny sérových imunoglobulinů, stejně jako gen IgVH a somatické mutace BRAF v600e.32 Některé HCL histopatologického a immunophenotypic vlastnosti jsou následující:
- •
Lymfocytů průtoková cytometrie v periferní krvi nebo kostní dřeně s CD19, CD20, FMC7, CD11c, CD103, CD25, HC2, CD22, sIg, CD79a a CD123 výrazy, čtyři jsou hlavní a specifické markery: CD11c, CD103, CD25 a CD123.34 Obecně negativní markery jsou CD5, CD23, CD10, CD79b a CD27.,32
- •
silný výraz pro CD200 je charakteristický pro HCL a může být užitečný při diagnostice obtížných případů.34
- •
aspirace kostní dřeně jehlou může být obtížné získat a je často neproduktivní nebo“suchá“. Při biopsii kostní dřeně můžeme pozorovat fibrózu s buněčným“ smaženým vejcem “ způsobeným širokými prostory mezi jádry a bohatou cytoplazmou. Imunohistochemie analýzy pro CD20 a PAST (tartarát rezistentní kyselé fosfatázy), DBA-4 a annexin A1 jsou prováděny, které jsou charakteristické pozitivní.,32
Andrulis et al. řídil studii, kde byla hlášena účinnost protilátky VE1 pro detekci BRAF V600E spolu s identifikací HCL u jiných subjektů. Navíc studie provedená Uppal et al. našli citlivost 88% a specificita 97% pro detekci této mutace s zmíněné protilátky.34
současná léčba
HCL má pravidelně indolentní vývoj. Čekání a pozorování je dobrou volbou pro asymptomatické pacienty, protože včasná léčba nenabízí žádný přínos v míře přežití těchto případů., Každopádně progrese onemocnění u většiny pacientů povede ke komplikacím v důsledku cytopenie a splenomegalie; tj. anémie,krvácení, recidivující infekce atd. V obecné praxi musí být léčba zahájena, pokud dojde k některému z kritérií uvedených v tabulce 2.35 je-li přijato rozhodnutí o zahájení léčby, mělo by být klinické a laboratorní sledování prováděno každé tři měsíce během prvního roku a poté každých šest měsíců.,35 HCL léčba není považována za léčivou, ale současné léčebné strategie jsou schopny dosáhnout dlouhodobé remise, čímž se zvyšuje globální přežití (Algoritmus 1).36-39
kritéria pro zahájení léčby.
1. Symptomatická splenomegalie
2. Cytopenie, zahrnující alespoň jednu z následujících možností:
-Hemoglobin g/dL
-Destiček ×109/L
-Neutrofily ×109/L
3., Závažných infekcí,
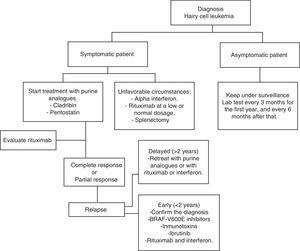
graf pro řízení pacienta s leukémií chlupatých buněk.
Purinových analogů
V roce 1960, výsledky ukázaly, že 30% dětí s těžkou kombinovanou imunodeficiencí syndrom postrádal adenosin deaminázy enzymu (ADA).,40 dále zjistili, že akumulace formy deoxyadenosintrifosfátu byla zodpovědná za snížení lymfocytů.41 s ohledem na tato pozorování byly vyvinuty léky schopné nevratně se vázat na ADA nebo antagonizovat jeho působení. Po léčbě s purinových analogů, deoxyadenosin-trifosfát akumulace následek prasknutí a inhibice opravy DNA, což se promítá do buněčné apoptózy.,42
Pentostatin
Také známý jako 2′-deoxycoformycin (dcF), produkt Streptomyces antibioticus a ADA inhibitory, poprvé představen v roce 1980 jako první purinových analogů pro HCL léčba. V tabulce 3,37,39,43,44 specifické studie ukazují míru odpovědi na pentostatin. Intravenózní použití pentostatin na 4mg/m2 poměr jednou za dva týdny až do dosažení kompletní odpovědi byl schválen v USA Pentostatin je bezpečná u pacientů s hodnotami clearance zesvětlení >60 ml/min. Snížení dávky je však nezbytné, pokud je toto vyčerpání mezi 40 a 60 ml/min.,Doporučuje se hydratace pacienta 1, 5 L intravenózního roztoku při každém pentostatinovém cyklu.30
Globální odezva se pohybuje mezi 88% a 96%, zatímco úplná odpověď je mezi 44% a 81%. Flinn et al. odhadovaná míra přežití 5 a 10 let 90% a 81% s průměrnou dobou sledování 9, 3 roku.45 Pentostatin je obecně dobře snášen a nejčastějšími nežádoucími účinky jsou anémie, trombocytopenie a neutropenie.,46 přesto bylo hlášeno, že pentostatin významně snižuje počet CD4+ a CD8+ lymfocytů, což by mohlo zvýšit sekundární malignity a výskyt infekcí.47,48
Kladribin
je znám jako 2-chlorodeoxyadenosin (CdA). V tabulce 4,49-52 studie naznačují jeho účinnost. Nejpoužívanější schéma spočívá v podávání 0,1 mg/kg/den v kontinuální infuzi po dobu 7 dnů. V ne randomizované studii existovaly důkazy prokazující, že neexistuje statisticky významný rozdíl v rozmezí odpovědí a toxicity mezi infuzemi (24h a 2h).,53 další randomizovaná studie porovnávala denní a týdenní podávání kladribinu; nebyly zjištěny žádné významné nálezy v reakci, přežití, globální a míře toxicity.54 jiná studie ukázala, že týdenní program snížil riziko infekcí.55 jednou z výhod subkutánního podání je skutečnost, že ve většině případů nevyžaduje hospitalizaci. 0, 14 mg / den po dobu 5 dnů má 95% míru odpovědi, 56 podobnou intravenóznímu podání. Týdenní subkutánní programy mají podobnou míru odezvy a toxicity jako denní.,57 s jedním kladribinovým cyklem lze získat globální odpověď až do 100% a celková míra odezvy se liší od 77% do 95%.49-52 Jehn et al. hlášeno globální přežití na 12 let 79%.36 obecně je kladribin dobře snášen, přičemž nejčastější nežádoucí účinky jsou cytopenie a horečka.
studie účinnosti kladribinu v případech HCL.,
| Study | Patients | Follow-up | Plan | % CR | % PR | % GR | Outcome |
|---|---|---|---|---|---|---|---|
| Robak (1999) | 97 | 36 months | 2h infusion IV 0.12mg/kg/d 5 days |
77.3 | 18.,6 | 95.9 | Progression-free survival: 37.4 months |
| Rosenberg (2014) | 83 | NA | Continuous infusion IV 0.1mg/kg/d 7 days |
88 | 12 | 100 | Average global survival: 231 months |
| Goodman (2003) | 207 | 7 years | Continuous infusion IV 0.1mg/kg/d 7 days |
95 | 5 | 100 | Global survival at 108 months: 97% |
| Chadha (2005) | 86 | 9.7 years | Continuous infusion IV 0.,1mg/kg/d 7 days |
79 | 21 | 100 | Global survival at 12 years: 87% |
RC: complete response, RP: partial response, RG: global response.
Until now, there are no randomized prospective studies comparing pentostatin versus cladribine, in part because of the great efficiency of both drugs and due to low HCL incidence., Přesto existují retrospektivní studie prokazující skutečnost, že obě léky mají podobnou účinnost, pokud jde o úplnou odpověď a přežití bez onemocnění.
další léčby
purinové analogy zůstávají první linií léčby, ale nové objevy týkající se patofyziologie HCL vedly k tvorbě léků s různými terapeutickými cíli. Tyto léky jsou předmětem výzkumu a některé ukázaly slibné výsledky.
Rituximab
vzhledem k tomu, že HCL je malignita B-buněk, je logické použít monoklonální protilátku proti CD20, jako je rituximab., Rituximab, který se používá jako samostatný lék, může dosáhnout celkové míry odpovědi 10-54% u pacientů s relapsem HCL při dávce 375 mg/m2 jednou týdně po dobu 4-8 týdnů.58,59 Else et al. zpětně přezkoumána 18 pacientů, kteří byli léčeni purinová analoga v kombinaci s rituximabem jako druhá linie léčby po ošetření s purinových analogů jako jednotlivé agenty. Všichni pacienti odpověděli s úplnou mírou odpovědi 89%.60
Rituximab při 375 mg / m2 týdně po dobu 8 týdnů jako počáteční léčba po podání 5.,6mg / m2 kladribin infuzí 2-H IV po dobu 5 dnů generuje celkovou odpověď 100%.61 ve zvláštních nebo nepříznivých situacích může být 100 mg rituximabu týdně využito po dobu 4-6 týdnů. To je levnější a je obvykle účinné, zejména pokud je kombinováno s interferonem.
zatímco purinové analogy nemusí být schopny eliminovat HCL, protože minimální reziduální onemocnění (MRD) zjištěné po podání kladribinu je vždy silně CD20+, lze pomocí rituximabu získat eradikaci MRD. Rivandi et al., dokázal v předběžné studii, která rituximab v běžných dávkách po dobu 8 týdnů provádí s velkou aktivitu, což eliminuje MRD u 13 pacientů, kdy je použit 4 týdny po podání kladribinu.62
Vemurafenib
jak bylo popsáno výše, mutace BRAF v600e je genetickým klíčem v HCL. Proto je to terapeutický cíl, který byl studován v posledních letech. Vemurafenib je perorální inhibitor BRAF v600e. Tiacci et al., studii k měření Vemurafenib činnost a bezpečnost u pacientů s HLC s relapsem po léčbě analogy purinových nebo kteří byli refrakterní na podávání purinových analogů. Globální míra odezvy byla 96% a úplná míra odezvy byla 35%, s průměrem přežití bez relapsu 19 měsíců. Nežádoucí účinky byly vyrážka, artralgie a artritida.63
Vzhledem k tomu pozitivní vztah byl pozorován mezi použitím Vemurafenib a vzniku kožních malignit, časté zkoumání pokožky se doporučuje.,
Ibrutinib
selektivní a nevratný inhibitor burtonovy tyrosinkinázy zasahuje do signální dráhy B-buněk.64 nedávno byl zahájen klinický test ibrutinibu u pacientů s relapsem HCL. Předběžné údaje o účinnosti a bezpečnosti ukazují nepříznivé účinky, jako jsou erupce, průjem a artralgie. Tento klinický test se v současné době provádí v několika centrech v USA (NCT01841723).
Imunotoxiny
za účelem zvýšení monoklonální cytotoxicity protilátek byly vytvořeny techniky, které usnadňují produkci konjugátů protilátek–toxinu nebo protilátek–léčiv., O imunotoxin je fúze mezi bakteriální toxin (tj. Pseudomonas exotoxin, nebo záškrtu) a variabilní zlomek monoklonální protilátka, jejíž specifický cíl je nalézt na povrchu nádorových buněk jako CD25 nebo CD22. Tento toxin se uvolňuje ve vnitřku neoplastické buňky a narušuje syntézu bílkovin.65
BL22 je imunotoxin proti CD22 mísil s komolého tvaru P. exotoxin PE38. V klinickém testu fáze II byl přípravek BL22 testován v 36 případech relapsu HCL nebo refrakterních onemocnění., Po cyklu (40 mg/kg každé dva dny, tři dávky) byla úplná míra odezvy 25% a globální míra odezvy byla 50%. Tyto odpovědi se zlepšily na celkovou míru odpovědi 47% a celkovou míru odpovědi 72% po opětovném ošetření (pouze u pacientů s cytopeniemi). Dva pacienti vyvinuli uremický hemolytický syndrom bez nutnosti opakování plazmaferézy.66 následně byl moxetumomab pasudotox vyvinut jako modifikovaná verze BL22 s vyšší afinitou a cytotoxicitou., V testu fáze I, který zahrnoval 28 pacientů s relapsem a rezistencí HCL, byla získána celosvětová míra odpovědi 86%, včetně trvalé úplné odpovědi u 46% pacientů.67
Terapeutické možnosti v nepříznivé okolnosti
I když HCL je léčen ve většině vyspělých zemí s kladribin a pentostatin, to je fakt, že tyto léky jsou nejen drahé, nejsou k dispozici v Mexiku a v mnoha zemích s omezenými zdroji., Takže v těchto typech okolností existují další dostupné terapeutické možnosti s příznivými výsledky
Interferon alfa pro léčbu pacientů s HCL byl poprvé zaveden v roce 1984. Dnes je jeho použití omezené, zejména kvůli velké účinnosti purinových analogů. Na druhou stranu, v zemích s nízkými ekonomickými zdroji je to levná varianta A ta, která prokázala podobné výsledky jako v kladribinu, pokud jde o globální přežití. Ruiz-Delgado et al., provedl srovnávací studii mezi interferon alfa (n=18) a kladribin (n=11), kde rozdíl v globální přežití mezi oběma skupinami nebyl statisticky významný; 94% na 217 měsíců v interferonové skupině a 91% na 133 měsíců v kladribin skupiny.68 Ve studii provedené v našem centru, devět HCL pacienti dostávali tři IFN mega-jednotky třikrát týdně po dobu 12 týdnů, následně se jim dostalo ošetření jednou za 8 týdnů, když tam byla leukémie reaktivaci nebo po 10 měsících pozorování každý rok., Všichni pacienti měli hematologickou remisi před 12 týdny léčby. Tato terapeutická možnost je levnější, účinná a srovnatelná s jinými formami léčby IFN při léčbě a udržování pacientů s tímto typem leukémie.69 je možné kombinovat interferon s rituximabem bez zvýšení toxických účinků a zlepšení účinnosti.
splenektomie byla první intervencí, která významně změnila přežití u pacientů. Dnes se používá jen zřídka., To může být doporučena u pacientů s bolestivým masivní splenomegalie (>10 cm pod žeberní okraji) a s minimální infiltrace kostní dřeně, nebo u pacientů, refrakterní na léčbu s interferonem a purinových analogů.33 retrospektivních studií ukazuje úplnou míru odezvy 40-62% a průměrnou míru přežití po 5 letech až 68%.70,71 chlapec et al. publikované retrospektivní studii zahrnující 24 pacientů s HCL diagnózy, které byly rozděleny do dvou skupin: 17 pacientů dostávalo kladribin a 7 byly splenectomized., 75% pacientů ve skupině s splenektomií vykazovalo celkovou remisi, 94% tak učinilo ve skupině s kladribinem. Zajímavým zjištěním při porovnávání obou skupin bylo, že nebyly pozorovány žádné statisticky významné rozdíly, pokud jde o přežití bez leukémie a globální přežití.72
Prognóza
doba Přežití u pacientů po stanovení diagnózy byl 4 roky před léčbou bylo známo, vzhledem ke komplikacím odvozen od cytopenie, včetně krvácení a infekce. Poté, s splenektomií jako léčbou první linie, došlo k úplné reakci 40-62% a přežití 5 let při 61-68%., Poté byl interferon alfa použit jako první lék s výhodami při léčbě HCL. Přesto byla jeho plná míra odezvy nízká, na 10%.73
u purinových analogů (pentostatin a kladribin) je dnes úplná odpověď vyvolána až u 80% pacientů se středním přežitím 10 let. Globální míra odezvy je 96-100% s úplnou mírou odezvy 80% a mírou přežití 10 let v rozmezí od 85% do 100%.74 navzdory tomu významná část pacientů s HCL selhává v reakci na léčbu nebo se stává rezistentní., Až 48% pacientů relapsu v následujících 15 letech.75 budoucnost pacientů s HCL je velmi příznivá. Úkolem je identifikovat tuto malignitu co nejdříve a léčit ji správně pomocí dostupných zdrojů.
Střet zájmů
autoři nemají žádné střety zájmu.