Johdanto
karvasoluleukemian (HCL) on B-solujen imukudoksen neoplasia. HCL erottaa muista B-solujen kasvaimet, koska sen morfologiset, immunophenotypic ja molekyylien ominaisuudet. Sen tärkein ominaisuus on kertymistä monoklonaalinen B-solut, hiukset-kuten ennusteet, sen pinnalla, löytyy pääasiassa perifeerisen veren, luuytimen ja pernan. Sen on kuvannut vuonna 1958 Bournoncle et al. He kutsuivat sitä kuitenkin leukemiaksi retikuloendotelioosiksi.,1 termi ”karvasolut” keksittiin vuonna 1996 Schrek et al.2 nykyään maailman terveysjärjestö luokittelee sen B-soluiseksi Non-Hodgkin-lymfoomaksi.3
Määritelmä
HCL on harvinainen, krooninen lymfoproliferatiivinen B-solujen häiriö. Sen tärkeimmät ominaisuudet ovat sytoplasmapitoisuudet, jotka antavat soluille karvaisen aspektin.
Etiologia
Vaikka on olemassa erilaisia tutkimuksia, jotka osoittavat yhteyden altistuminen tietyille tekijöille ja HCL, sen etiologia ei ole selvää, mikä voisi olla selitti koska sen esiintyvyys on alhainen., Niistä aineet, jotka ovat osoittautuneet positiivinen yhteys ovat: exposition to pesticides, 4 rikkakasvien torjunta-aineet, kivennäisöljyt, työskentelevät puuseppä, tai maanviljelijä.4-7 viime aikoina on kuvattu positiivinen yhteys kokoon, 5 kun taas tupakoinnilla on käänteinen yhteys erityisesti miehillä.8 erityistä mekanismia, joka antaa suojan, ei tunneta; tupakoinnin on kuitenkin ehdotettu vähentävän tulehdusmekanismien9 vaikeusastetta ja nikotiinin indusoivan apoptoosia lymfosyyteissä.10
epidemiologia
HCL on 2-3% kaikista leukemioista. Yhdysvalloissa raportoidaan vuosittain 600 uutta tapausta (3.,2 tapausta miljoonaa asukasta kohti). Mediaani-ikä diagnoosin ajankohtana on 52 vuotta vanha, ja se on yleisempää miehillä kuin naisilla, kanssa 4:1-suhteessa, jossa esiintyy enemmän valkoisessa väestössä, erityisesti keskuudessa Ashkenazi Juutalaisia.3 Meksikossa HCL: n osuus kaikista leukemioista on 1,12%. Kuitenkin, pohjoisessa maassa, se edustaa jopa 1,83%, vastaavat tiedot alkaen U. S. 11,12,
Physiopathology
HCL on krooninen, lymfoproliferatiiviset B-solujen häiriö. Sen soluissa ei kuitenkaan ole B-solujen alapopulaatiota, ja sen alkuperästä on keskusteltu., Immunoglobuliinien (IG) muuttuvien alueiden geenien analysointi on työkalu, jolla selvitetään lymfoidisolujen kloonista alkuperää.13 yli 85% tapauksista, voimme löytää somaattiset mutaatiot Ig muuttuja alueiden geenit HCL soluja,14,15, joka on osoitus siitä, että solujen mukana ovat läpäisseet germinal center tai lymfaattisen perifeeristen elinten.16 noin 40% HCL-soluista ilmentävät useita klonaalisesti liittyviä Ig-isotyyppejä.17
todistusaineisto viittaa alkuperään bakteerikeskuksen jälkeisessä muistissa B-soluissa niiden genomisen ekspressioprofiilin vuoksi.,18,19 muistin B-solujen alkuperä on yhteensopiva HCL: n kromosomien vastavuoroisen translokaation puuttumisen kanssa.20 Cd27: n puuttuminen on tyypillistä HCL: ssä. Tämä edustaa pistettä sen alkuperän hypoteesia vastaan muistissa B-soluissa.21 negatiivisia CD27-muistisia B-soluja on kuitenkin havaittu.22 Koska imusolmuke hellyyttä on harvinaista, se on ehdotettu, että HCL solujen alkuperä on luultavasti sijaitsevat luuytimessä tai perna, koska ne ovat yleensä enemmän vaikuttaa paikoissa. HCL-soluissa on samanlainen ekspressioprofiili kuin pernan reunavyöhykkeellä.,23
HCL on ominainen ilme johtuu beta-aktiini ilme, joka on polymeroidaan F-aktiini, joka sijaitsee aivokuoren tukiranka.24 PP52 phosphoprotein, joka on spesifinen leukosyyttien, on yhteydessä F-aktiini ja on vastuussa kanteen tukea hiukset-kuten ennusteet.25 toisaalta, HCL-geenin sekvensointi äskettäin tunnistettu läsnäolo BRAF V600E mutaatio lähes jokaisen potilaan sairaus, poissa muiden B-solujen imukudoksen maligniteetteja.26,27 BRAF-mutaatiota aktivoi MAPK-reitin edistäen kasvua, eloonjäämistä ja HCL-solujen erilaistumista.,28
kliininen esitys ja laboratoriolöydökset
taudin kliininen hoitojakso on indolentti. Useimmilla potilailla esiintyy yleensä heikkoutta ja väsymystä pääasiallisina oireina sairauden alkamisen aikana.29 Joskus on ollut toistuvia infektioita. Se fisical tutkimuksen havainnot ovat: splenomegalia 96%, hepatomegalia 58% ja lymfadenopatia vain 35%. Näitä turvonneita imusolmukkeita havaitaan harvoin periferiassa; kuitenkin niitä esiintyy yleensä vatsassa ja havaitaan kuvantamistutkimuksissa.,30
Vuonna edennyt pitkälle tauti voimme löytää kipua superior-left quadrant, infektiot, kuume, ja verenvuotoja ja/tai laihtuminen. Tämä on kuitenkin harvinaista hoidon saatavuuden ja tehokkuuden vuoksi.30,31 kliiniset oireet ovat seurausta karvasolujen kertymisestä pernaan, maksaan ja luuytimeen (Taulukko 1).32
kliiniset oireet.,
| Perna | Maksa | luuytimen | Imusolmukkeiden |
|---|---|---|---|
| – soluja kerääntyä punainen massa ja surkastumista valkoinen massa. Myöhemmin he muodostavat ns ”pseudo-sinusoids” läpi korvaaminen endoteelin solujen punainen massa parantamalla verisuonten kanavia, edistää anemia. | täällä ne kerääntyvät maksan sinusoideihin sekä portaaliin., Jälkimmäisessä on fibroosia runsaan hyaluronihapon vuoksi, joka stimuloi karvasoluja tuottamaan fibronektiiniä, jolla on vastaava fibroosi. | tällä alalla fibroosi ja hematopoieesin suppressio ovat laajoja. Keskeinen tekijä on vuorovaikutus karvainen solujen hyaluronihappoa soluväliaineen, tuottaa fibroblastic kasvutekijöiden (FGF) ja edistää parjata solut tuottavat ja erittävät fibronektiini. | yleensä ilman tautia. Reseptorien puute karvasolujen sisäänpääsyyn., |
Respect to lab studies, it is frequent to observe anemia in 85%, thrombocytopenia in 60.80% and leukopenia in 60% due to hypersplenism and bone marrow infiltration.30
Differential diagnosis
HCL must be differentiated from other indolent lymphoid malignancies such as prolymphocytic leukemia, splenic marginal zone lymphoma, mantle cell lymphoma and HCL variant (HCL-v)., Viimeinen esiintyy 10% tapauksista mediaani-ikä oli 70 vuotta, ja vaikka yhtäläisyyksiä klassinen karvasoluleukemian, ne eroavat puuttuessa CD25-ja CD123 immunophenotypic markkereita. Toinen tapa tehdä erotusdiagnoosi on puute vastaus standardi HCL hoito ja olemattomuuden mutaatioita geenien MOLEKYYLITESTAUKSELLA V600F geeni.30
Diagnostiset menetelmät
HCL diagnoosi on yleisesti tehty biopsia ja luuytimen aspiraatio yhdistettynä immunophenotypic luonnehdinta kautta virtaussytometria.,33 on tärkeää huomauttaa, että tämä patologia on yleensä alidiagnosoitu ja vaatii kliinistä epäilyä ja asianmukaisen teknologian käyttöä tämän ongelman ratkaisemiseksi. Kuten aiemmin mainittiin, useimmat potilasta (70-90%) nykyinen pansytopenia, jossa leukopenia (
×109/L), anemian (g/dL), neutropenia (×109/L), monotsitopeniey (×109/L) ja trombosytopenia (×109/L). Vain 10-20%: lla esiintyy Kohtalaista leukosytoosia (>10×109/L). HCL-potilailla seerumin il-2R (CD25) – pitoisuus on kohonnut, mikä korreloi taudin aktiivisuusasteen kanssa.,34 Muut testit, jotka tulisi ottaa huomioon tehtäessä diagnoosia ovat seerumin immunoglobuliinitaso, sekä IgVH geeni-ja BRAF V600E somaattiset mutaatiot.32 Jotkut HCL histopatologisia ja immunophenotypic ominaisuudet ovat seuraavat:
- •
Lymfosyyttien virtaussytometria perifeerisen veren tai luuytimen kanssa CD19, CD20, FMC7, CD11c, CD103, CD25, HC2, CD22, sIg, CD79a ja CD123 ilmaisuja, neljä on tärkein ja erityisiä markkereita: CD11c, CD103, CD25-ja CD123.34 Yleisesti negatiivinen merkit ovat CD5, CD23, CD10, CD79b ja CD27.,32
- •
vahva ilmaus CD200 on ominaista HCL ja voi olla hyödyllinen diagnoosi vaikeita tapauksia.34
- •
luuytimen aspiraatio neulalla voi olla vaikea saada ja on usein tuottamatonta tai ”kuiva”. Vuonna luuydinbiopsia, voimme tarkkailla fibroosi, jossa solu ”paistettu muna” näyttää aiheuttama laaja välejä ytimet ja runsas sytoplasmassa. Immunohistokemia analyysit CD20 ja ANSA (tartrate resistentti hapan fosfataasi), DBA-4 ja anneksiini A1 tehdään, jotka ovat luonteeltaan positiivisia.,32
Andrulis et al. ohjasi tutkimuksen, jossa raportoitiin VE1-vasta-aineen tehokkuus BRAF V600E-tunnistuksessa ja HCL-tunnistus muissa yksiköissä. Lisäksi Uppal et al: n tekemä tutkimus. löytyi 88%: n herkkyys ja 97%: n spesifisyys tämän mutaation havaitsemiseksi mainitulla vasta-aineella.34
nykyinen hoito
HCL kehittyy säännöllisesti. Odottaa ja tarkkailemalla on hyvä vaihtoehto oireettomilla potilailla, koska varhainen hoito ei tarjoa minkäänlaista hyötyä selviytymisen hinnat näissä tapauksissa., Joka tapauksessa, taudin etenemistä useimmilla potilailla johtaa komplikaatioita seurauksena cytopenias ja splenomegalia, eli anemia, verenvuodot, toistuvia infektioita, jne. Yleensä hoito on aloitettava, jos jokin taulukossa 2 luetelluista kriteereistä täyttyy.35 Kun päätös ei aloittaa hoito on otettu, kliiniset ja laboratorio seurantaa tulee tehdä kolmen kuukauden välein ensimmäisen hoitovuoden aikana ja kuuden kuukauden välein sen jälkeen.,35 HCL hoito ei pidetä paranemista, mutta nykyinen hoito strategioita, joilla voidaan saavuttaa pitkäaikaisen remission, mikä lisää global survival hinnat (Algoritmi 1).36-39
kriteerit hoidon aloittamiselle.
1. Oireinen splenomegalia
2. Sytopenia, joihin liittyy ainakin yksi seuraavista:
-Hemoglobiini g/dL
-Verihiutaleiden ×109/L,
-Neutrofiilien ×109/L,
3., Vakavia infektioita
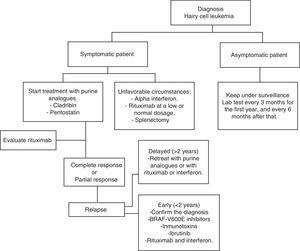
kaavio karvasoluleukemiaa sairastavan potilaan hoidosta.
Puriini analogit
Vuonna 1960, tulokset osoittivat, että 30% lapsista, joilla on vakava yhdistetty immuunipuutos-oireyhtymä puuttui kautta adenosiini-entsyymin (ADA).,40 Lisäksi, he huomasivat, että kertyminen deoxyadenosine trifosfaatiksi oli vastuussa vähentää lymfosyyttien.41 Pitää nämä havainnot mielessä, lääkkeitä, jotka pystyvät sitova peruuttamattomasti ADA tai suututtaa sen toimintaa kehitettiin. Hoidon jälkeen puriini analogit, deoxyadenosine trifosfaatiksi kertyminen johtaa repeämä ja estämällä DNA: n korjaukseen, mikä tarkoittaa solujen apoptoosin.,42
Pentostatin
tunnetaan Myös nimellä 2′-deoxycoformycin (dcF), tuote Streptomyces antibioticus ja ADA: n estäjät, ensimmäisen kerran käyttöön vuonna 1980 ensimmäisenä puriini analogit HCL: hoito. Taulukossa 3,37,39,43,44 erityiset tutkimukset osoittavat, että vaste pentostatin. Suonensisäisen käytön pentostatin klo 4 mg/m2 suhde kahden viikon välein, kunnes saavutetaan täydellinen hoitovaste oli hyväksytty YHDYSVALLOISSA Pentostatin on turvallista potilailla, joiden kreatiniinipuhdistuma vaalentamiseen >60mL/min. Annosta on kuitenkin pienennettävä, jos depuraatio on 40-60 ml/min.,32 potilaan nesteytys 1, 5 L laskimonsisäisellä liuoksella jokaisen pentostatiinisyklin yhteydessä on suositeltavaa.30
kokonaisvaste vaihtelee 88%: n ja 96%: n välillä, kun taas täydellinen vaste on 44%: n ja 81%: n välillä. Flinn ym. arvioitu eloonjäämisaste 5 ja 10 vuotta 90% ja 81%, vastaavasti, jossa keskimääräinen seuranta-kesto 9,3 vuotta.45 Pentostatiini on yleensä hyvin siedetty ja yleisimmät haittavaikutukset ovat anemia, trombosytopenia ja neutropenia.,46 Edelleen, pentostatin on raportoitu lasku CD4+ – ja CD8+ lymfosyyttien laskee merkittävästi, mikä voi lisätä sekundaaristen maligniteettien ja infektioiden esiintyvyys.47,48
Kladribiini
Se tunnetaan 2-klorodeoksiadenosiini (CdA). Taulukossa 4,49-52 tutkimukset osoittavat sen tehokkuuden. Käytetyin hoito koostuu 0,1 mg / kg / vrk jatkuvasta infuusiosta 7 päivän ajan. Satunnaistamattomassa tutkimuksessa saatiin näyttöä siitä, että vaste-ja toksisuusväleissä infuusioiden välillä (24h-2h) ei ollut tilastollisesti merkitsevää eroa.,53 Toisessa satunnaistetussa tutkimuksessa verrattiin päivittäin vs. viikoittain kladribiini hallinto; ei ollut merkittäviä havaintoja vastauksena, survival -, globaali-ja myrkyllisyys hinnat.54 eri tutkimus osoitti, että viikoittainen ohjelma vähensi infektioriskiä.55 Yksi eduista ihonalaisen on se, että useimmissa tapauksissa se ei vaadi sairaalahoitoa. 0,14 mg/vrk 5 päivän ajan vaste on 95%, 56 vastaa laskimonsisäistä antoa. Viikoittain ihon alle annettavilla ohjelmilla on samanlainen vaste ja toksisuusaste kuin päivittäisillä ohjelmilla.,57 vain yksi kladribiini sykli, maailmanlaajuisesti jopa 100% voi saada, ja yhteensä vastausprosentit eroavat 77% – 95%.49-52 Jehn ym. maailman eloonjäämisaste oli 12 vuotta, 79%.Kladribiini on yleisesti ottaen hyvin siedetty, ja yleisimmät haittavaikutukset ovat sytopeniat ja kuume.
Tutkimukset vaikuttavuudesta kladribiini HCL tapauksissa.,
| Study | Patients | Follow-up | Plan | % CR | % PR | % GR | Outcome |
|---|---|---|---|---|---|---|---|
| Robak (1999) | 97 | 36 months | 2h infusion IV 0.12mg/kg/d 5 days |
77.3 | 18.,6 | 95.9 | Progression-free survival: 37.4 months |
| Rosenberg (2014) | 83 | NA | Continuous infusion IV 0.1mg/kg/d 7 days |
88 | 12 | 100 | Average global survival: 231 months |
| Goodman (2003) | 207 | 7 years | Continuous infusion IV 0.1mg/kg/d 7 days |
95 | 5 | 100 | Global survival at 108 months: 97% |
| Chadha (2005) | 86 | 9.7 years | Continuous infusion IV 0.,1mg/kg/d 7 days |
79 | 21 | 100 | Global survival at 12 years: 87% |
RC: complete response, RP: partial response, RG: global response.
Until now, there are no randomized prospective studies comparing pentostatin versus cladribine, in part because of the great efficiency of both drugs and due to low HCL incidence., Tästä huolimatta on retrospektiivisiä tutkimuksia, jotka osoittavat, että molemmilla lääkkeillä on samanlainen teho täydellisen vasteen ja taudista vapaan eloonjäämisen suhteen.
Muut hoidot
Puriini analogit edelleen ensimmäinen rivi hoitoa, mutta uusia löytöjä koskien HCL patofysiologia on johtanut lääkkeiden kanssa erilaisia terapeuttisia tavoitteita. Nämä lääkkeet ovat tutkimuksen kohteena, ja jotkut ovat osoittaneet lupaavia tuloksia.
rituksimabi
koska HCL on B-solujen maligniteetti, on loogista käyttää monoklonaalista vasta-ainetta CD20: tä vastaan, kuten rituksimabia., Työllisiä kuin stand-alone lääke, rituksimabia voi nousta yhteensä vastausta hinnat 10-54% potilailla, joilla HCL uusiutumisen, klo 375mg/m2 kerran viikossa 4-8 viikkoa.58,59 Else ym. takautuvasti läpi 18 potilaat, jotka hoidettiin puriini analogit yhdessä rituksimabin, koska toisen linjan hoito, kun hoidettavan kanssa puriini analogit kuin yhden aineita. Kaikki potilaat saivat vasteen, ja täydellinen vaste oli 89%.60
Rituksimabi klo 375mg/m2 viikossa 8 viikon hoidon jälkeen hallinnoinnissa 5.,6 mg/m2 kladribiinia 2 h IV-infuusiona 5 päivän ajan saa aikaan 100% kokonaisvasteen.61 erityisissä tai epäsuotuisissa tilanteissa 100 mg rituksimabia viikossa voidaan käyttää 4-6 viikkoa. Tämä on halvempaa ja on yleensä tehokas, varsinkin kun sitä käytetään yhdessä interferonin kanssa.
Kun puriini analogit ei ehkä voi poistaa HCL, koska minimaalinen jäljellä oleva sairaus (MRD) havaitaan sen jälkeen kladribiini hallinto on aina vahvasti CD20+, MRD hävittämistä voidaan saada käyttämällä rituksimabia. Rivandi ym., osoittautui alustavassa tutkimuksessa, että rituksimabi tavanomaisilla annoksilla ajaksi 8 viikkoa suorittaa kanssa suuri toimintaa, poistaa MRD 13 potilaalla, kun sitä käytetään 4 viikkoa annon jälkeen kladribiini.62
vemurafenibi
kuten aiemmin on kuvattu, BRAF V600E-mutaatio on HCL: n geneettinen avain. Siksi se on terapeuttinen kohde, jota on tutkittu viime vuosina. Vemurafenibi on suun kautta otettava BRAF V600E-inhibiittori. Tiacci ym., suoritettu tutkimus mittaa Vemurafenib toimintaa ja turvallisuutta potilailla, joilla HLC, jotka uusiutunut hoidon jälkeen puriini analogit tai jotka olivat tulenkestävät hallinnon puriini analogit. Global vastausprosentti oli 96% ja täydellinen vastausprosentti oli 35%, ja relapse-free survival, keskimäärin 19 kuukautta. Haittavaikutuksia olivat ihottuma, nivelkipu ja niveltulehdus.63
Koska positiivinen yhteys on havaittu käytön välillä Vemurafenib ja puhkeamista iho-maligniteetit, usein selvittämään iho on suositeltavaa.,
Ibrutinib
selektiivinen ja palautumaton estäjä Burtonin tyrosiinikinaasin puuttuu B-solun signalointi reitin.Ibrutinibin kliininen määritys potilailla, joilla on HCL-relapsi, on äskettäin aloitettu. Alustavat teho-ja turvallisuustiedot osoittavat haittavaikutuksia, kuten purkauksia, ripulia ja nivelkipua. Tämä kliininen määritys tapahtuu tällä hetkellä useissa keskuksissa Yhdysvalloissa (NCT01841723).
Immunotoksiinit
monoklonaalisten vasta–aineiden sytotoksisuuden lisäämiseksi on kehitetty menetelmiä, jotka helpottavat vasta–aineiden tai vasta-aineiden konjugaattien tuotantoa., On immunotoxin on fuusio välillä bakteeri-toksiini (eli Pseudomonas eksotoksiini tai kurkkumätä) ja muuttuva osa monoklonaalinen vasta-aine, jonka erityinen tavoite on, löytyy pinnalla neoplastisia soluja, kuten CD25-tai CD22. Tämä toksiini vapautuu neoplastisen solun sisustus ja häiritsee proteiinisynteesiä.65
BL22 on immunotoxin vastaan CD22 sulatettu katkaistu muoto P. eksotoksiini PE38. Faasin II kliinisessä määrityksessä BL22-valmistetta testattiin 36: ssa HCL-relapsissa tai refraktorisessa sairaustapauksessa., Syklin (40 mg/kg kahden päivän välein, kolme annosta) jälkeen täydellinen vaste oli 25% ja kokonaisvaste 50%. Nämä vasteet paranivat kokonaisvasteprosentiksi 47% ja kokonaisvasteprosentiksi 72% uusintahoidon jälkeen (vain sytopeniapotilailla). Kahdelle potilaalle kehittyi ureeminen hemolyyttinen oireyhtymä ilman tarvetta plasmafereesiin.66 myöhemmin moksetumomabipasudotox kehitettiin modifioiduksi versioksi BL22: sta, jolla oli suurempi affiniteetti ja sytotoksisuus., Faasi I: pitoisuus, joka sisälsi 28 potilasta, joilla HCL uusiutumisen ja kestävyys, globaali vastausprosentti 86% oli saatu, mukaan lukien kestävä täydellinen vaste 46%: lla potilaista.67
Terapeuttisia vaihtoehtoja epäsuotuisat olosuhteet
vaikka HCL: ää on käsitelty useimmissa kehittyneissä maissa kladribiinilla ja pentostatin, se on tosiasia, että nämä lääkkeet eivät ole ainoastaan kalliita, ne eivät ole käytettävissä, Meksikossa ja monissa maissa, joissa on rajalliset resurssit., Niin, tällaisissa olosuhteissa, on olemassa muita kohtuuhintaisia hoitovaihtoehtoja suotuisat tulokset
Interferoni alfa-HCL: potilaan hoito otettiin käyttöön vuonna 1984. Nykyään sen käyttö on vähäistä, mikä johtuu pääasiassa puriinianalogien suuresta tehokkuudesta. Toisaalta maissa, joissa on alhainen taloudelliset resurssit, se on edullinen vaihtoehto, ja yksi joka on osoittautunut samankaltaisia tuloksia kuin kladribiini kannalta globaalin selviytymisen asia. Ruiz-Delgado ym., vertailevan tutkimuksen välillä interferoni alfa (n=18) ja kladribiini (n=11), jossa ero global survival ryhmien välillä ei ole tilastollisesti merkitsevä; 94% 217 kuukautta interferoni-ryhmässä ja 91% 133 kuukautta kladribiini ryhmä.68 Tässä tutkimuksessa meidän center, yhdeksän HCL potilasta sai kolme IFN mega-yksikköä kolme kertaa viikossa 12 viikon ajan, tämän jälkeen he saivat hoitoa kerran 8 viikkoa, kun siellä oli leukemia regenerointi tai sen jälkeen 10 kuukauden havainto vuosittain., Kaikilla potilailla oli hematologinen remissio ennen 12 hoitoviikkoa. Tämä terapeuttinen vaihtoehto on halvempi, tehokkaampi ja verrattavissa muihin hoitomuodoilla kanssa IFN hoitoon ja ylläpitoon potilailla, joilla on tämän tyyppinen leukemia.69 interferonin ja rituksimabin yhdistäminen on mahdollista ilman, että toksiset vaikutukset lisääntyvät ja tehokkuus paranee.
pernan poisto oli ensimmäinen toimenpide, joka muutti merkitsevästi potilaiden elossaoloaikaa. Nykyään sitä käytetään harvoin., Se voi olla suositeltavaa potilailla, joilla on kivulias massiivinen splenomegalia (>10 cm alle kylki reuna) ja minimaalinen tunkeutumisen luuytimen, tai potilaat eivät sietäneet hoitoa yhdessä interferoni ja puriini analogit.33 retrospektiivisen tutkimuksen mukaan täydellinen vaste oli 40-62% ja keskimääräinen eloonjäämisaste 5 vuoden kohdalla jopa 68%.70,71 Lad ym. julkaistu retrospektiivinen tutkimus, mukaan lukien 24 potilaat, joilla on HCL-diagnoosi, ne jaettiin kahteen ryhmään: 17 potilasta sai kladribiini ja 7 olivat splenectomized., 75%: lla pernan poistopotilaista oli täydellinen remissio, 94%: lla kladribiiniryhmässä. Mielenkiintoinen havainto molempia ryhmiä vertailtaessa oli se, että leukemiattomasta eloonjäämisestä ja maailmanlaajuisesta eloonjäämisestä ei havaittu tilastollisesti merkitseviä eroja.72
Ennuste
elinaika potilailla sen jälkeen, kun diagnoosi oli 4 vuotta ennen hoito oli tiedossa, koska komplikaatioita, jotka on johdettu cytopenias, mukaan lukien verenvuodot ja infektiot. Sen jälkeen pernanpoistoa kuin ensimmäinen rivi hoito, siellä oli täydellinen vastaus 40-62% ja eloonjäämisaste 5 vuotta 61-68%., Sen jälkeen alfa-interferonia käytettiin ensimmäisenä lääkkeenä, josta oli hyötyä HCL: n hoidossa. Silti sen täydellinen vastausprosentti oli alhainen, 10 prosenttia.73
Tänään, puriini-analogit (pentostatin ja kladribiini), täydellinen vaste jopa 80% potilaiden keskimääräinen elinaika on 10 vuotta. Kokonaisvasteprosentti on 96-100%, kokonaisvasteprosentti 80% ja eloonjäämisaste 10 vuotta 85-100%.74 tästä huolimatta merkittävä osa HCL: ää sairastavista potilaista ei reagoi hoitoon tai tulee resistenteiksi., Enintään 48% potilaista uusiutui seuraavien 15 vuoden aikana.75 HCL-potilaiden tulevaisuus on erittäin suotuisa. Haasteena on tunnistaa tämä maligniteetti mahdollisimman varhaisessa vaiheessa ja hoitaa se asianmukaisesti käytettävissä olevilla resursseilla.
eturistiriita
tekijöillä ei ole eturistiriitoja ilmoitettavana.