Oppimisen Tavoitteet
- Vertaa pistemutaatioita ja frameshift-mutaatioita
- Kuvaile eroja näin, hölynpölyä, ja hiljainen mutaatioita
- Kuvaile eroja vaalean ja tumman korjaus
- Selittää, miten eri perimän muutoksia aiheuttaville aineille teko
- Selittää, miksi Ames-testissä voidaan havaita syöpää
- Analysoi DNA-sekvenssit ja tunnistaa esimerkkejä tyyppisiä mutaatioita
A-mutaatio on periytyvä muutos DNA-sekvenssi organismin., Tuloksena organismi, kutsutaan mutantti, voi olla tunnistettavissa muutos fenotyyppi verrattuna villi tyyppi, joka on fenotyyppi yleisimmin havaittu luonnossa. Muutos DNA-jakso siirretään mRNA läpi transkriptio, ja voi johtaa muuttunut aminohappojärjestys proteiini käännös. Koska proteiinit suorittaa valtaosa solujen toiminnot, muutos aminohappojärjestys proteiini voi johtaa muuttunut fenotyyppi solun ja organismin.,
mutaatioiden vaikutukset DNA-sekvenssiin
on olemassa useita mutaatiotyyppejä, jotka luokitellaan sen mukaan, miten DNA-molekyyli muuttuu. Yksi tyyppi, nimeltään piste mutaatio, vaikuttaa yhden pohja ja yleisimmin tapahtuu, kun yksi pohja on korvattu tai korvataan toisella. Mutaatioiden seurauksena myös lisäämällä yhden tai useamman emäksen, joka tunnetaan nimellä lisäys tai poistaminen yhden tai useamman emäksen, joka tunnetaan poistetaan.
Miettiä
- millainen mutaatio tapahtuu, kun geeni on kaksi vähemmän nukleotidit sen järjestyksessä?,
Vaikutukset Mutaatiot Proteiinin Rakenne ja Toiminta
pistemutaatioita voi olla monenlaisia vaikutuksia proteiinin toiminnan (Kuva 1). Seurauksena degeneraatio geneettinen koodi, piste mutaatio on yleisesti johtaa sama aminohappo on sisällytetty tuloksena polypeptidi huolimatta järjestyksessä muuttaa. Tällä muutoksella ei olisi vaikutusta proteiinin rakenteeseen, joten sitä kutsutaan hiljaiseksi mutaatioksi. On näin mutaatio johtaa eri aminohappo on sisällytetty tuloksena polypeptidi., Missense-mutaation vaikutus riippuu siitä, miten kemiallisesti Uusi aminohappo eroaa villin tyypin aminohaposta. Myös muuttuneen aminohapon sijainti proteiinin sisällä on tärkeä. Jos esimerkiksi muuttunut aminohappo on osa entsyymin aktiivista kohtaa, missense-mutaation vaikutus voi olla merkittävä. Monet missense-mutaatiot johtavat proteiineihin, jotka ovat ainakin jossain määrin edelleen toimivia. Joskus vaikutukset näin mutaatioita voi olla vain näennäinen tietyissä ympäristöolosuhteissa; niin näin mutaatioita kutsutaan ehdollinen mutaatioita., Harvoin missense-mutaatiosta voi olla hyötyä. Oikeissa ympäristöolosuhteissa tällainen mutaatio voi antaa eliölle valikoivan edun. Vielä toinen kohta mutaatio, jota kutsutaan hölynpölyä mutaatio, muuntaa kodoni koodaa aminohappo (tunne kodonissa) tulee stop kodonissa (hölynpölyä kodonissa). Nonsense-mutaatiot johtavat luonnossa esiintyvää tyyppiä lyhyempien ja tyypillisesti toimimattomien proteiinien synteesiin.
poistot ja lisäykset aiheuttavat myös erilaisia vaikutuksia., Koska kodonit ovat nukleotidien kolmosia, kolmen nukleotidin ryhmissä olevat insertiot tai deleetiot voivat johtaa yhden tai useamman aminohapon asettamiseen tai poistamiseen, eivätkä ne välttämättä aiheuta merkittäviä vaikutuksia tuloksena olevan proteiinin toimivuuteen. Kuitenkin, frameshift-mutaatioita, aiheuttamia lisäyksiä tai poistoja useita nukleotidit, jotka eivät ole jaollinen kolme ovat erittäin ongelmallisia, koska muutos käsittelyssä runko tuloksia (Kuva 1). Koska ribosomit lukevat mRNA: ta triplettikodoneissa, frameshift-mutaatiot voivat muuttaa jokaista aminohappoa mutaation pisteen jälkeen., Uudessa lukurungossa voi olla myös stop-koodari ennen koodausjakson päättymistä. Näin ollen frameshift-mutaatioita sisältävistä geeneistä valmistetut proteiinit ovat lähes aina toimimattomia.
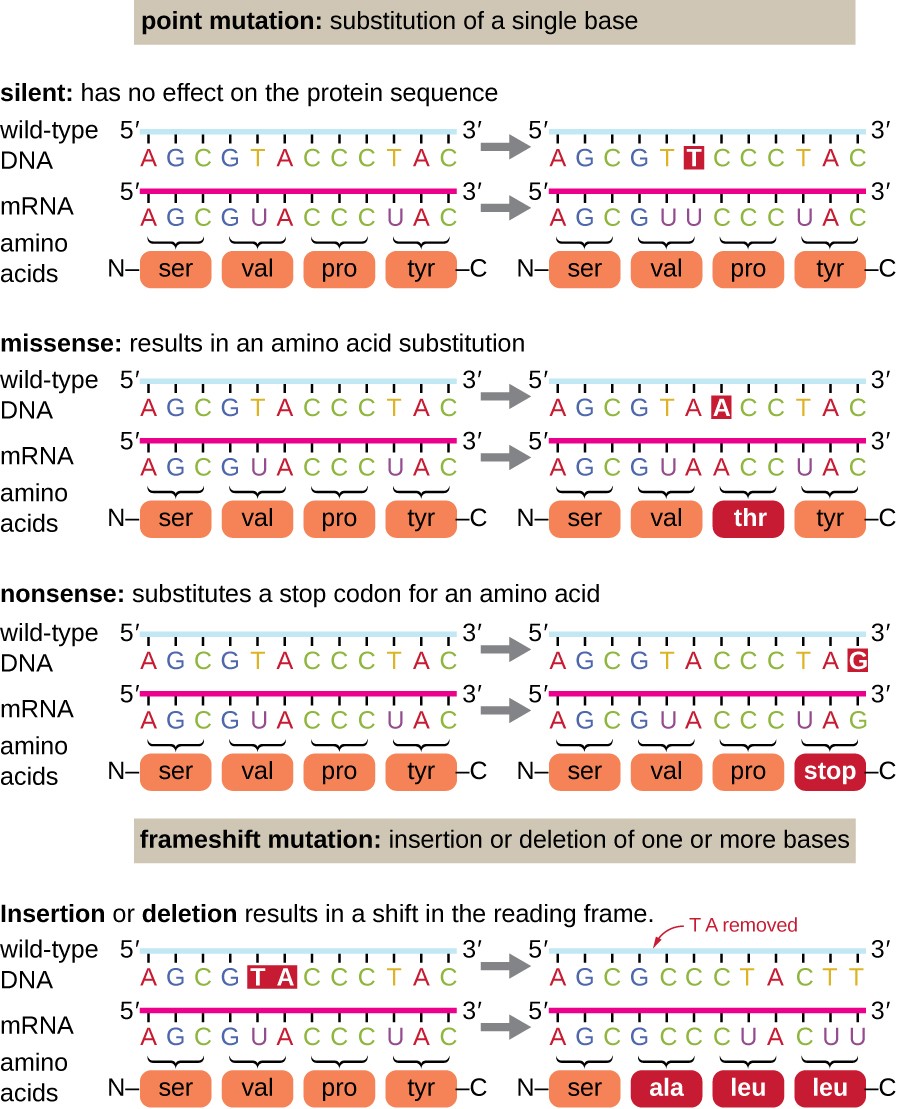
Kuva 1. Klikkaa isompaa kuvaa. Mutaatiot voivat johtaa DNA: n koodaaman proteiinijakson muutoksiin.
Miettiä
- Mitkä ovat syyt nukleotidin muutos geenin proteiinia ei välttämättä ole mitään vaikutusta fenotyypin, että geeni?,
- Onko mahdollista, että lisäys kolmen nukleotidin yhdessä viidennen nukleotidin proteiinia koodaavan geenin tuottamaan proteiinia, joka on lyhyempi kuin normaali? Miten tai miten ei?
Edullinen Mutaatio
Koska ensimmäinen tapaus tartunnan immuunikatoviruksen (HIV) raportoitiin vuonna 1981, lähes 40 miljoonaa ihmistä kuoli HIV-infektio, virus, joka aiheuttaa immuunikato (AIDS)., Virus tavoitteet auttaja-T-soluja, joilla on keskeinen rooli kuromaan synnynnäisen ja adaptiivisen immuunivasteen, tarttuu ja tappaa soluja normaalisti mukana kehon vastaus infektio. HIV-infektioon ei ole parannuskeinoa, mutta monia lääkkeitä on kehitetty hidastamaan tai estämään viruksen etenemistä. Vaikka ihmiset ympäri maailman voivat olla tartunnan, korkein levinneisyys ihmiset 15-49 vuotta vanha on Saharan eteläpuolisessa Afrikassa, jossa lähes joka 20 on saanut tartunnan, osuus suurempi kuin 70% infektioita eri puolilla maailmaa (Kuva 2)., Valitettavasti tämä on myös osa maailmaa, jossa ehkäisystrategiat ja lääkkeet infektion hoitoon ovat kaikkein puuttuu.

Kuva 2. HIV on erittäin yleistä Saharan eteläpuolisessa Afrikassa, mutta sen esiintyvyys on melko alhainen joissakin muissa osissa maailmaa.
viime vuosina, tieteellinen kiinnostus on ollut närkästynyt löytämisen muutamia yksilöitä alkaen pohjois-Euroopassa, jotka ovat resistenttejä HIV-infektio. Vuonna 1998 yhdysvaltalainen geneetikko Stephen J., O ’ Brien National Institutes of Health (NIH) ja kollegansa julkaisi tulokset niiden geneettinen analyysi yli 4000 yksilöä. Nämä osoittivat, että monet ihmiset Euraasian laskeutuminen (jopa 14% joissakin etniset ryhmät) on poistaminen mutaatio, nimeltä CCR5-delta-32, geeni, joka koodaa CCR5. CCR5 on coreceptor löytyy pinnalla T-soluja, joita on tarpeen monille kantoja viruksen syöttää isäntä solun. Mutaatio johtaa reseptorin tuottamiseen, johon HIV ei pysty tehokkaasti sitoutumaan ja estää siten viruksen pääsyn., Tämän mutaation homotsygoottiset ihmiset ovat vähentäneet huomattavasti alttiutta HIV-infektiolle, ja heterotsygoottisilla ihmisillä on jonkin verran suojaa myös infektiolta.
Se ei ole selvää, miksi ihmiset pohjois Eurooppalaista syntyperää, erityisesti, kuljettaa tämä mutaatio, mutta sen esiintyvyys näyttää olevan eniten pohjois-Euroopassa ja tasaisesti vähenee väestön kuin yksi liikkuu etelään. Tutkimus osoittaa, että mutaatio on ollut olemassa jo ennen HIV ilmestyi ja voi on valittu Euroopan väestön altistumisen seurauksena rutto tai isorokko., Tämä mutaatio voi suojella yksilöitä alkaen rutto (aiheuttanut bakteeri Yersinia pestis) ja isorokko (aiheutti variola-virus), koska tämä reseptori voi myös olla mukana näiden sairauksien. Ikä tämä mutaatio on kiistanalaista, mutta arvioiden mukaan se ilmestyi välillä 1875 vuotta, 225 vuotta sitten, ja on saattanut levitä Pohjois-Euroopan kautta Viking valloitusten.
Tämä jännittävä havainto on johtanut uusia keinoja HIV-tutkimusta, mukaan lukien etsivät huumeita estää CCR5 sitoutuminen HIV-henkilöitä, joilla ei ole mutaatiota., Vaikka DNA-testaus määrittää, mitkä yksilöt kantavat CCR5-delta-32-mutaatio on mahdollista, on olemassa dokumentoituja tapauksia, joissa henkilöitä on homotsygoottinen mutaatio HIV-tartunnan. Tästä syystä DNA-testaus mutaatio ei ole yleisesti suositeltavaa julkisen terveydenhuollon virkamiehille, jotta ei rohkaista riskialtista käyttäytymistä ne, jotka kantavat mutaatio. Kuitenkin, estämällä sitova HIV: n CCR5-on edelleen voimassa strategian kehittämiseen lääkehoitojen niille HIV-tartunnan.,
mutaatioiden syyt
virheet DNA: n replikaatioprosessissa voivat aiheuttaa spontaaneja mutaatioita. DNA-polymeraasin virhenopeus on yksi virheellinen emäs miljardissa toistetussa emäsparissa. Mutageeneille altistuminen voi aiheuttaa indusoituja mutaatioita, jotka ovat erityyppisiä kemiallisia aineita tai säteilyä (Taulukko 1). Mutageenialtistus voi lisätä mutaationopeutta yli 1000-kertaiseksi. Mutageenit ovat usein myös syöpää aiheuttavia aineita. Lähes kaikki karsinogeenit ovat kuitenkin mutageenisia, mutta kaikki mutageenit eivät välttämättä ole karsinogeeneja.,
| Taulukko 1., to AT base pair | Point | |||
|---|---|---|---|---|
| Intercalating agents | ||||
| Acridine orange, ethidium bromide, polycyclic aromatic hydrocarbons | Distorts double helix, creates unusual spacing between nucleotides | Introduces small deletions and insertions | Frameshift | |
| Ionizing radiation | ||||
| X-rays, γ-rays | Forms hydroxyl radicals | Causes single- and double-strand DNA breaks | Repair mechanisms may introduce mutations | |
| X-rays, γ-rays | Modifies bases (e.,g., deaminating C-U) | Muuntaa GC AT base-pari | Kohta | |
| Ionisoimaton säteily | ||||
| Uv – | Lomakkeet pyrimidiini (yleensä tymiini) dimeerit | Aiheuttaa DNA replikointi virheitä | Frameshift tai kohta | |
Kemialliset Mutageenit
Erilaisten kemiallisten mutageenien vuorovaikutuksessa suoraan DNA: n kanssa joko toimimalla nukleosidianalogien tai muuttamalla ytimissä., Kemikaaleja nimeltään nukleosidianalogien ovat rakenteellisesti samanlaisia kuin tavalliset ytimissä, ja se voidaan liittää osaksi DNA: n replikaatiota (Kuva 3). Nämä emäsanalogit aiheuttavat mutaatioita, koska niillä on usein erilaiset emäspareja koskevat säännöt kuin niiden korvaamat emäkset. Muut kemialliset mutageenit voivat muuttaa normaaleja DNA-emäksiä, mikä johtaa erilaisiin emäsparitussääntöihin. Esimerkiksi typpihappo deaminoi sytosiinia muuntaen sen urasiiliksi. Urasiili sitten paria adeniini myöhemmässä kierros lisääntymään, jolloin muuntaminen GC emäsparin AT base pair., Typpihapokkeen myös deaminates adeniini, jotta hypoksantiini, joka emäsparia, jossa sytosiini sen sijaan, tymiini, jolloin muuntaminen TA base pari CG-emäsparin.

Kuva 3. Klikkaa isompaa kuvaa. (a) 2-aminopurine nukleosidinen (2AP) rakenteellisesti on nucleoside analoginen adeniini nukleosidi, kun taas 5-bromouracil (5BU) on nucleoside analoginen tymiini nukleosidi. 2AP emäsparit C, muuntaa AT base pari GC base pari jälkeen useita kierroksia replikaatio., 5BU paria G, muuntaa AT base pari GC base pari jälkeen useita kierroksia replikaatio. (b) Dityppioksidi on eri tyyppi kemiallinen mutageenin, joka muuttaa jo olemassa olevia nukleosidi-emäkset, kuten C tuottamaan U, joka emäsparin A. Tämä kemiallinen muutos, kuten kuvassa, tulokset voi muuntaa CG-base pair TA base pair.
väliaineina tunnetut kemialliset mutageenit toimivat eri tavalla., Nämä molekyylit liu ’ uta välillä pinottu typpipitoiset emäkset DNA-kaksoiskierre, vääristää molekyylin ja luoda epätyypillinen väli nukleotidin pohja paria (Kuva 4). Tämän seurauksena aikana DNA: n replikaatio DNA-polymeraasi voi joko ohittaa jäljittelevän useita nukleotidit (luominen, poistaminen) tai lisätä ylimääräisiä nukleotideja (luominen lisäys). Kumpi tahansa tulos voi johtaa frameshift-mutaatioon. Palamisen tuotteita, kuten polysykliset aromaattiset hiilivedyt ovat erityisen vaarallisia intercalating aineita, jotka voivat aiheuttaa mutaation aiheuttamia syöpiä., Interkaloivat aineet etidiumbromidia ja akridiinioranssia käytetään laboratoriossa yleisesti DNA: n värjäämiseen visualisointia varten ja ne ovat potentiaalisia mutageeneja.

Kuva 4. Intercalating aineet, kuten akridiini, esitellä epätyypillinen väli emäsparia, jolloin DNA-polymeraasi käyttöön joko poisto tai lisäys, mikä potentiaali frameshift-mutaatio.
Säteily
Altistuminen joko ionisoivaa tai ionisoimaton säteily voi jokainen aiheuttaa mutaatioita DNA: ssa, vaikka eri mekanismeilla., Voimakas ionisoiva säteily, kuten röntgen-ja gamma-säteet voivat aiheuttaa single – ja double-stranded katkoksia DNA: n runkoverkon kautta muodostuu hydroksyyliradikaaleja säteily altistuminen (Kuva 5). Ionisoiva säteily voi myös muuttaa emäkset; esimerkiksi deaminaatio sytosiini, jotta urasiili, analoginen toiminta dityppioksidi. Ionisoivaa säteilyä käytetään tappaa mikrobeja steriloida lääketieteelliset laitteet ja elintarvikkeet, koska sen dramaattinen epäspesifinen vaikutus, vahingoittaa DNA: ta, proteiineja ja muita solun osia (ks. Käyttää Fyysistä Menetelmiä Valvoa Mikro-organismeja).,
Ionisoimaton säteily, kuten ultraviolettivalo, ei ole riittävän energistä tällaisten kemiallisten muutosten aloittamiseksi. Kuitenkin, ionisoimaton säteily voi aiheuttaa dimeerin muodostuminen kahden vierekkäisen pyrimidiini perustaa, yleisesti kaksi thymines, yhden nukleotidin strand. Aikana tymiini dimeerin muodostuminen, kaksi vierekkäistä thymines tullut kovalenttisesti toisiinsa ja, jos jätetään korjaamatta, sekä DNA: n replikaatio ja transkriptio on pysähtynyt tässä vaiheessa. DNA-polymeraasi voi edetä ja jäljitellä dimeeri väärin, mikä voi johtaa frameshift tai pistemutaatioita.,

Kuva 5. (a) Ionisoivaa säteilyä voi aiheuttaa muodostumista single-stranded ja double-stranded taukoja sokeri-fosfaatti selkäranka DNA: ta, sekä muutos-emäkset (ei kuvassa). (b) Ionisoimaton säteily, kuten uv-valo voi johtaa muodostumista guaniini dimeerit, joka voi pitkittyä replikaatio ja transkriptio ja esitellä frameshift tai pistemutaatioita.
Miettiä
- Miten pohja analoginen käyttöön mutaatio?,
- miten interkaloiva aine aiheuttaa mutaation?
- minkä tyyppinen mutageeni aiheuttaa tymiinidimeerejä?
DNA: n Korjaukseen
prosessi DNA: n replikaatio on erittäin tarkka, mutta virheitä voi esiintyä spontaanisti tai olla aiheuttama perimän muutoksia aiheuttaville aineille. Korjaamattomat virheet voivat johtaa vakaviin seurauksiin fenotyypille. Solut ovat kehittäneet useita korjausmekanismeja, joiden avulla voidaan minimoida mutaatioiden määrä, jotka jatkuvat.,
Oikoluku
Suurin osa virheistä käyttöön aikana DNA: n replikaatio on viipymättä korjattava useimmat DNA-polymerases kautta toiminto nimeltään oikoluku. Oikoluvun, DNA-polymeraasi lukee äskettäin lisätty pohja, varmistetaan, että se täydentää vastaava pohja mallin strand ennen kuin lisäät seuraavan. Jos virheellistä emästä on lisätty, entsyymi tekee leikkaus väärän nukleotidin vapauttamiseksi ja siihen lisätään uusi emäs.,
Epäsuhta Korjaus
Joitakin virheitä aikana käyttöön replikointi korjataan pian sen jälkeen, kun replikointi koneet on siirretty. Tätä mekanismia kutsutaan epäsuhta korjaus. Osallistuvia entsyymejä tämä mekanismi tunnistaa virheellisesti lisätty nukleotidin, valmistevero sen, ja korvata sen oikea perusta. Yksi esimerkki on E. colin metyyliohjattu epäsuhtakorjaus. DNA on hemimetyloitu. Tämä tarkoittaa, että parental nauha metyloidaan, kun taas äskettäin syntetisoitu tytär strand ei ole. Kestää useita minuutteja ennen kuin uusi juoste metyloituu., Proteiinit MutS, MutL ja MutH sitoutuvat hemimetyloituneeseen kohtaan, jossa virheellinen nukleotidi esiintyy. MutH leikkaa ei-metyloidun juosteen (uuden juosteen). Exonuclease poistaa osan strand (mukaan lukien väärän nukleotidin). Muodostuneen aukon täyttävät DNA pol III ja ligaasi.
Korjaus Guaniini Dimeerit
Koska tuotanto guaniini dimeerit on yleinen (monet eliöt eivät voi välttää uv-valo), mekanismit ovat kehittyneet korjata näitä vaurioita., Vuonna nukleotidin leikkaaminen korjaus (kutsutaan myös tumma korjaus), entsyymejä, poistaa pyrimidiini dimeeri ja korvata sen oikea nukleotidit (Kuva 6). E. coli-bakteerissa DNA: ta skannaa entsyymikompleksi. Jos vääristymä double helix on todettu, että otettiin käyttöön pyrimidiini dimeeri, entsyymi monimutkainen leikkauksia sokeri-fosfaatti selkäranka useita tukikohtia alkupään ja loppupään dimeerin, ja segmentti DNA: n välillä nämä kaksi leikkaukset on sitten entsymaattisesti poistettu. DNA pol I korvaa puuttuvat nukleotidit oikeilla ja DNA-ligaasi sinetöi sokerifosfaatin selkärangan aukon.,
suora korjaus (kutsutaan myös valon korjaus) ja guaniini dimeerit tapahtuu prosessin kautta photoreactivation läsnä näkyvää valoa. Fotolyaasi-niminen entsyymi tunnistaa tymiinidimeerin aiheuttaman DNA-helixin vääristymän ja sitoutuu dimeeriin. Sitten, läsnäolo näkyvä valo, photolyase entsyymi, muutokset rakenne ja lohkeilevat tymiini dimeeri, jolloin thymines taas oikein emäsparin kanssa adenines on toisiaan täydentäviä strand., Fotoreaktivaatiota näyttää esiintyvän kaikissa eliöissä, lukuun ottamatta istukkanisäkkäitä, myös ihmisiä. Photoreactivation on erityisen tärkeää organismien jatkuvasti alttiina uv-säteilylle, kuten kasvien fotosynteesin bakteerit, levät ja koralleja, estää kertyminen aiheuttamia mutaatioita tymiini dimeerin muodostuminen.

Kuva 6. Klikkaa isompaa kuvaa. Bakteereilla on kaksi mekanismia kateenkorvan dimeerien korjaamiseen., (a) nukleotidin leikkaaminen korjaus, entsyymi monimutkainen tunnistaa vääristymä DNA monimutkainen ympäri tymiini dimeeri ja leikkaa ja poistaa vaurioitunut DNA-strand. Oikeat nukleotidit korvataan DNA pol I: llä ja nukleotidijuoste sinetöidään DNA-ligaasilla. (b) photoreactivation, entsyymi photolyase sitoutuu tymiini dimeeri ja läsnäolo näkyvä valo, lohkeilevat dimeeri, palauttaa base pariksi thymines täydentäviä adenines vastakkaisella DNA-strand.,
Miettiä
- Aikana epäsuhta korjaus, miten entsyymi tunnistaa, mikä on uutta ja mikä on vanhaa strand?
- miten interkaloiva aine aiheuttaa mutaation?
- minkä tyyppinen mutaatio fotolyaasi korjaa?
bakteerien mutanttien tunnistaminen
yksi yleinen menetelmä bakteerien mutanttien tunnistamiseksi on nimeltään replica plating., Tätä tekniikkaa käytetään havaitsemaan ravitsemukselliset mutantteja, nimeltään auxotrophs, joka on mutaatio geeni koodaa entsyymiä, biosynteesiin koulutusjakso tietyn ravintoaineen, kuten aminohappo. Seurauksena, kun taas villin tyypin solut säilyttävät kyvyn kasvaa normaalisti keskipitkällä puuttuu erityinen ravintoaine, auxotrophs eivät voi kasvaa tällaisella välineellä. Aikana replica pinnoitus (Kuva 7), jonka väkiluku on bakteeri-soluja on mutagenized ja sitten kullattu kuin yksittäisten solujen monimutkainen ravitsemuksellisesti täydellinen levy ja saa kasvaa siirtomaita., Näiden pesäkkeiden solut poistetaan tästä päälevystä, usein steriiliä samettia käyttäen. Tätä samettia, joka sisältää soluja, painetaan samassa suunnassa eri väliaineiden levyille. Vähintään yhden levyn tulee olla myös ravitsemuksellisesti ehyt, jotta varmistetaan, että solut siirtyvät kunnolla levyjen väliin. Muut levyt ole erityisiä ravintoaineita, jolloin tutkija löytää eri leusiinia mutantteja pysty tuottamaan tiettyjä ravintoaineita. Mutantin talteenottoon voidaan käyttää ravitsemuksellisesti täydellisen levyn vastaavan siirtokunnan soluja lisätutkimuksia varten.,

Kuva 7. Auksotrofisten mutanttien, kuten histidiini-auxotrofien, tunnistaminen tehdään replica-pinnoituksella. Sen jälkeen mutageenisuus, pesäkkeitä, jotka kasvavat ravitsemuksellisesti täydellinen medium mutta ei keskipitkän puuttuu histidiini on tunnistettu histidiini auxotrophs.
Miettiä
- Miksi solut levitettiin ravitsemuksellisesti täydellinen levy lisäksi ravinteiden puutosta levyt kun etsit mutantti?,
Ames-Testi
Ames-testi, jonka on kehittänyt Bruce Ames (1928–) 1970-luvulla, on menetelmä, joka käyttää bakteerien nopea, edullinen seulonta karsinogeenisuutta uusia kemiallisia yhdisteitä. Testi mittaa mutaatio liittyy altistuminen yhdiste, joka, jos se on koholla, voi osoittaa, että altistuminen tämä yhdiste on yhteydessä suurempaan syöpäriskiin., Ames-testi käyttää, kun testi organismi kanta Salmonella typhimurium, joka on histidiini auxotroph, pysty syntetisoimaan omaa histidiini, koska mutaatio olennainen geeni tarvitaan sen synteesi. Altistumisen jälkeen mahdollisesti perimää vaurioittava, nämä bakteerit ovat kullattu päälle keskipitkän puuttuu histidiini, ja määrä mutantteja takaisin kyky syntetisoida histidiini on tallennettu ja verrattuna useita tällaisia mutantteja, jotka syntyvät ilman mahdollisia perimää vaurioittava (Kuva 8)., Mutageenisemmat kemikaalit saavat aikaan lisää mutantteja, joilla on palautettu histidiinisynteesi Amesin testissä. Koska monet kemikaalit eivät ole suoraan mutageenisia mutta ovat metaboloituu mutageenisia muotoja, joita maksan entsyymejä, rotta maksa ote on yleisesti mukana alussa tämä kokeilu matkia maksan aineenvaihduntaa. Ames-testin suorittamisen jälkeen mutageenisiksi todettuja yhdisteitä testataan edelleen niiden mahdollisten karsinogeenisten ominaisuuksien selvittämiseksi käyttämällä muita malleja, kuten eläinmalleja, kuten hiiriä ja rottia.
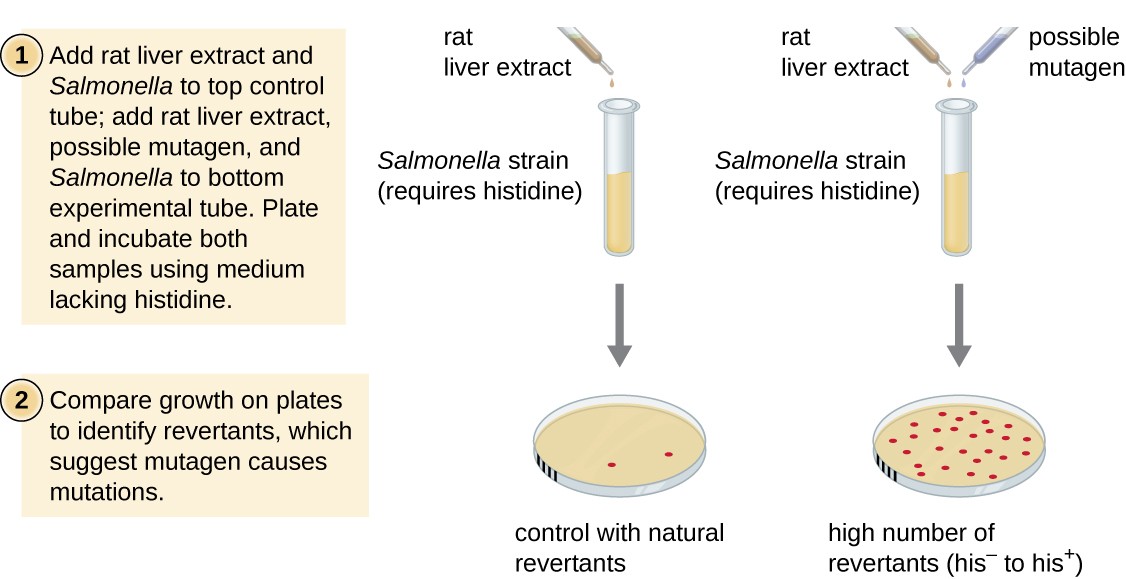
Kuva 8., Ames-testillä tunnistetaan mutageenisia, mahdollisesti karsinogeenisia kemikaaleja. Salmonella histidiini auxotroph käytetään testin rasitusta, altistuvat mahdollisesti perimää vaurioittava/karsinogeeni. Määrä keinotekoisia mutantteja voi kasvaa ilman mukana histidiini on laskea ja verrata useita luonnon palautuminen mutantteja, jotka syntyvät ilman mahdollisia aineosia.
Miettiä
- Mikä mutaatio on käytetty indikaattorina mutaatio Ames-testi?
- miksi Ames-testi voi toimia karsinogeenisuustestinä?,
avainkäsitteet ja yhteenveto
- mutaatio on periytyvä muutos DNA: ssa. Mutaatio voi johtaa proteiinin aminohappojärjestyksen muuttumiseen, mikä mahdollisesti vaikuttaa sen toimintaan.
- pistemutaatio vaikuttaa yhteen emäspariin. Kohta mutaatio voi aiheuttaa hiljainen mutaatio, jos mRNA kodonissa koodit sama aminohappo, on näin mutaatio jos mRNA kodoni koodaa eri aminohappoa, tai hölynpölyä mutaatio jos mRNA kodonissa tulee stop-kodoni.,
- Missense-mutaatiot voivat säilyttää toimintakykynsä riippuen uuden aminohapon kemiasta ja sen sijainnista proteiinissa. Nonsense-mutaatiot tuottavat typistettyjä ja usein toimimattomia proteiineja.
- A frameshift-mutaatio tuloksia lisäys tai poistaminen useita nukleotidien, joka ei ole jaollinen kolmella. Lukurungon muutos muuttaa jokaista aminohappoa mutaation pisteen jälkeen ja johtaa toimimattomaan proteiiniin.
- spontaanit mutaatiot tapahtuvat DNA: n replikaatiovirheiden kautta, kun taas indusoidut mutaatiot tapahtuvat mutageenialtistuksen kautta.,
- mutageeniset aineet ovat usein karsinogeenisia, mutta eivät aina. Lähes kaikki karsinogeenit ovat kuitenkin mutageenisia.
- kemialliset mutageenit sisältävät emäsanalogeja ja kemikaaleja, jotka muuttavat olemassa olevia emäksiä. Molemmissa tapauksissa mutaatiot otetaan käyttöön useiden DNA-replikaatiokierrosten jälkeen.
- Ionisoivan säteilyn, kuten X-säteet ja γ-säteet, johtaa rikkoutuminen phosphodiester selkäranka DNA: ta ja voi myös kemiallisesti muuttaa emäkset muuttavat emäspariutumi-sääntöjä.,
- Ionisoimaton säteily, kuten uv-valo voi ottaa käyttöön pyrimidiiniä (sytosiini) dimeerit, jonka aikana DNA: n replikaatio ja transkriptio, voi ottaa käyttöön frameshift tai pistemutaatioita.
- soluissa on mekanismeja, joilla voidaan korjata luonnossa esiintyviä mutaatioita. DNA-polymeraasilla on oikolukutoimintaa. Epäsuhta korjaus on prosessi korjata väärin sisällytetty emäkset jälkeen DNA replikaatio on valmistunut.
- Pyrimidiinimittarit voidaan myös korjata., Vuonna nukleotidin leikkaaminen korjaus (tumma korjaus), entsyymit tunnistaa vääristymä käyttöön pyrimidiini dimeeri ja vaihda vaurioitunut lohkon oikea emäkset, käyttäen ehjä DNA-juosteen mallina. Bakteerit ja muut eliöt voivat myös käyttää suoraa korjaus, jossa photolyase entsyymi, läsnäolo näkyvä valo, lohkeilevat pyrimidines.
- Kautta vertailu kasvua täydellinen levy ja kasvun puute media puuttuu tiettyjä ravintoaineita, erityisiä loss-of-function mutantteja kutsutaan auxotrophs voidaan tunnistaa.,
- Ames-testi on edullinen menetelmä, joka käyttää leusiinia bakteerit mitata perimää vaurioittavat vaikutukset kemiallinen yhdiste. Mutageenisuus on karsinogeenisuuden indikaattori.
Useita Valinta
Mikä seuraavista on muutos sekvenssi, joka johtaa muodostumista stop kodonissa?
- näin mutaatio
- hölynpölyä mutaatio
- hiljainen mutaatio
- poistaminen mutaatio
pyrimidiinidimeerien muodostuminen johtuu mistä seuraavista?
- spontaani virheitä DNA-polymeraasi
- altistuminen gammasäteilyä
- altistuminen uv-säteilylle
- altistuminen intercalating aineet
Mikä seuraavista on esimerkki frameshift-mutaatio?
- a poistetaan kodonissa
- näin mutaatio
- hiljainen mutaatio
- poistaminen, yhden nukleotidin
Mikä seuraavista on tyyppi, DNA-korjaus, joka guaniini dimeerit ovat suoraan eriteltyinä entsyymin photolyase?,
- suora korjaus
- nukleotidin leikkaaminen korjaus
- epäsuhta korjaus
- oikoluku
Mikä seuraavista Ames-testin suhteen on totta?
- sitä käytetään vasta muodostuneiden auxotrofisten mutanttien tunnistamiseen.
- sitä käytetään tunnistamaan mutantteja, joilla on palautunut biosynteettinen aktiivisuus.
- sitä käytetään spontaanien mutanttien tunnistamiseen.,
- sitä käytetään tunnistamaan mutantteja, joilla ei ole fotoreaktivointitoimintaa.
Täytä Tyhjä
kemiallinen mutageenin, joka on rakenteellisesti samanlainen nukleotidin mutta on eri emäspariutumi-säännöt on nimeltään ________.,
entsyymiä käytetään valon korjaus split guaniini dimeerit on nimeltään ________.
luonnossa yleisimmin havaitun organismin fenotyyppiä kutsutaan___________.,
True/False
Karsinogeeneja ovat tyypillisesti mutageeninen.
Miettiä
Miksi se on enemmän todennäköistä, että lisäyksiä tai poistoja on enemmän haittaa solun kuin pistemutaatioita?,
miksi Ames-testi on mielestäsi parempi kuin eläinmallien käyttö kemiallisten yhdisteiden seulomiseen mutageenisuuden varalta?
Kriittinen Ajattelu
Alla on useita DNA-sekvenssit, jotka ovat muuntunut verrattuna villin tyypin järjestyksessä: 3′-T A C T G A C T G A C G A T C-5′. Kuvitella, että jokainen on osa DNA-molekyylin, joka on erotettu valmisteltaessa transkriptio, niin olet vain nähdä malli strand., Rakentaa täydentäviä DNA-sekvenssit (mainitse 5′ – ja 3′ – päät) kunkin mutaatio DNA-sekvenssi, sitten puhtaaksi (mainitse 5′ – ja 3′ – päät) mallin osa, ja kääntää mRNA-molekyylejä käyttäen geneettinen koodi, tallennus tuloksena aminohappojärjestys (mikä osoittaa, että N-ja C-termini). Millainen mutaatio kukin on?,>
Täydentäviä DNA-sekvenssi:
mRNA: n sekvenssi transkriptoitu malli:
aminohappojärjestyksen peptidi:
– Tyyppinen mutaatio:
Täydentäviä DNA-sekvenssi:
mRNA: n sekvenssi transkriptoitu malli:
aminohappojärjestyksen peptidi:
– Tyyppinen mutaatio: