Miten elementit ovat vuorovaikutuksessa toistensa kanssa riippuu siitä, miten niiden elektronit ovat järjestetty ja miten paljon aukkoja elektronit olemassa syrjäisellä alueella, jossa elektronit ovat läsnä atomi. Elektroneja on energiatasoilla, jotka muodostavat ytimen ympärille kuoria. Lähimmässä kuoressa voi olla jopa kaksi elektronia. Ytimen lähin kuori täytetään aina ensin, ennen kuin mikään muu kuori voidaan täyttää. Vedyllä on yksi elektroni, joten sillä on vain yksi piste, joka sijaitsee alimmassa kuoressa., Heliumilla on kaksi elektronia, joten se voi täysin täyttää alimman kuoren kahdella elektronillaan. Jos tarkastellaan jaksollisen järjestelmän, näet, että vety ja helium ovat ainoat kaksi alkuainetta ensimmäisellä rivillä. Tämä johtuu siitä, että niillä on vain elektroneja ensimmäisessä kuoressaan. Vety ja helium ovat ainoat kaksi alkuainetta, joilla on alin kuori eikä muita kuoria.
toisella ja kolmannella energiatasolla voi olla jopa kahdeksan elektronia. Kahdeksan elektronia on järjestetty neljäksi pariksi ja yksi paikka kussakin parissa on täytetty elektronilla ennen kuin yhdet parit on saatu valmiiksi.,
kun katsoo jaksollista järjestelmää uudelleen (Kuva 1), huomaa, että rivejä on seitsemän. Nämä rivit vastaavat määrää kuoret, että elementit kyseisen rivin on. Elementit tietyllä rivillä on yhä enemmän elektroneja kuin sarakkeita edetä vasemmalta oikealle. Vaikka jokaisessa alkuaineessa on sama määrä kuoria, kaikki kuoret eivät ole täysin täynnä elektroneja. Jos katsot toisen rivin jaksollisen, löydät litium (Li), beryllium (Be), boori (B), hiili (C), typpi (N), happi (O), fluori (F) ja neon (Ne)., Näillä kaikilla on elektroneja, jotka vievät vain ensimmäisen ja toisen kuoren. Litium on vain yksi elektroni sen uloin kuori, beryllium on kaksi elektronia, boori on kolme, ja niin edelleen, kunnes koko kuori on täynnä kahdeksan elektronia, kuten on tapauksessa, jossa neon.
Ei kaikki elementit ovat tarpeeksi elektroneja täyttää heidän syrjäisimpien kuoret, mutta atom on kaikkein vakaa, kun kaikki electron tehtävissä uloin kuori on täytetty., Koska nämä työpaikat syrjäisimmillä kuoret, näemme muodostumista kemiallisia sidoksia, tai vuorovaikutus kaksi tai enemmän samaa tai eri elementtejä, jotka johtavat muodostumista molekyylien. Saavuttaa vakautta, atomit pyrkivät täysin täytä niiden ulompi kuoret ja side muita elementtejä saavuttaa tämä tavoite jakamalla elektroneja, hyväksyä elektroneja toiselle atomille, tai luovuttaa elektroneja toiselle atomille., Koska syrjäisimmillä kuoret elementtejä, joilla on alhainen atomic numeroita (enintään kalsiumia, joiden järjestysluku 20) mahtuu kahdeksan elektronia, tämä on nimitystä oktetti sääntö. Alkuaine voi luovuttaa, hyväksyä tai jakaa elektroneja muiden alkuaineiden kanssa täyttääkseen ulkokuorensa ja täyttääkseen oktettisäännön.
kun atomi ei sisällä yhtä monta protonia ja elektronia, sitä kutsutaan ioniksi. Koska elektronien määrä ei vastaa protonien määrää, jokaisella ionilla on nettovaraus. Positiiviset ionit muodostuvat menettämällä elektroneja ja niitä kutsutaan kationeiksi., Negatiiviset ionit muodostuvat saamalla elektroneja ja niitä kutsutaan anioneiksi.
esimerkiksi natriumin uloimmassa kuoressa on vain yksi elektroni. Yhden elektronin luovuttaminen natriumille vie vähemmän energiaa kuin seitsemän elektronia ulomman kuoren täyttämiseen. Jos natrium menettää elektronin, sillä on nyt 11 protonia ja vain 10 elektronia, jolloin sen kokonaisvaraus on +1. Sitä kutsutaan nykyään natriumioniksi.
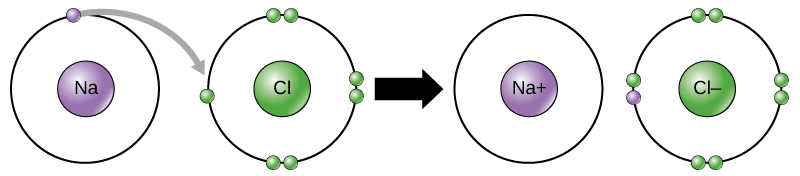
klooriatomilla on ulkokuoressaan seitsemän elektronia. On taas energiatehokkaampaa, että kloori saa yhden elektronin kuin menettää seitsemän., Siksi sillä on taipumus saada elektroni luomaan ioni, jossa on 17 protonia ja 18 elektronia, jolloin sillä on nettonegatiivinen (-1) varaus. Sitä kutsutaan nykyään kloridi-ioniksi. Tätä elektronien liikettä alkuaineesta toiseen kutsutaan elektroninsiirroksi. Kuten Kuva 1 havainnollistaa, natrium-atomin (Na) on vain yksi elektroni-sen uloin kuori, kun taas klooria atom (Cl) on seitsemän elektronia sen uloin kuori. Natrium-atomin lahjoittaa sen yksi elektroni tyhjentää sen kuori, ja klooria atom hyväksyy, että elektroni täyttää sen kuori, tulossa kloridi., Molemmat ionit täyttävät nyt oktettisäännön ja niillä on täydelliset uloimmat kuoret. Koska määrä elektroneja ei ole enää sama määrä protoneja, jokainen on nyt ioni ja on +1 (natrium) tai -1 (kloridi) maksutta.

Ionic Joukkovelkakirjojen
On olemassa neljä joukkovelkakirjoja tai yhteisvaikutukset: ioni -, kovalenttinen, vetysidokset ja van der Waals-vuorovaikutukset. Ioni-ja kovalenttinen joukkovelkakirjat ovat vahvoja vuorovaikutuksia, jotka vaativat suurempaa energiaa hajota. Kun alkuaine luovuttaa elektronin ulkokuorestaan, kuten edellä olevassa natriumatomin esimerkissä, muodostuu positiivinen ioni (kuva 2). Elektronin hyväksyvä alkuaine on nyt negatiivisesti varautunut., Koska positiiviset ja negatiiviset maksut houkutella, nämä ionit pysyvät yhdessä ja muodostavat ionic bond, tai sidos-ioneja. Elementit bond yhdessä electron yksi elementti jää pääasiassa muiden elementti. Kun Na+ ja Cl– – ionit yhdistyvät tuottaa NaCl, elektronin päässä natrium-atomi pysyy muiden seitsemän klooria atom, ja natrium-ja kloridi-ionit vetävät toisiaan puoleensa ristikko ionien kanssa net nolla maksu.,
Kovalenttinen Joukkovelkakirjat
Toinen tyyppi vahva kemiallinen sidos kahdesta tai useammasta atomia on kovalenttinen sidos. Näiden joukkovelkakirjojen muodossa, kun elektroni on jaettu kahteen elementit, ja ne ovat vahvin ja yleisin kemiallinen sidos elävien organismien. Solujemme biologisten molekyylien muodostavien alkuaineiden välille muodostuu kovalenttisia sidoksia., Toisin kuin ionisidokset, kovalenttiset sidokset eivät hajoa vedessä.
mielenkiintoista on, että kemistit ja biologit mittaavat sidoksen lujuutta eri tavoin. Kemistit mittaavat sidoksen absoluuttista lujuutta (teoreettista lujuutta), kun taas biologit ovat kiinnostuneempia siitä, miten sidos käyttäytyy biologisessa järjestelmässä, joka on yleensä vesipitoinen (vesipohjainen). Vedessä, ionic joukkovelkakirjojen irtoavat paljon helpommin kuin kovalenttisia sidoksia, joten biologit sanoisivat, että he ovat heikompia kuin kovalenttisten joukkovelkakirjojen. Kemian oppikirjasta näkee jotain erilaista., Tämä on hyvä esimerkki siitä, miten sama tieto voi aiheuttaa erilaisia vastauksia riippuen näkökulmasta, että tarkastelet sitä.
vety-ja happiatomit, jotka yhdistyvät muodostaen vesimolekyylejä, sitoutuvat toisiinsa kovalenttisilla sidoksilla. Vetyatomin elektroni jakaa aikansa vetyatomin ulkokuoren ja happiatomin epätäydellisen ulkokuoren välillä. Happiatomin ulkokuoren täydelliseen täyttämiseen tarvitaan kaksi elektronia kahdesta vetyatomista, joten H2O: n alaindeksi ”2”., Elektronit jaetaan atomien kesken, jolloin niiden välinen aika ”täyttää”kunkin ulkokuoren. Tämä jakaminen on vähemmän energiaa valtion kaikkien atomien mukana kuin jos ne olivat olemassa ilman niiden ulompi kuoret täynnä.
kovalenttisia sidoksia on kahdenlaisia: polaarisia ja nonpolaarisia. Ei-polaarisia kovalenttisia sidoksia muodostavat kahden atomien sama tekijä tai eri elementtejä, jotka jakavat elektroneja yhtä. Esimerkiksi happiatomi voi kiinnittyä toiseen happiatomiin täyttääkseen niiden ulkokuoret., Tämä assosiaatio on ei-polaarinen, koska elektronit jakautuvat tasaisesti kunkin happiatomin kesken. Kaksi kovalenttisten joukkovelkakirjojen muodossa välillä kaksi happiatomia, koska happea tarvitaan kaksi yhteistä elektronia täyttää sen uloin kuori. Typen atomit muodostavat kolme kovalenttisten joukkovelkakirjojen (kutsutaan myös triple kovalenttinen) välillä kaksi atomia typpeä, koska jokainen typen atom tarvitsee kolme elektronia täyttää sen uloin kuori. Toinen esimerkki nonpolaarisesta kovalenttisesta sidoksesta löytyy metaani (CH4) – molekyylistä. Hiiliatomilla on uloimmassa kuoressaan neljä elektronia ja sen täyttämiseen tarvitaan neljä lisää., Se saa nämä neljä neljästä vetyatomista, joista jokainen atomi tarjoaa yhden. Nämä tekijät kaikki jakavat elektroneja yhtä, luoda neljä-polaarisia kovalenttisia sidoksia (Kuva 3).
polaarinen kovalenttinen sidos, elektronit jaettu atomit viettää enemmän aikaa lähemmäs yksi ydin kuin muut tuma. Koska epätasaisen jakautumisen elektroneja eri ytimet, hieman positiivinen (δ+) tai hieman negatiivinen (δ–) vastaa kehittyy. Vedyn ja veden happiatomien kovalenttiset sidokset ovat polaarisia kovalenttisia sidoksia., Jaettu elektronit viettää enemmän aikaa lähellä happea ydin, jolloin se pieni negatiivinen varaus, kuin he viettävät lähellä vety-ytimet, jolloin nämä molekyylit pieni positiivinen varaus.

Vety Joukkovelkakirjoja
Ioni-ja kovalenttinen joukkovelkakirjat ovat vahvoja sidoksia, jotka vaativat paljon energiaa rikkoa. Kaikki alkuaineiden väliset sidokset eivät kuitenkaan ole ionisia tai kovalenttisia sidoksia. Myös heikommat sidokset voivat muodostua. Nämä ovat vetovoimatekijöitä, jotka tapahtuvat positiivisten ja negatiivisten maksujen välillä, jotka eivät vaadi paljon energiaa murtuakseen. Kaksi usein esiintyvää heikkoa sidosta ovat vetysidokset ja van der Waalsin vuorovaikutukset. Nämä sidokset synnyttävät veden ainutlaatuiset ominaisuudet sekä DNA: n ja proteiinien ainutlaatuiset rakenteet.,
Kun polar kovalenttisten joukkovelkakirjojen joissa vetyatomi muodossa, vety-atomi, että bond on hieman positiivinen varaus. Tämä johtuu siitä, että jaettu elektroni vedetään voimakkaammin kohti toista alkuainetta ja pois vetyytimestä. Koska vety-atomi on lievästi positiivinen (δ+), se houkuttelee naapurimaiden kielteisiä osittainen maksut (δ–). Tällöin tapahtuu heikko vuorovaikutus yhden molekyylin vetyatomin δ+ varauksen ja toisen molekyylin δ– varauksen välillä. Tätä vuorovaikutusta kutsutaan vetysidokseksi., Tällainen sidos on yleinen; esimerkiksi veden nestemäisyys johtuu vesimolekyylien välisistä vetysidoksista (Kuva 4). Vetysidokset antavat vedelle ainutlaatuisia ominaisuuksia, jotka ylläpitävät elämää. Ilman vetysidosta vesi olisi huoneenlämpötilassa pikemminkin kaasua kuin nestettä.

vetysidokset voivat muodostua eri molekyylejä, ja ne eivät aina tarvitse sisältää veden molekyyli. Minkä tahansa molekyylin polaarisissa sidoksissa olevat vetyatomit voivat muodostaa sidoksia muiden vierekkäisten molekyylien kanssa. Esimerkiksi vetysidokset pitävät koossa kaksi pitkää DNA-juostetta, jotta DNA-molekyyli saisi sille ominaisen kaksijuosteisen rakenteen. Vetysidokset vastaavat myös osasta proteiinien kolmiulotteista rakennetta.,
van der Waalsin Vuorovaikutukset
Kuten vetysidokset, van der Waalsin vuorovaikutukset ovat heikkoja nähtävyyksiä tai vuorovaikutukset molekyylien välillä. Ne esiintyvät polaaristen, kovalenttisesti sitoutuneiden atomien välillä eri molekyyleissä. Jotkut näistä heikoista nähtävyyksistä johtuvat väliaikaisista osittaisista varauksista, jotka muodostuvat elektronien liikkuessa ytimen ympärillä. Nämä molekyylien väliset heikot vuorovaikutukset ovat tärkeitä biologisissa järjestelmissä.