edellisessä postitse olemme käyttöön orto- ,para – ja meta – ohjaajia electrophilic aromaattinen substituutio. Sitä ennen käsittelimme elektrofiilisen aromaattisen substituution mekanismia ja osoitimme, että mekanismi etenee karbokationivälin kautta.,
Tänään, aiomme sitoa nämä kaksi käsitettä yhdessä, ja yrittää näyttää, että onko substituentin on orto-, para – tai meta – ohjaaja riippuu siitä, miten substituentin vaikuttaa vakautta carbocation väli.
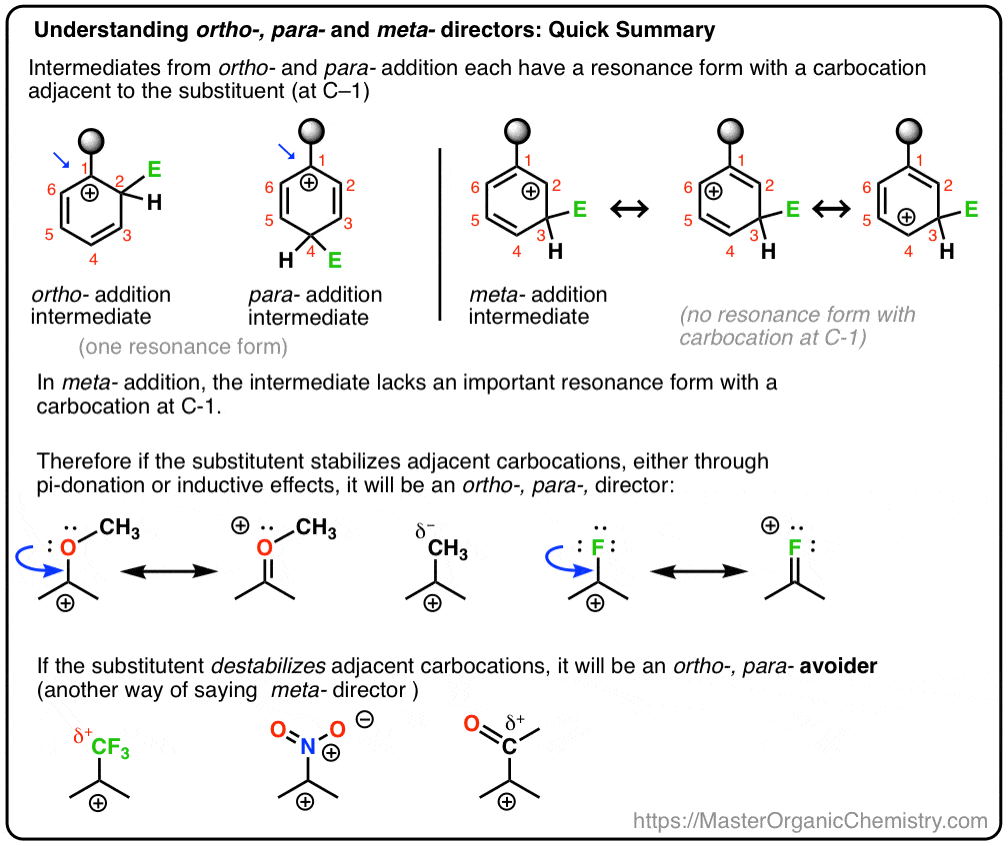
Ja me myös nähdä, miksi vaihtoehtoinen nimi meta – johtaja voi olla”, orto-, para – avoider”. : – )
Sisällysluettelo
- Carbocations Ovat Vakiintunut Viereisten Atomien Kanssa Yksinäinen Paria
- Case Study #1: On orto-,para – Ohjaaja (OCH3)
- Kyllä, Happea On Electronegative., Mutta Sen Yksinäisen Parin Lahjoittaminen Enemmän Kuin Korvaa Sen!
- Orto-para – ohjaajan Reaktioenergiakaavio
- tapaustutkimus #2: meta-johtaja (CF3).
- Mitä Me Kutsumme ”meta– Johtajat” Ovat Enemmän Kuin ”orto-, para– Avoiders”
- Reaktio Energiaa Kaavio meta – Johtaja
- Miksi Halogeenit Ovat Orto-, Para – Ohjaajia?
- Notes
- Quiz Yourself!,
- (Lisäasetukset) Viitteet ja kirjallisuutta
Carbocations Ovat Vakiintunut Viereisten Atomien Kanssa Yksinäinen Paria
ajatellaanpa takaisin, mitkä tekijät lisäävät vakautta carbocations.
Karbokationit ovat elektroniköyhiä lajeja, joiden valenssikuoressa on kuusi elektronia. Joten kaikki substituentit, jotka voivat luovuttaa elektronitiheyden kohti karbokationia, stabiloituvat. Näihin kuuluvat:
- elektroneja vapauttavat substituentit, jotka voivat toimia ”sigma-luovuttajina” (esim., monet alkyyliryhmiä, joka lahjoittaa electron tiheys läpi induktiivinen vaikutukset )
- viereisten atomien kanssa yksinäinen paria, joka voi toimia ”pi luovuttajia” ja carbocation
- viereisen C–C pi joukkovelkakirjoja, jotka voivat vakauttaa carbocation maksu-ala siirtyy muualle (”resonanssi vakauttaminen”, toisin sanoen).
ja karbokationeja horjuttavat tekijät?
- kaikki substituentin, että poistaa electron tiheys on carbocation, kuten vahva elektroni-ryhmien vetäminen.
so here ’ s a quick quiz., Kun otetaan huomioon kaikki edellä kirjoitettu, mikä kahdesta carbocations alla on vakaampi?
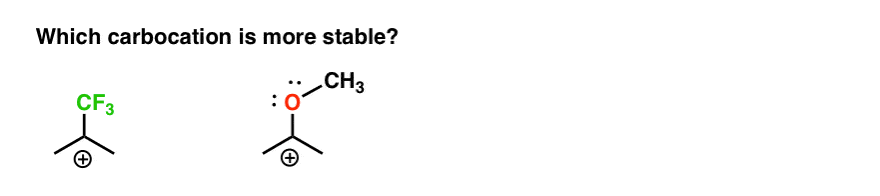
Jos et voi vastata tähän kysymykseen hyvin, olet hyvin matkalla kohti ymmärrystä ero orto-, para – ja meta – ohjaajia.
tutkitaan kahta tapaustutkimusta. Me tarkastelemme geneerinen electrophilic aromaattinen substituutio reagoi bentseenin kanssa orto-, para – ohjaaja (metoksibentseeni) ja tutkia välituotteita, jotka on saatu hyökkäyksen orto -, meta -, ja para kantoja., Sitten teemme saman harjoituksen meta-ohjaajan (trifluorimetyylibentseeni) kanssa.
parhaillaan, toivottavasti ymmärtää, miksi metoksibentseeni suosii orto – ja para– tuotteita, kun trifluoromethylbenzene suosii meta – tuote.
Case Study #1: On orto-,para – Ohjaaja (OCH3)
Electrophilic aromaattinen substituutio metoksibentseeni taipumus antaa orto – ja para – tuotteita, joilla on hyvin vähän meta- ., Tässä on, mitä tapahtuu nitraus, esimerkiksi:
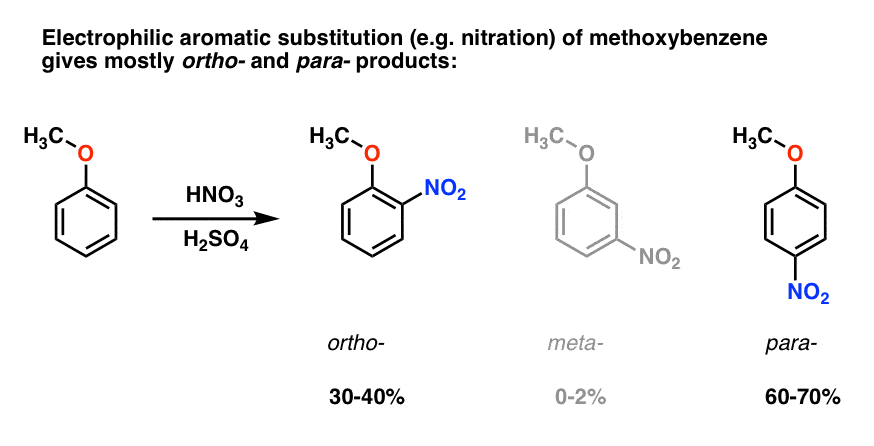
para – tuote hallitsee (60-70%), ja ortho – lähellä takana (30-40%) ja vain jälkeäkään meta– .
miksi?
3. Happi On Elektronegatiivista. Mutta Sen Yksinäisen Parin Lahjoittaminen Enemmän Kuin Korvaa Sen!
tässä ortotuotteeseen johtava polku., Rikomme C–C pi bond ja muodostaa uuden C–E bond (missä E on tarkoitettu edustamaan geneerinen electrophile), tuottaa resonanssi-vakiintunut carbocation:
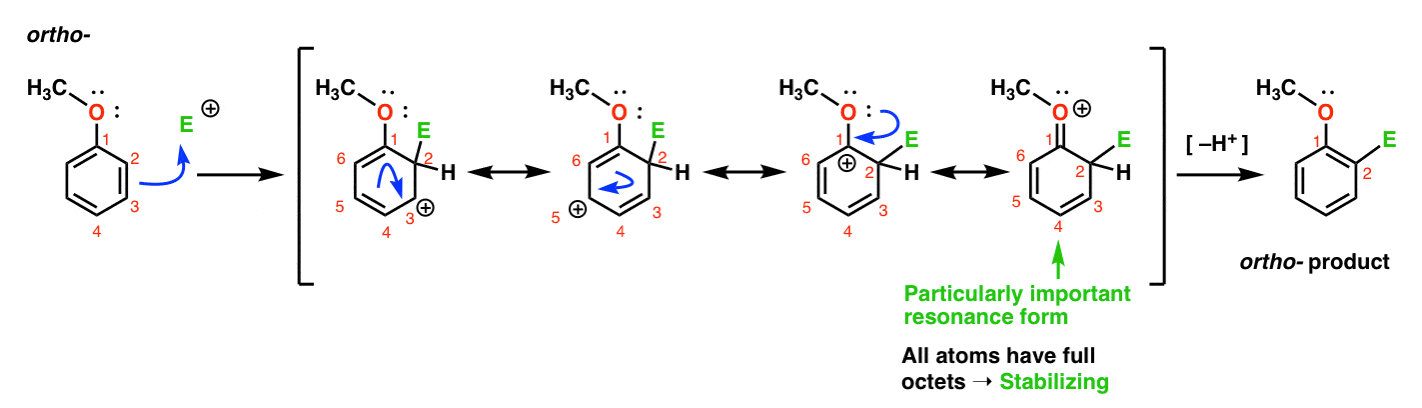
Jos katsoo tarkasti, huomaa, että emme voi muodostaa neljä resonanssi muotoja . Kolme heistä kantavat täyden carbocations (paikan C1, C3 ja C5), mutta se on neljäs yksi – resonanssi muodossa, jossa on C=O pi bond – joka on erityisen tärkeää. Miksi? Tässä resonanssimuodossa kaikilla hiiliatomeilla on täysi oktetti elektroneja., Se johtuu siitä, että suoraan renkaaseen sitoutunut happi voi luovuttaa yksinäisen parin viereiseen karbokationiin muodostaen pi-sidoksen. Tämä on esimerkki pi-lahjoituksesta.
Tässä on koulutusjakson hyökkäys electrophile meta – asentoon. Huomaa ero!
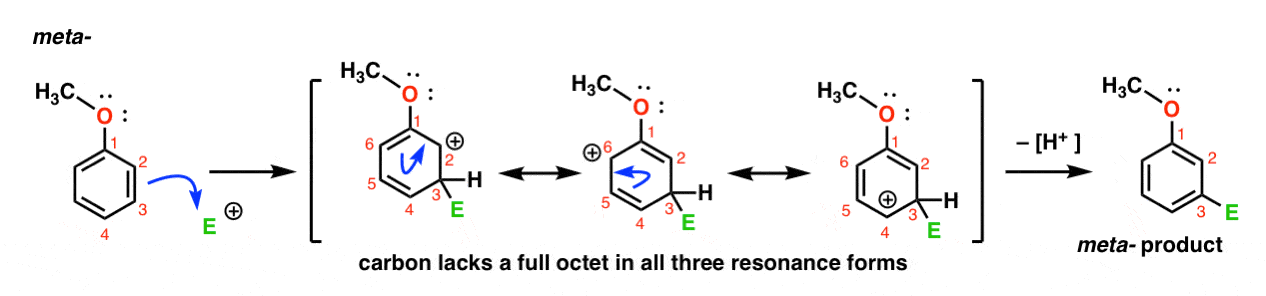
Hyökkäys electrophile C-3 tulokset carbocation joka voi olla delokalisoituneita kautta resonanssi C2, C4 ja C6. Kuitenkin, ei ole mahdollista ”siirtää” carbocation C1, joka tarkoittaa, että ei ole järkevää resonanssi muodossa, jossa kaikki atomit ovat täysin tavua.,
tämä tekee meta – karbokationivälistä huomattavasti vähemmän stabiilin kuin ortokationiväli.
Lopuksi, tässä on reaktio johtaa para – tuote:
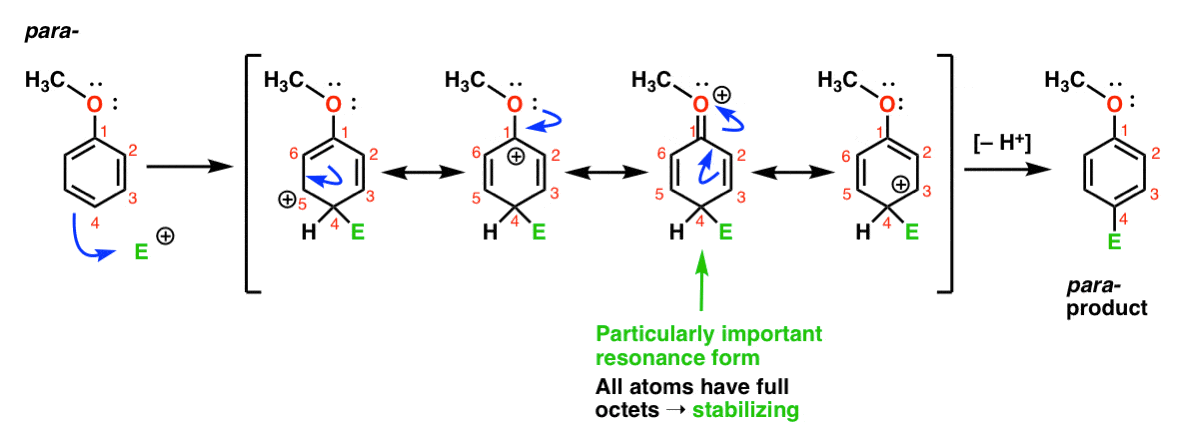
Tässä voimme jälleen tehdä resonanssi lomakkeet carbocations siitä, C1, C3 ja C5, sekä neljäs resonanssi muodossa, jossa liitteenä oleva happi atomi luovuttaa elektronin pari carbocation siitä, C1, jolloin täysi oktetti carbon. Tämä on käytännössä sama tilanne kuin Orto-väli.,
Niin, analysoimalla resonanssi muotoja (ja mark my word, saatat hyvinkin olla pyysi tekemään sama testi lähitulevaisuudessa) voimme nähdä, että väli carbocations johtuvat orto – ja para– lisäksi on huomattavasti vakaampi kuin väli-meta– lisäksi.
Tämä selittää, miksi orto – ja para – tuotteet hallitsevat, ja meta – tuote on vähäinen.
saattaa olla hyödyllistä visualisoida tämä piirtämällä reaktioenergiakaavio.
4., Reaktio-Energia-Kaavio On Orto-Para-Ohjaaja
siirtyminen tilaan johtavat orto – ja para – lisäksi tuotteita on paljon pienempi energia kuin meta– .
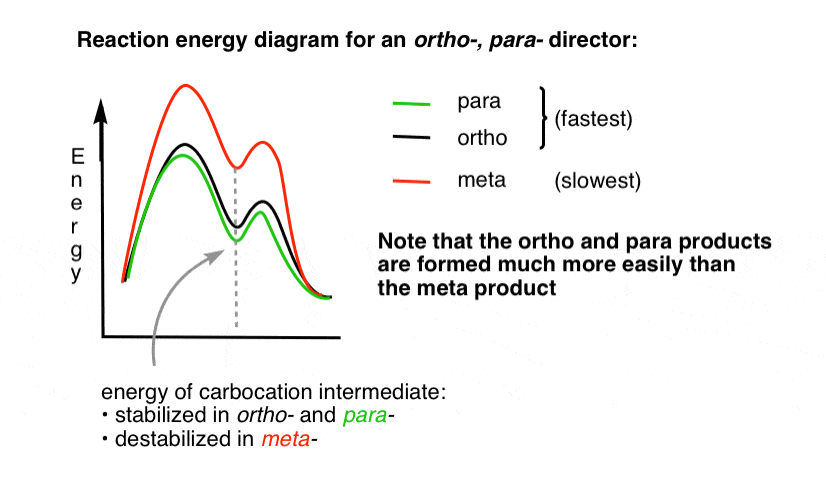
Yksi kysymys – miksi luulet, että para – saattaa olla suosiossa (esim. 60%-70% tuotto para– tuote nitraus, edellä, vs. 30-40% orto-) vaikka on olemassa kaksi orto – asemassa ja vain yksi para- ?
mieti sitä hetki, niin käsittelemme sitä alla.
5. Tapaustutkimus #2: meta-johtaja (CF3).
joten entä CF3?, Miksi se antaa metatuotteita? Tehdään samantyyppinen analyysi.
tässä ortotuotteeseen johtava polku. Kuten Orto-väli edellä, voimme piirtää kolme resonanssi muotoja sijoittamalla carbocation C1, C3, ja C5, vastaavasti.
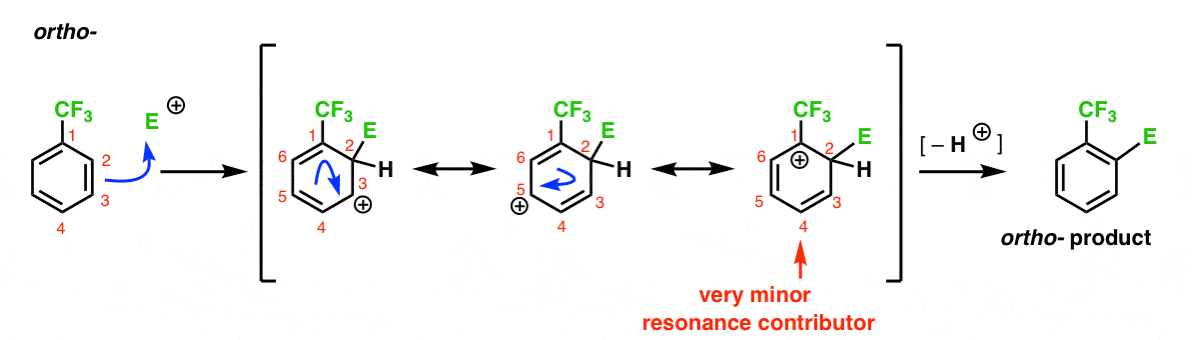
Joten mikä on erilaista tässä tapauksessa?
eri asia on vahvan elektronin vetäytyvän ryhmän (CF3) läsnäolo C1: ssä, mikä muuttaa pallopelin täysin.
Kuten olemme sanoneet, carbocations ovat horjuttaneet naapurit, joka nostaa electron-tiheys., Siksi odotamme, että tämä on hyvin pieni resonanssi tekijä, sillä seurauksella, että positiivinen varaus on vain delokalisoituneita yli C3 ja C5.
olemme todenneet, että CF3 on meta – johtaja. On järkevää ajatella, että metassa on jotain, mikä tekee siitä erityisen vakaan. Analysoimalla alla olevan metatuotteen välituotetta, huomaatko miksi?
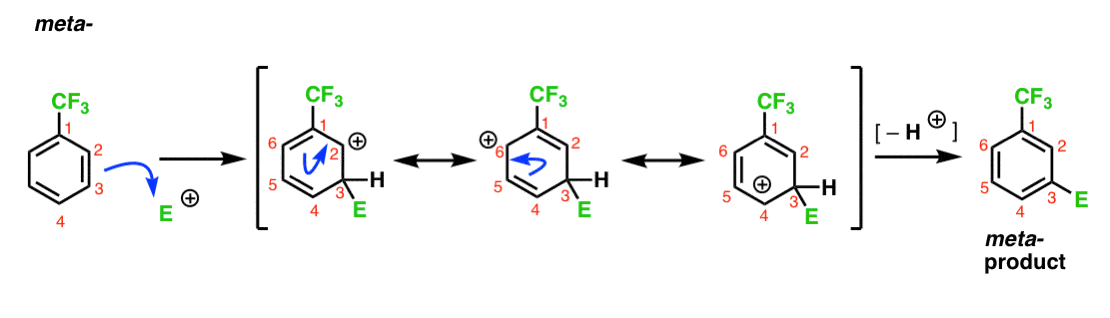
Hmmm. Ei ole välivaihetta, jossa hiilellä on täysi oktetti. Erityisen vakaita resonanssimuotoja ei ole.
It ’s kind of ”meh”, isn ’ t it?
6., Mitä Me Kutsumme ”meta– Johtajat” Ovat Enemmän Kuin ”orto-, para– Avoiders”
toisaalta, ei ole mitään erityisen epävakaa resonanssi muodostaa joko. Koska positiivinen varaus on lokalisoitu C2, C4 ja C6, tilanne, jossa positiivinen varaus on suoraan vieressä electron-peruuttamista CF3 ryhmä on vältettävä. Ja positiivinen varaus on siten delokalisoituneita hienosti koko rengas, toisin kuin ortho – tilanne, edellä.
Joten se on ”vähemmän huono” väli-kuin orto-.,
Lopulta, para – väli on sama ongelma kuin orto- ; välituote, jossa positiivinen varaus on C1, vieressä CF3.
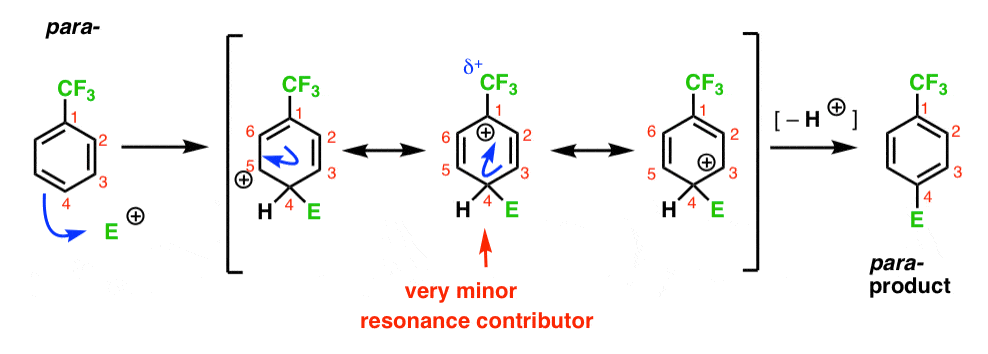
Tämä johtaa vain kaksi tärkeää resonanssi muotoja, mikä johtaa vähemmän delokalisoituneita (ja siksi vähemmän vakaa) carbocation väli.
alaraja: meta– karbokationiväli on stabiilimpi kuin joko Orto – tai para-välituotteet.
Mutta se ei ole, koska substituentin itse on vakauttava vaikutus meta– väli. .,
väittäisin, että meta on hyödyllisempää ajatella vähemmän epävakaana kuin orto – ja para -.
näin CF3 ei ole niinkään meta – ohjaaja, vaan ”Orto–, para– avoideri”. ”
7. Reaktio Energiaa Kaavio meta – Johtaja
Tässä on luonnos reaktio energia-kaavio:
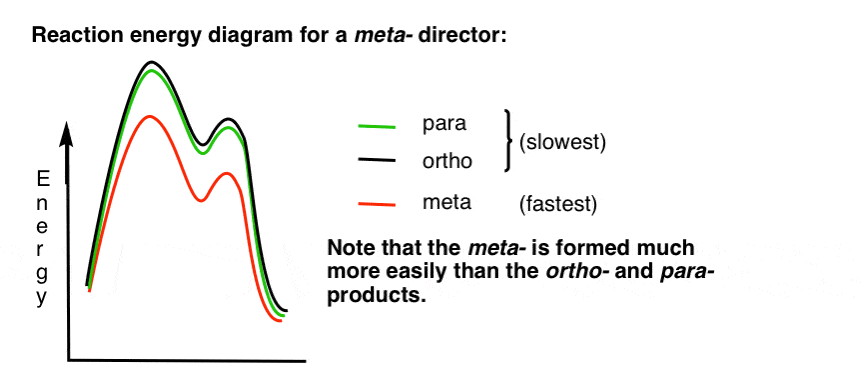
Selvä.
takaisin alkuperäiseen kysymykseemme. Kumpi karbokationi on vakaampi?,
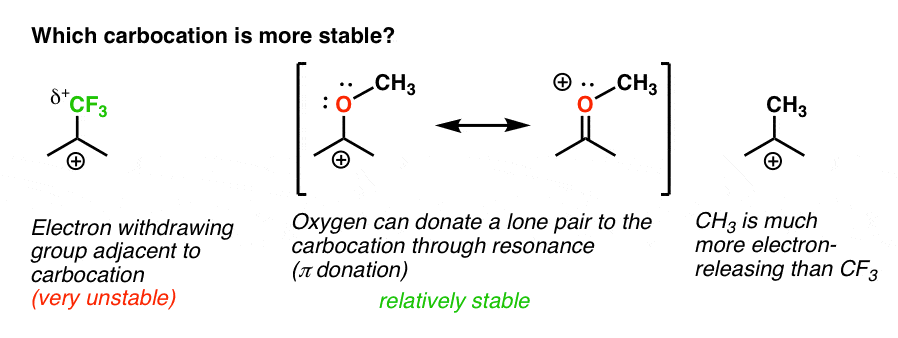
on Selvää, carbocation viereisen happea laakeri yksinäinen pari on paljon vakaampi kuin carbocation vieressä elektroni-ryhmän vetäminen, kuten CF3.
Ja joka käsittää ero orto-, para – ohjaaja, kuten OCH3 ja meta – ohjaaja, kuten CF3.
on syytä huomata, että useimmilla alkyyliryhmillä (kuten CH3 ) ei ole yksinäistä paria, mutta ne ovat silti Orto -, para – ohjaajia., Tämä on sopusoinnussa kaikki, mitä olemme oppineet ennen siitä, miten alkyyli-ryhmät ovat yleensä vakauttaa varten carbocations – muista, että carbocation vakaus yleensä kasvaa korvaaminen
noin ne para– tuotteet…
Miksi para – tuotteita, jotka on tuotettu suurempi määrä kuin orto- ?
vastaus on sterinen este.
hyökkäys para-asennossa on vähemmän substituentti kuin hyökkäys Orto-asennoissa.
joten miksi halogeenit ovat Orto -, Para-ohjaajia?
tämä jättää meille hieman kinkkisen esimerkin halogeeneista.,
miksi fluori, kloori, bromi ja jodi-Orto -, para-ohjaajat ovat deaktivoivia ryhmiä?
vastauksen ei pitäisi tulla yllätyksenä, jos on seurannut mukana, mutta lähdemme tästä seuraavaan postiin asti, koska tämä on jo tarpeeksi pitkä.
Next post: Why are halogens ortho-, para – directors?
huomautukset
Huomautus 1. Se on enemmän oikein sanoa, että orto – ja para – tuotteet hallitsevat, koska siirtyminen todetaan, johtavat nämä tuotteet ovat alhaisemmat energiaa, eikä energia välituotteet itse., Loppujen lopuksi juuri siirtymätilojen energia määrittää aktivointiesteen ja siten reaktionopeuden.
Huom.2. Tai hyperkonjugaatio, jota useimmat oppikirjat (lukuun ottamatta Maitland Jonesia) yleensä välttävät.
Quiz Yourself!,/div>
 Klikkaa Flip
Klikkaa Flip

 Klikkaa Flip
Klikkaa Flip 
 Klikkaa Flip
Klikkaa Flip 
 Klikkaa Flip
Klikkaa Flip 
(Lisäasetukset) Viitteet ja kirjallisuutta
- A., F. Holleman, Die direkte Einführung von Substituenten den Benzolkern
Rec. Trav. Chim. Pays-Bas 1910, 12, 455-456
DOI: 10.1002/recl.19100291205
A. F Holleman vuodesta 1910 sanoi, että ortho–para suuntautumiseen liittyy aktivointi ja meta suunta deaktivointi. - —vuorotteluvaikutuksen luonne hiiliketjuissa. Osa XXIII. Poikkeava suunta, jonka halogeenit, ja sen vaikutusta ongelmaan ortho–para-suhde, aromaattisia korvaaminen
Christopher Kelk Ingold ja Charles Cyril Norrey vas huijaa
J. Chem. Soc. 1928, 417-425
DOI: 10.,1039 / JR9280000417
tämä paperi käsittelee suuntaamalla vaikutuksia 1,2-dihalobentseenejä. - Joitakin huomautuksia, jotka koskevat steric haittaa ja vaikutuksia substituentteja on ortho : para-suhde aromaattinen substituutio
P. B. D. de la Mare
J. Chem. Soc. 1949, 2871-2874
DOI: 10.1039/JR9490002871
tässä kirjassa de la Mare käsitellään eri tekijöitä, jotka voi selittää ylivalta para yli ortho valikoivuus, jälkeen jakamalla tuotto ortho tuotteen 2 (koska siellä on 2 orto-paikkoja, mutta vain 1 para asema monosubstituted benzenes)., - alkyyliryhmien Volyymivaikutukset aromaattisissa yhdisteissä. Osa V. monosulphonation p-symeeni
R. J. W. Le Fèvre
J. Chem. Soc. 1934, 1501-1502
DOI: 10.1039/JR9340001501
p-symeeni, suuret tuote, joka saadaan, kun electrophilic sulfonation on 2-tuotteen (ortho, että metyyli-ryhmä), mikä johtuu todennäköisesti sterics. - Vaikutukset Alkyyli Ryhmien Electrophilic Lisäykset ja Vaihdot
COHN, H., HUGHES, E., JONES, M. ja KUORINTA, M. G.
Luonto 1952, 169, 291
DOI: 1038/169291a0
Tässä asiakirjassa on tietoja vertaamalla nitraus t-butylbenzene ja tolueeni., T-butylbenzene on paljon enemmän p-ohjaa kuin tolueeni (79.5% para t-butylbenzene vs. 40% para sillä tolueeni), joka johtuu todennäköisesti sterics (ortho lähestymistapa on estänyt kookkaammat t-butyyli-ryhmä). - isomeerien jakautuminen etyyli – ja Isopropyylibentseenin Mononitraatiossa. Edelleen Näyttöä Steric Vaikutus Isomeeri Jakelu
Herbert C. Brown ja W. Hallam Bonner
Journal of American Chemical Society 1954, 76 (2), 605-606
DOI: 10.,1021/ja01631a084
Taulukko II tässä kirjassa osoittaa, että ortho saatu tuote, nitraus ja monoalkylbenzenes pienenee alkyyli-ryhmä suurenee (esim. t-butylbenzene saadaan hyvin vähän ortho, kun tuote nitraus verrattuna tolueeni). - —vuorotteluvaikutuksen luonne hiiliketjuissa. Osa XXII. Yritys edelleen määritellä todennäköinen mekanismi suuntautumiseen aromaattinen substituutio
Christopher Kelk Ingold ja Firenze Ruth Shaw
J. Chem. Soc. 1927, 2918-2926
DOI: 10.,1039/JR9270002918
varhainen paperi, jonka vaikutusvaltainen Fyysinen Orgaaninen Kemisti, Professori C. K. Ingold, jossa todetaan, että halogenobenzenes ovat induktiivisesti electron-peruuttamista, mutta samanaikaisesti resonanssi-vakauttava. - Poikkeava Reaktiivisuus Fluorobenzene vuonna Electrophilic Aromaattinen Substituutio ja siihen Liittyviä Ilmiöitä
Joel Rosenthal ja David I., Schuster
Journal of Chemical Education 2003, 80 (6), 679
DOI: 1021/ed080p679
erittäin mielenkiintoinen kirja, sopii uteliaita opiskelijoita, ja mainitsee jotain, että useimmat harjoitellaan orgaaniset kemistit tietävät, empiirisesti – fluorobenzene on lähes yhtä reaktiivinen kuin bentseeni EAS tai Friedel-Crafts reaktioita, joka on counterintuitive, kun yksi katsoo, elektroniset tehosteet! - Orgaaninen kemia
N. Haworth, C. K. Ingold, T. A. Henry
Ann. Rep. Prog. Kem. 1926, 23, 74-185
DOI: 10.1039/AR9262300074
varhainen paperi keskustelemme ohjaa vaikutuksia EAS. PP., 136 ja 137 sisältävät lukuja, jotka kuvaavat elektronien virtausta. Pg. 140 käsittelee meta-suuntaa, joka esiintyy ”vastakkaisista” syistä alkyyliryhmien o/p-suuntaisena.