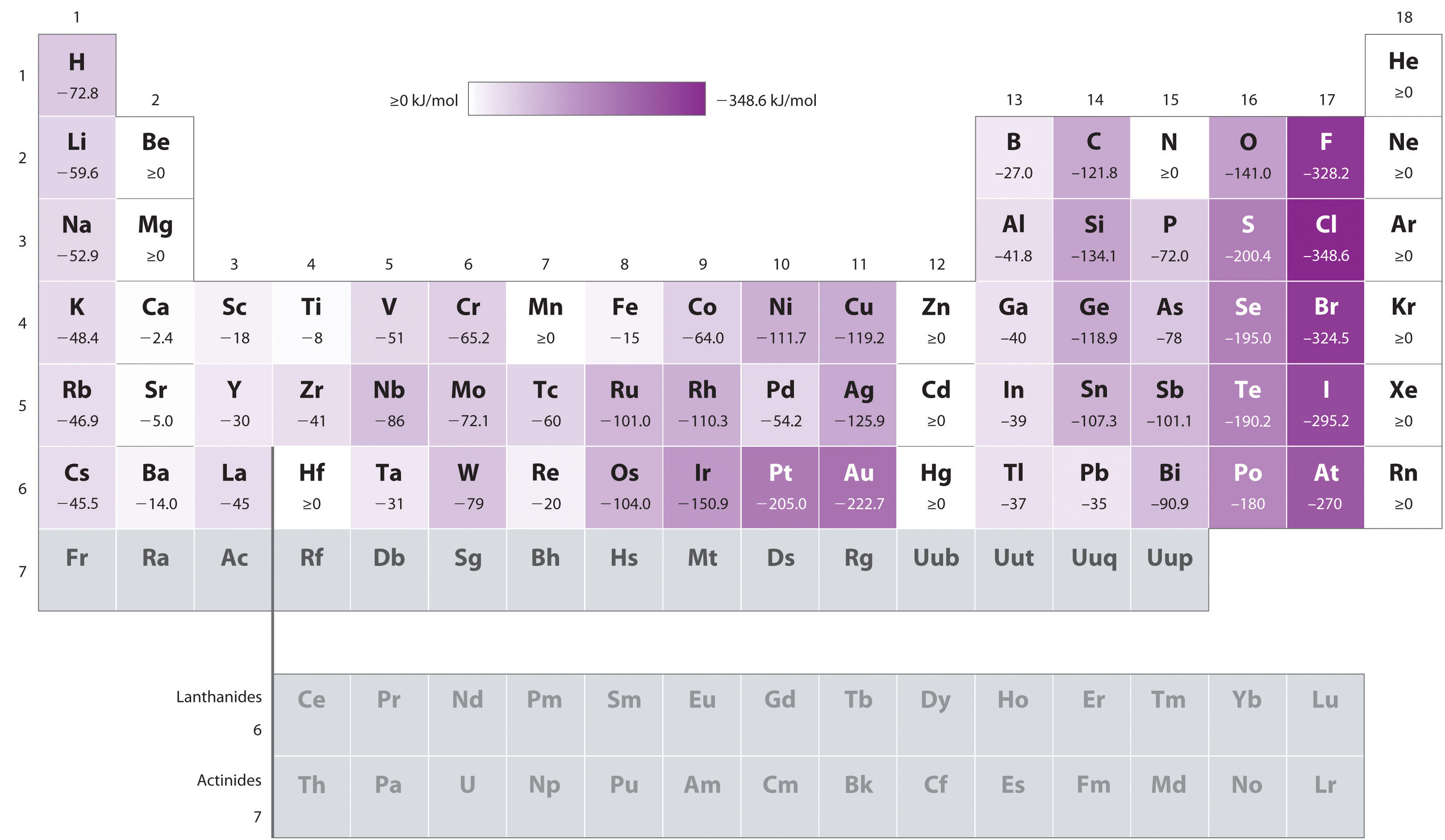
az Atomok a legnagyobb sugarak, amelyek a legalacsonyabb ionizációs energiák (affinitása a saját valence elektronok), továbbá a legalacsonyabb affinitást egy hozzáadott elektron. Ennek a tendenciának azonban két fő kivétele van:
- a Periódusos táblázat második sorában a B-F elemek elektronhatásai kevésbé negatívak, mint a harmadik sorban közvetlenül alatta lévő elemek., Nyilvánvaló, hogy az elektronok által tapasztalt megnövekedett elektron–elektron visszaverődések, amelyek a viszonylag kicsi 2P pályákra korlátozódnak, rövid nukleáris távolságokon legyőzik a megnövekedett elektron–mag vonzerőt. Ezért a fluor kisebb affinitással rendelkezik egy hozzáadott elektronhoz, mint a klór. Következésképpen a harmadik sor elemei (n = 3) a legtöbb negatív elektron affinitással rendelkeznek. Lejjebb egy oszlop, a vonzás egy hozzáadott elektron csökken, mert az elektron belép egy orbitális távolabb a mag., Az elektron-elektron visszaverődések szintén csökkennek, mivel a vegyértékű elektronok nagyobb mennyiségű helyet foglalnak el. Ezek a hatások Általában megszakítják egymást, így a családon belüli elektron affinitás változásai sokkal kisebbek, mint az ionizációs energia változásai.
- az alkáliföldfémek elektronhatásai a Be-től a Ba-ig negatívabbá válnak. A töltött ns2 és az üres NP részhéj közötti energiaeloszlás az n növekedésével csökken, így a nehezebb elemekből származó anion kialakulása energetikailag kedvezőbb lesz.,
a második és a magasabb elektronhatások egyenletei hasonlóak a második és magasabb ionizációs energiák egyenleteihez:
\
mint láttuk, az első elektron affinitás az atom elektronkonfigurációjától függően nulla vagy negatív lehet. Ezzel szemben a második elektron affinitása mindig pozitív, mivel a dianionban a megnövekedett elektron–elektron visszaverődés sokkal nagyobb, mint a mag vonzereje az extra elektronok számára., Például, az első elektron affinitás, az oxigén -141 kJ/mol, de a második elektron affinitást +744 kJ/mol:
\
\
Így megalakult egy gáznemű-oxid (\(O^{2−}\)) ion ez energetikailag nagyon kedvezőtlen (becsült hozzáadásával mindkét lépés):
\
Míg az első elektron affinitást lehet negatív, pozitív, illetve nulla, a második elektron affinitást mindig pozitív.,
ha energiára van szükség mind a pozitív töltésű kationok, mind a monatomi polianionok kialakításához, miért alakulnak ki olyan ionos vegyületek, mint a \(MgO\), \(Na_2S\) és \(Na_3P\) egyáltalán? A stabil ionos vegyületek kialakulásának legfontosabb tényezője a kristályos sóban lévő kationok és anionok kedvező elektrosztatikus kölcsönhatása.
példa \(\PageIndex{1}\): kontrasztos elektron affinitások Sb, Se, és Te
a periodikus táblázatban szereplő pozícióik alapján, melyik Sb, Se, vagy Te szeretné megjósolni, hogy a legtöbb negatív elektron affinitás?,
adott: három elem
kért: elem a legtöbb negatív elektron affinitás
stratégia:
- keresse meg az elemeket a periódusos rendszerben. Használja az elektron affinitások trendjeit, amelyek egy oszlopba esnek ugyanazon csoport elemeihez. Hasonlóképpen használja az elektron affinitások trendjeit balról jobbra az ugyanabban a sorban lévő elemek esetében.
- helyezze az elemeket sorrendben, felsorolva az elemet a legtöbb negatív elektron affinitással.,
megoldás:
A tudjuk, hogy az elektron affinitások kevésbé negatívak lesznek egy oszlopon (kivéve a második sor elemeinek rendellenesen alacsony elektron affinitásait), így megjósolhatjuk, hogy az Se elektron affinitása negatívabb, mint a Te. Azt is tudjuk, hogy az elektron affinitások egyre negatívabb balról jobbra egy sorban, és hogy a csoport 15 elemek általában értékek, amelyek kevésbé negatív a vártnál., Mivel az SB a te bal oldalán található, és a 15. csoportba tartozik, azt jósoljuk, hogy a Te elektron affinitása negatívabb, mint az Sb. Az Általános sorrend Se < Te < Sb, tehát az Se a három elem közül a negatív elektron affinitással rendelkezik.