az elemek kölcsönhatása attól függ, hogy az elektronok hogyan vannak elrendezve, és hány nyílás van az elektronok számára a legkülső régióban, ahol az elektronok jelen vannak egy atomban. Az elektronok olyan energiaszinten léteznek, amelyek héjakat képeznek a mag körül. A legközelebbi héj akár két elektront is tartalmazhat. A maghoz legközelebb eső héjat mindig először töltik meg, mielőtt bármilyen más héj feltölthető. A hidrogénnek egy elektronja van, ezért csak egy folt van elfoglalva a legalacsonyabb héjon belül., A Héliumnak két elektronja van, ezért két elektronjával teljesen kitöltheti a legalacsonyabb héjat. Ha megnézzük a periódusos rendszert, látni fogjuk, hogy a hidrogén és a hélium az egyetlen két elem az első sorban. Ennek oka az, hogy csak az első héjában vannak elektronok. A hidrogén és a hélium az egyetlen olyan elem, amelynek a legkisebb a héja, és nincs más héja.
a második és a harmadik energiaszint akár nyolc elektront is tartalmazhat. A nyolc elektron négy párban van elrendezve, és minden párban egy-egy pozíciót egy elektron tölt be, mielőtt bármelyik pár befejeződik.,
ismét a periódusos táblázatot nézi (1. ábra), észreveszi, hogy hét sor van. Ezek a sorok megfelelnek azoknak a kagylóknak a számának, amelyeket az adott sorban lévő elemek tartalmaznak. Az elemek egy adott sorban egyre több elektron, mint az oszlopok folytassa balról jobbra. Bár minden elem azonos számú héjjal rendelkezik, nem minden kagyló teljesen tele van elektronokkal. Ha megnézzük a periódusos rendszer második sorát, akkor lítium (Li), berillium (Be), bór (B), szén (C), nitrogén (N), oxigén (O), fluor (F) és neon (Ne) található., Ezek mind elektronokkal rendelkeznek, amelyek csak az első és a második héjat foglalják el. A lítiumnak csak egy elektronja van a legkülső héjában, a berilliumnak két elektronja van, a bórnak három, stb., amíg az egész héj nyolc elektronnal van feltöltve, mint a neon esetében.
nem minden elem rendelkezik elegendő elektronral a legkülső héjak kitöltéséhez, de egy atom a legstabilabb, ha a legkülső héj összes elektronpozíciója tele van., Mivel ezek a megüresedett a legkülső héjak, látjuk a kialakulását kémiai kötések, vagy kölcsönhatások két vagy több azonos vagy különböző elemek, amelyek eredményeként a kialakulását molekulák. A nagyobb stabilitás elérése érdekében az atomok hajlamosak teljesen kitölteni külső héjaikat, és más elemekkel kötődnek ahhoz, hogy ezt a célt elektronok megosztásával, elektronok elfogadásával egy másik atomból, vagy elektronok adományozásával egy másik atomhoz., Mivel az alacsony atomszámú elemek legkülső héjai (a kalciumig, a 20-as atomszámmal) nyolc elektronot tarthatnak, ezt oktettszabálynak nevezik. Egy elem adományozhat, elfogadhat vagy megoszthat elektronokat más elemekkel, hogy kitöltse külső héját, és kielégítse az oktettszabályt.
Ha egy atom nem tartalmaz azonos számú protont és elektront, akkor ionnak nevezzük. Mivel az elektronok száma nem egyenlő a protonok számával, minden ion nettó töltéssel rendelkezik. A pozitív ionokat elektronok elvesztésével alakítják ki, kationoknak nevezik., A negatív ionok elektronok megszerzésével alakulnak ki, amelyeket anionoknak neveznek.
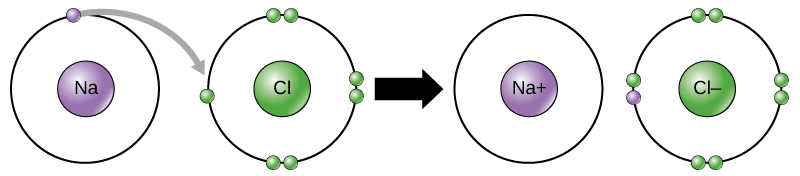
például a nátriumnak csak egy elektronja van a legkülső héjában. A nátriumnak kevesebb energiára van szüksége ahhoz, hogy ezt az egy elektronot adományozza, mint hogy hét további elektront fogadjon el a külső héj kitöltéséhez. Ha a nátrium elveszít egy elektronot, akkor most 11 protonja és csak 10 elektronja van, így a teljes töltése +1. Most nátrium-ionnak nevezik.
a klóratomnak hét elektronja van a külső héjában. Ismét energiahatékonyabb a klór számára, hogy egy elektronot szerezzen, mint hét elvesztését., Ezért hajlamos arra, hogy elektront nyerjen egy 17 protonnal és 18 elektronral rendelkező ion létrehozásához, ami nettó negatív (-1) töltést eredményez. Most kloridionnak nevezik. Az elektronok egyik elemről a másikra történő mozgását elektronátvitelnek nevezik. Az 1. ábra szemlélteti, hogy egy nátriumatomnak (Na) csak egy elektronja van a legkülső héjában, míg egy klóratomnak (CL) hét elektronja van a legkülső héjában. A nátrium-atom egy elektront adományoz a héj ürítésére, a klór atom pedig elfogadja azt az elektront, hogy kitöltse a héját, kloridvá válva., Mindkét Ion most kielégíti az oktettszabályt, és teljes legkülső héjakkal rendelkezik. Mivel az elektronok száma már nem egyenlő a protonok számával, mindegyik most ion, +1 (nátrium) vagy -1 (klorid) töltéssel rendelkezik.

ionos kötések
négyféle kötés vagy kölcsönhatás létezik: Ionos, kovalens, hidrogénkötések és van der Waals kölcsönhatások. Az ionos és kovalens kötések olyan erős kölcsönhatások, amelyek nagyobb energiabevitelt igényelnek a szétváláshoz. Amikor egy elem egy elektront adományoz a külső héjából, mint a fenti nátrium-atomban, pozitív ion keletkezik (2.ábra). Az elektront elfogadó elem negatív töltésű., Mivel a pozitív és negatív töltések vonzzák egymást, ezek az ionok együtt maradnak és ionos kötést vagy ionok közötti kötést alkotnak. Az elemek az egyik elem elektronjával kötődnek, túlnyomórészt a másik elemhez. Amikor a Na + és a Cl– ionok NaCl-t termelnek, a nátriumatomból származó elektron a klór atom másik hetesével marad, a nátrium – és kloridionok pedig nettó nulla töltésű ionok rácsában vonzzák egymást.,
kovalens kötések
egy másik típusú erős kémiai kötés két vagy több atom között kovalens kötés. Ezek a kötések akkor alakulnak ki, amikor egy elektron két elem között oszlik meg, és az élő szervezetekben a kémiai kötés legerősebb és leggyakoribb formája. Kovalens kötések alakulnak ki a sejtjeink biológiai molekuláit alkotó elemek között., Az ionos kötésekkel ellentétben a kovalens kötések nem disszociálódnak a vízben.
érdekes módon a vegyészek és a biológusok különböző módon mérik a kötés erősségét. A vegyészek mérik a kötés abszolút erősségét (az elméleti szilárdságot), míg a biológusokat jobban érdekli, hogyan viselkedik a kötés egy biológiai rendszerben, amely általában vizes (vízalapú). A vízben az ionos kötések sokkal könnyebben szétesnek, mint a kovalens kötések, így a biológusok azt mondják, hogy gyengébbek, mint a kovalens kötések. Ha megnézed a kémia tankönyv, látni fogod, valami más., Ez egy nagyszerű példa arra, hogy ugyanazok az információk hogyan vezethetnek különböző válaszokhoz attól függően, hogy milyen perspektívából nézi azt.
a vízmolekulákat alkotó hidrogén-és oxigénatomok kovalens kötésekkel vannak összekötve. A hidrogénatomból származó elektron a hidrogénatom külső héja és az oxigénatom külső héja között osztja el idejét. Az oxigénatom külső héjának teljes kitöltéséhez két hidrogénatomból két elektronra van szükség, így a H2O “2” indexe., Az elektronok meg vannak osztva az atomok között, elosztva az idejüket közöttük, hogy” kitöltsék ” mindegyik külső héját. Ez a megosztás alacsonyabb energiájú állapot az összes érintett Atom számára, mintha külső héjuk nélkül léteznének.
kétféle kovalens kötés létezik: poláris és nempoláris. Nem poláris kovalens kötések alakulnak ki ugyanazon elem két atomja között vagy különböző elemek között, amelyek egyenlően osztják meg az elektronokat. Például egy oxigénatom kötődhet egy másik oxigénatomhoz, hogy kitöltse külső héját., Ez az összefüggés nem poláris, mert az elektronok egyenlően oszlanak el az egyes oxigénatomok között. Két kovalens kötés alakul ki a két oxigénatom között, mivel az oxigénhez két megosztott elektron szükséges a legkülső héj kitöltéséhez. A nitrogénatomok három kovalens kötést alkotnak (más néven hármas kovalens) két nitrogénatom között, mivel minden nitrogénatomnak három elektronra van szüksége a legkülső héj kitöltéséhez. A metán (CH4) molekulában egy másik példa a nempoláris kovalens kötésre. A szénatomnak négy elektronja van a legkülső héjában, és még négy kell ahhoz, hogy kitöltse., Ezt a négyet négy hidrogénatomból kapja,mindegyik atomból egyet. Ezek az elemek mind egyenlően osztják meg az elektronokat, négy nem poláris kovalens kötést hozva létre (3.ábra).
poláris kovalens kötésben az atomok által megosztott elektronok több időt töltenek közelebb az egyik maghoz, mint a másik maghoz. Az elektronok egyenlőtlen eloszlása miatt a különböző magok között kissé pozitív (δ+) vagy enyhén negatív (δ–) töltés alakul ki. A vízben lévő hidrogén és oxigénatomok kovalens kötései poláris kovalens kötések., A megosztott elektronok több időt töltenek az oxigénmag közelében, kis negatív töltést adva, mint a hidrogénmagok közelében, kis pozitív töltést adva ezeknek a molekuláknak.

hidrogénkötések
Az ionos és kovalens kötések olyan erős kötések, amelyek jelentős energiát igényelnek a megszakításhoz. Az elemek között azonban nem minden kötés ionos vagy kovalens kötés. Gyengébb kötvények is kialakulhatnak. Ezek a pozitív és a negatív töltések között előforduló attrakciók, amelyek nem igényelnek sok energiát a megszakításhoz. Két gyakran előforduló gyenge kötés a hidrogénkötések és a van der Waals kölcsönhatások. Ezek a kötések a víz egyedi tulajdonságait, valamint a DNS és a fehérjék egyedi szerkezetét eredményezik.,
amikor egy hidrogénatomot tartalmazó poláris kovalens kötések alakulnak ki, az abban a kötésben lévő hidrogénatom kissé pozitív töltéssel rendelkezik. Ennek oka az, hogy a megosztott elektront erősebben húzzák a másik elem felé, távol a hidrogénmagtól. Mivel a hidrogénatom kissé pozitív (δ+), vonzódik a szomszédos negatív részleges töltésekhez (δ–). Amikor ez megtörténik, gyenge kölcsönhatás lép fel az egyik molekula hidrogénatomjának δ+ töltése és a másik molekula δ– töltése között. Ezt az interakciót hidrogénkötésnek nevezik., Ez a fajta kötés gyakori; például a víz folyékony természetét a vízmolekulák közötti hidrogénkötések okozzák (4.ábra). A hidrogénkötések a víz számára egyedülálló tulajdonságokat biztosítanak, amelyek fenntartják az életet. Ha nem lenne hidrogénkötés, a víz inkább gáz lenne, mint folyadék szobahőmérsékleten.

hidrogénkötések alakulhatnak ki a különböző molekulák között, és nem mindig kell vízmolekulát tartalmazniuk. A poláris kötésekben lévő hidrogénatomok bármely molekulán belül kötéseket képezhetnek más szomszédos molekulákkal. Például a hidrogénkötések két hosszú DNS-szálat tartanak össze, hogy a DNS-molekula jellegzetes kettős szálú szerkezetét adja. A fehérjék háromdimenziós szerkezetéért a hidrogénkötések is felelősek.,
van der Waals Kölcsönhatások
Mint a hidrogén kötések, van der Waals kölcsönhatás gyenge látnivalók, vagy molekulák közötti kölcsönhatások. Ezek a poláris, kovalensen kötött, különböző molekulákban lévő atomok között fordulnak elő. Ezek közül a gyenge látnivalók közül néhányat ideiglenes részleges töltések okoznak, amikor az elektronok egy mag körül mozognak. Ezek a molekulák közötti gyenge kölcsönhatások fontosak a biológiai rendszerekben.