először is meg kell tudni, hogy hány vegyértékű elektronok. Ezt úgy teheti meg, hogy (1) rajzolja az elektron konfigurációját elemenként, vagy (2) konzultál az időszakos táblával.,
Ha úgy döntött, hogy felhívja az elektron konfiguráció per elem, akkor valami ilyesmi:
#N# (rendszám = 7) : #1s^2# #színű (piros) (2^2)# #színű (piros) (2p^3)# (5 külső elektronok)
#O# (atomi száma = 8) : #1s^2# #színű (piros) (2^2)# #színű (piros) (2p^4)# (6 külső elektronok)
Ha azt választotta, hogy forduljon a periódusos rendszer, most vettem észre, hogy #N# tartozik Csoport 5A, míg #O# tartozik Csoport 6A. A csoport számát jelöli, a szám a külső elektronok.,
most, hogy ismeri a valence elektronok számát elemenként, ki kell számítania a #NO_3^” -1 ” # ion teljes valence elektronjait.
5 + (3 x 6) = 23 elektron
De mivel az egész molekula -1 töltéssel rendelkezik, ezt is hozzá kell adnia. Tehát a valence elektronok teljes száma 24.
a következő lépés a rajzolás. Általában a kémiai képlet első eleme a központi atom. Ebben az esetben a #N# atomot három #O# Atom veszi körül.,
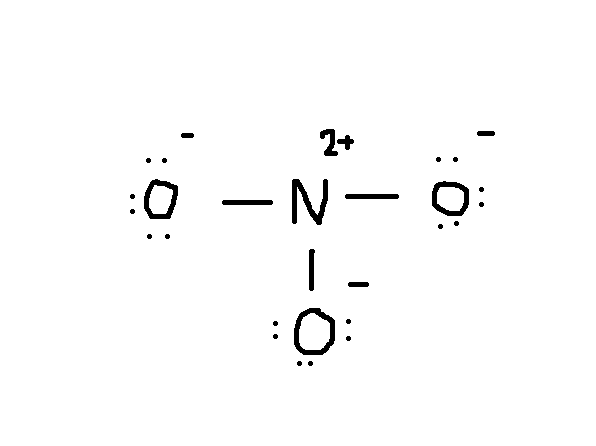
vegye figyelembe, hogy az #O# magányos elektronpárja is szerepel az ábrán. Ha a fenti rajzon az elektronok teljes számát számolja, akkor már 24 elektron (az egyvonal 2 elektronnak számít). De ez a rajz megsértette az oktettszabályt, mivel a központi atomnak csak 6 elektronja van a helyes 8 szám helyett. Szóval mi a teendő?
adjon hozzá egy másik kötést, de hol?, 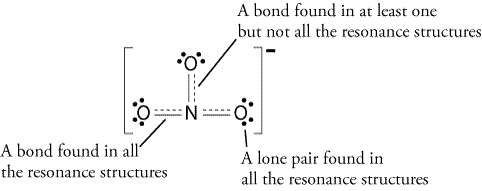
Ezért a rezonancia szerkezete így néz ki: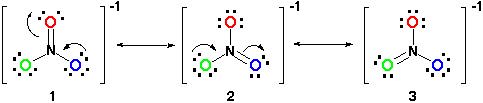
a rezonancia szerkezetek helyes, mivel minden következik a oktett szabály van összesen 24 elektronok. Csak vegye figyelembe, hogy az egyetlen kötés mozog a Pi (#pi#) kötés vagy laikus távon, a kettős kötés és az egyik elektron pár # O # atom.