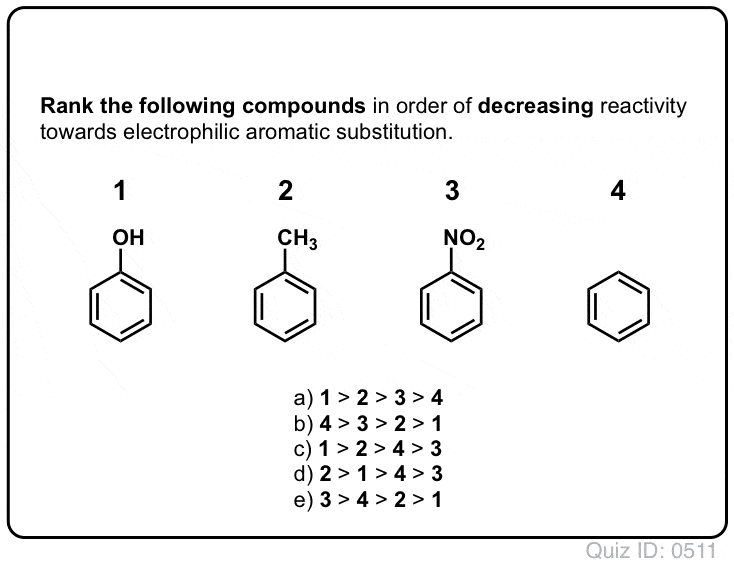
az előző poszt bemutattuk ortho -, para – és meta-rendezők elektrofil aromás szubsztitúció. Ezt megelőzően lefedtük az elektrofil aromás szubsztitúció mechanizmusát, és megmutattuk, hogy a mechanizmus egy karbokációs közbenső útján megy végbe.,
ma össze fogjuk kötni ezt a két fogalmat, és megpróbáljuk megmutatni, hogy egy szubsztituens Orto -, para – vagy meta-rendező attól függ, hogy a szubsztituens hogyan befolyásolja a karbokációs közbenső stabilitását.
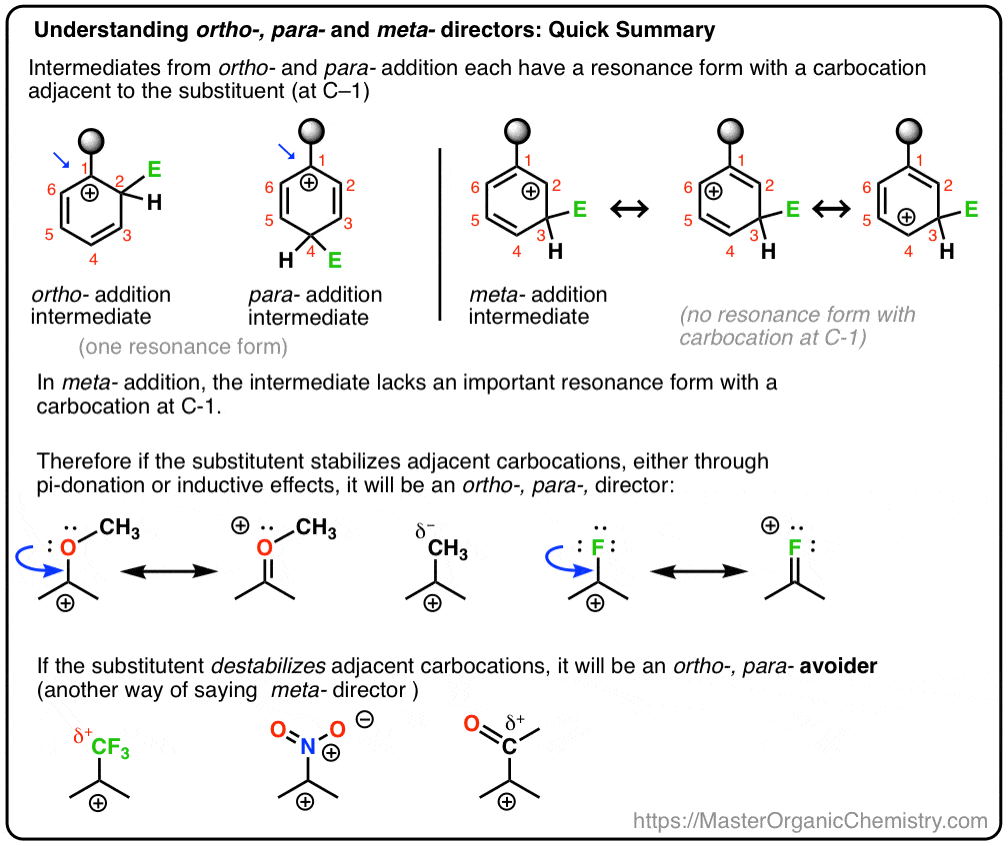
és azt is látni fogjuk, hogy miért lehet A meta – director alternatív neve, “ortho -, para – avoider”. :–)
Tartalomjegyzék
- a Karbokációkat szomszédos atomok stabilizálják, magányos párokkal
- 1. esettanulmány :Orto -, para-rendező (OCH3)
- Igen, az oxigén elektronegatív., De Adománya A Magányos Pár Több Mint Teszi Fel!
- az Orto para Director reakció-energia diagramja
- esettanulmány # 2: meta-director (CF3).
- amit mi “meta– Directors” – nak hívunk, inkább “Orto–, para – Avoiders”
- A meta-Director Reakcióenergia diagramja
- miért vannak a halogének Orto -, Para-Rendezők?
- Megjegyzések
- kvíz magad!,
- (haladó) referenciák és további olvasmányok
A Karbokációkat a szomszédos atomok stabilizálják, magányos párokkal
gondoljunk vissza arra, hogy mely tényezők növelik a karbokációk stabilitását.
A Karbokációk elektronszegény Fajok, hat elektronnal a valenciahéjukban. Tehát minden szubsztituens, amely elektronsűrűséget adhat a karbokáció felé, stabilizálódik. Ide tartoznak a következők:
- elektron-felszabadító szubsztituensek, amelyek “sigma-donorokként” működhetnek (pl., sok alkilcsoport, amelyek az elektron sűrűségét induktív hatások révén adományozzák )
- szomszédos atomok magányos párokkal, amelyek “pi donorokként” működhetnek a karbokációhoz
- szomszédos C–C pi kötések, amelyek stabilizálhatják a karbokációt töltés delokalizációval (“rezonancia stabilizáció”, más szóval).
és a karbokationt destabilizáló tényezők?
- bármely szubsztituens, amely eltávolítja az elektronsűrűséget egy karbokációból, például erős elektronkivonó csoportokból.
tehát itt egy gyors kvíz., Tekintettel a fent leírtakra, az alábbi két karbocáció közül melyik lesz stabilabb?
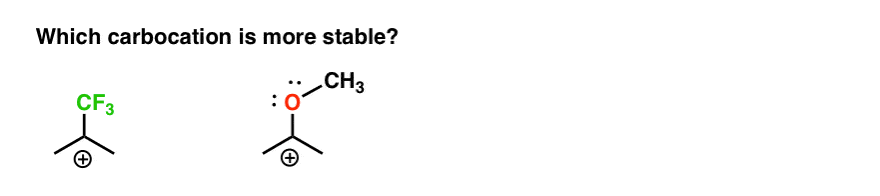
ha jól tudja megválaszolni ezt a kérdést, akkor leginkább az Orto-, para – és meta – rendezők közötti különbség megértése felé halad.
vizsgáljunk meg két esettanulmányt. Megnézzük a benzol általános elektrofil aromás szubsztitúciós reakcióját Orto -, para-direktorral (metoxibenzol), és megvizsgáljuk az Orto, meta és para pozícióból származó intermediereket., Ezután ugyanazt a gyakorlatot végezzük egy meta-rendezővel (trifluor-metil-benzol).
a folyamat során reméljük, hogy megértjük, hogy a metoxibenzol miért részesíti előnyben az Orto– és para-termékeket, míg a trifluor-metil-benzol kedvez a meta-terméknek.
1. esettanulmány: az Orto -, para-Director (OCH3)
a metoxibenzol elektrofil aromás szubsztitúciója általában Orto – és para – termékeket ad, nagyon kevés meta-val ., Itt van, mi történik a nitrálás, például:
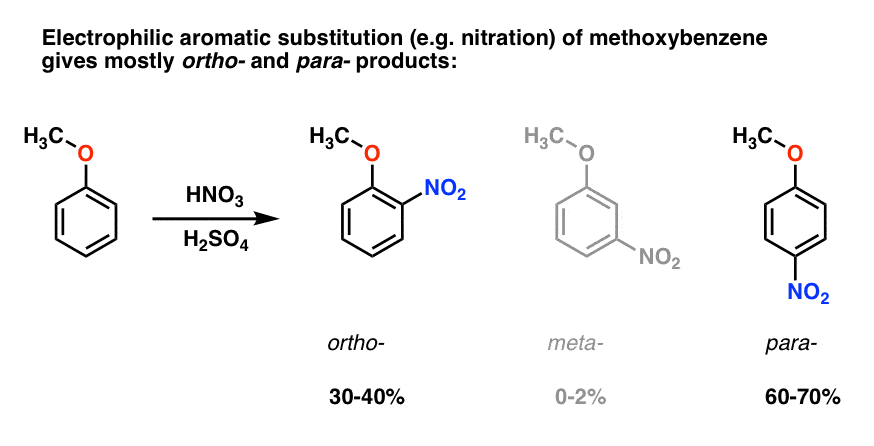
a para – termék dominál (60-70%), Orto – szoros mögött (30-40%), és csak egy nyoma a meta– .
miért?
3. Igen, Az Oxigén Elektronegatív. De Adománya A Magányos Pár Több Mint Teszi Fel!
itt van az Orto – termékhez vezető út., Megszakítunk egy C–C pi kötést, és egy új C-E kötést alkotunk (ahol az E egy általános elektrofíliát képvisel), amely rezonancia-stabilizált karbokciót generál:
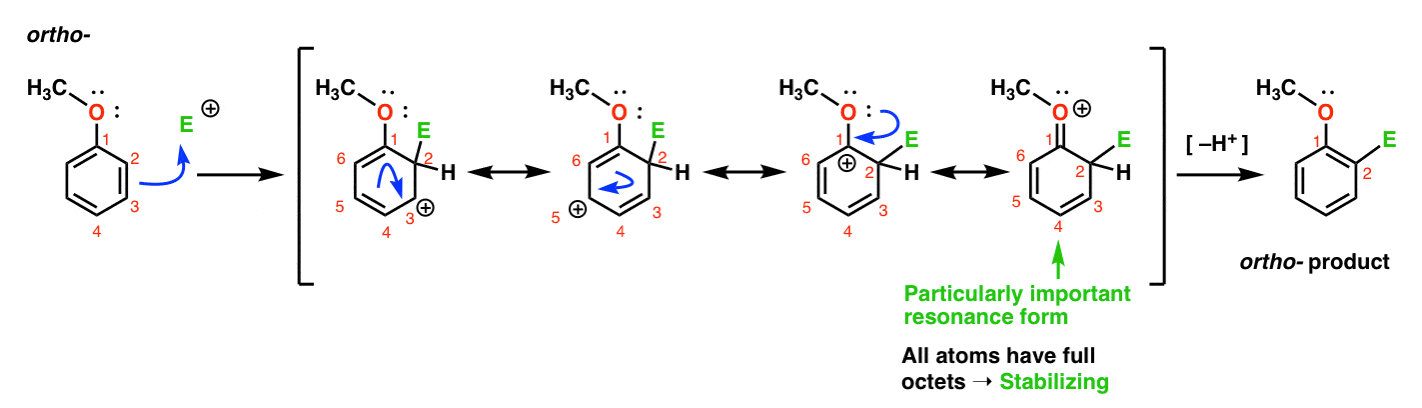
ha alaposan megnézed, vegye figyelembe, hogy négy rezonancia formát alakíthatunk ki . Három közülük teljes karbokációt hordoz (C1, C3 és C5), de ez a negyedik – a rezonancia forma, ahol van egy C=O pi kötés – ami különösen fontos. Miért? Ebben a rezonancia formában az összes szénatom teljes oktett elektronokkal rendelkezik., Ennek oka az, hogy a gyűrűhöz közvetlenül kötött oxigén egy magányos párot adhat a szomszédos karbokációnak, amely pi kötést képez. Ez egy példa a pi adományozásra.
itt van az elektrofil támadásának útja a meta-helyzetben. Vegye figyelembe a különbséget!
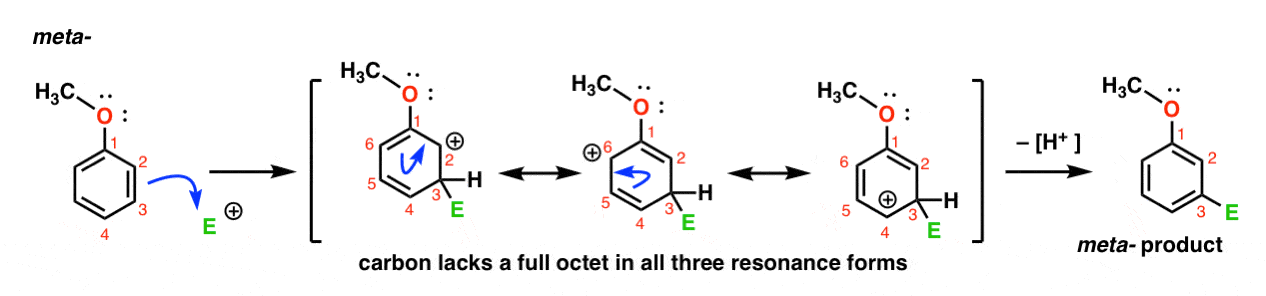
az elektrofil támadása c-3-nál olyan karbokációt eredményez, amely rezonancián keresztül C2, C4 és C6-ra osztható. A karbokciót azonban nem lehet “mozgatni” a C1-re, ami azt jelenti, hogy nincs ésszerű rezonancia forma, ahol minden atomnak teljes oktettje van.,
Ez a meta – carbocation intermedier sokkal kevésbé stabil, mint az Orto-carbocation intermedier.
Végül itt van a para – termékhez vezető reakció:
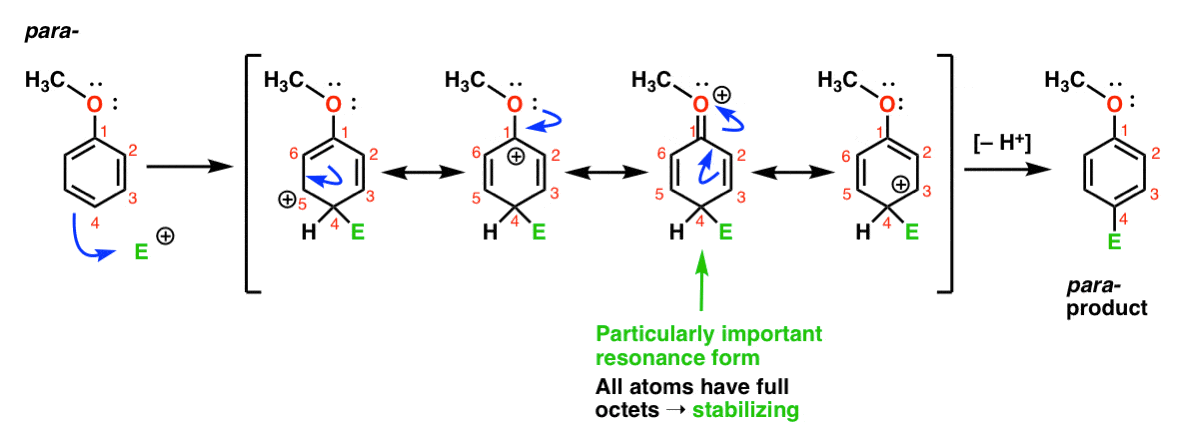
itt ismét rezonancia formákat rajzolhatunk a C1, C3 és C5 karbocációival, valamint egy negyedik rezonancia formát, ahol a csatolt oxigénatom egy elektronpárt ad a C1 karbokációjához, ami teljes oktettet eredményez szénnél. Ez a helyzet lényegében ugyanaz, mint az Orto – közbenső.,
tehát a rezonanciaformák elemzésével (és a szavam megjelölésével a közeljövőben meg lehet kérni, hogy ugyanezt tegye egy teszten) láthatjuk, hogy az Orto – és para– addícióból származó közbenső karbocációk lényegesen stabilabbak, mint a meta– kiegészítés közbenső.
Ez magyarázza, hogy miért az Orto – és para – termékek dominálnak, és a meta – termék kisebb.
hasznos lehet ezt megjeleníteni egy reakcióenergia-diagram rajzolásával.
4., Az Orto para Director
reakció-energia diagramja az Orto – és para – addíciós termékekhez vezető átmeneti állapot energiája sokkal alacsonyabb, mint a meta– .
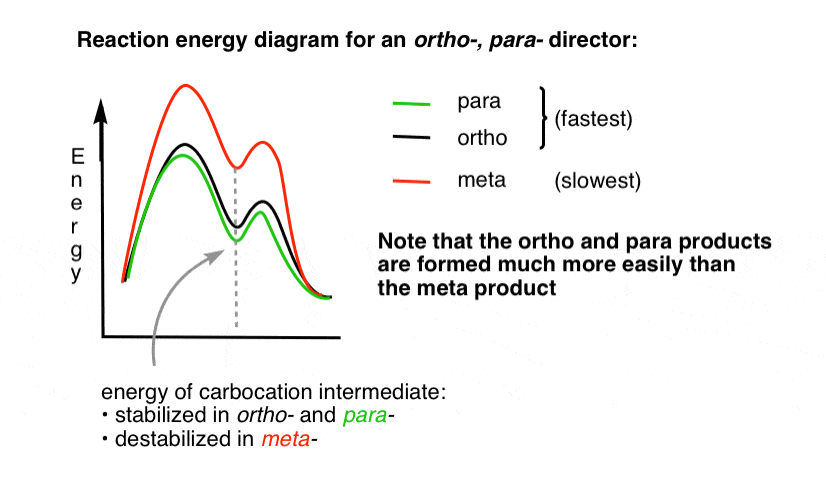
egy kérdés – miért gondolja, hogy a para – előnyben részesíthető (pl. 60% -70%– os hozam a nitrációs para-termék esetében, fent, szemben az Orto – esetében 30-40% – kal), annak ellenére, hogy két Orto-pozíció van, és csak egy para -?
gondolj erre egy percre, és az alábbiakban foglalkozunk vele.
5. Esettanulmány #2: a meta-igazgató (CF3).
Tehát mi a helyzet a CF3-mal?, Miért ad meta-termékeket? Csináljuk ugyanazt az elemzést.
itt van az Orto – termékhez vezető út. A fenti Orto-intermedierhez hasonlóan három rezonancia formát is rajzolhatunk, amelyek a karbokációt C1-re, C3-ra, illetve C5-re helyezik.
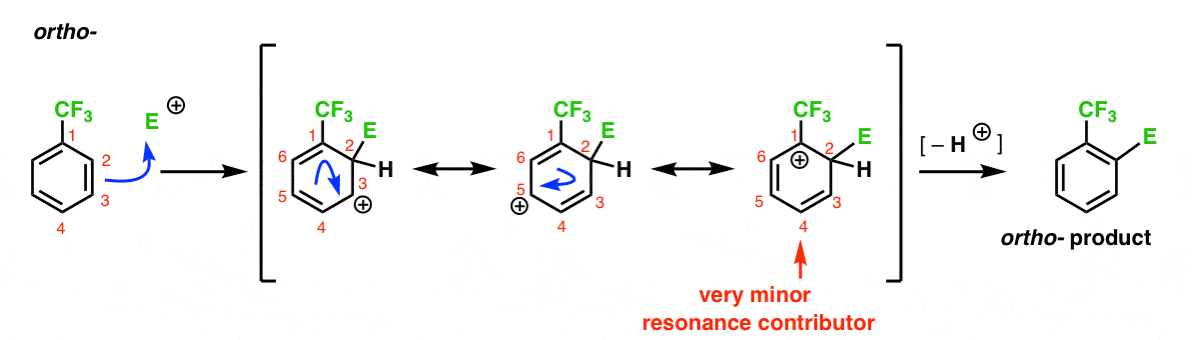
tehát mi a különbség ebben az esetben?
ami más, az egy erős elektron kivonó csoport (CF3) jelenléte a C1-en, és ez teljesen megváltoztatja a labdajátékot.
mint mondtuk, a karbokációkat destabilizálják a szomszédok, amelyek visszavonják az elektronsűrűséget., Ezért azt várnánk, hogy ez egy nagyon kis rezonancia hozzájárul, azzal az eredménnyel, hogy a pozitív töltés csak delokalizált felett C3 és C5.
megjegyeztük, hogy a CF3 meta-rendező. Ésszerű azt gondolni, hogy van valami a meta-ban-ami különösen stabilvá teszi. Az alábbi meta– termék közbenső elemzésével láthatja, miért?
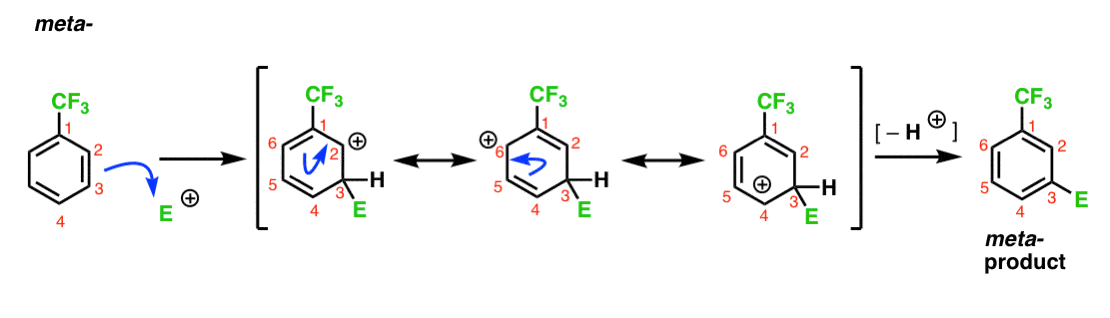
Hmmm. Nincs köztes, ahol a szénnek teljes oktettje van. Nincsenek különösen stabil rezonancia formák.
Ez egyfajta “meh”, nem igaz?
6., Amit “meta– rendezőknek” nevezünk, inkább “Orto -, para– Avoiders”
másrészt nincsenek különösen instabil rezonancia formák sem. Mivel a pozitív töltés lokalizálódik C2, C4, C6, a helyzet, amikor a pozitív töltés közvetlenül szomszédos elektron-visszavonó CF3 csoport kerülendő. A pozitív töltést így szépen elhatárolják az egész gyűrűben, ellentétben a fenti Orto-helyzettel.
tehát ez egy “kevésbé rossz” közbenső, mint az ortho-.,
végül a para-közbenső ugyanaz a probléma, mint az ortho -; köztes pozitív töltéssel a C1-en, a CF3 mellett.
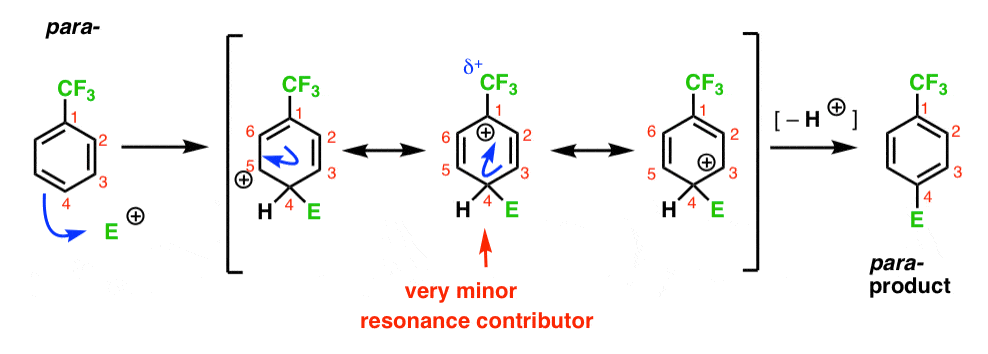
Ez csak két fontos rezonancia formát eredményez, ami kevésbé delokalizált (tehát kevésbé stabil) karbokációs közbensőhez vezet.
alsó sor: a meta carbocation intermedier stabilabb, mint az Orto– vagy a para – intermedierek.
de nem azért, mert maga a szubsztituens stabilizáló hatással van a meta– közbenső értékre. .,
azt állítanám, hogy hasznosabb úgy gondolni a metára, hogy kevésbé instabil, mint az Orto – és para -.
ily módon nem annyira, hogy a CF3 meta-rendező, annyira, hogy ” Orto–, para-avoider. “
7. A reakcióenergia Diagram egy meta-rendező
itt egy vázlatot a reakció energia diagram:
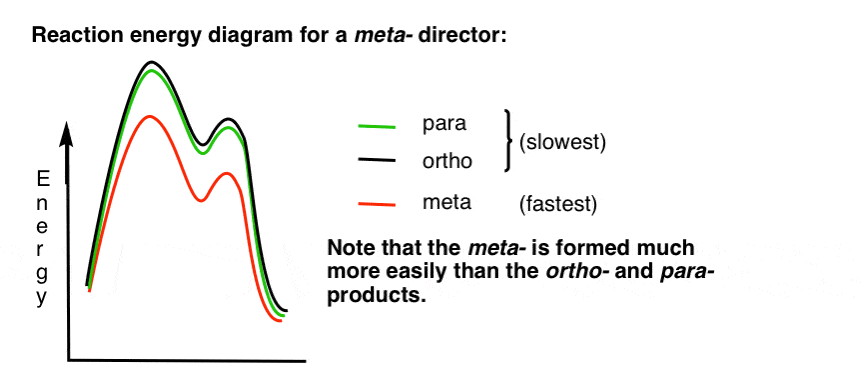
rendben.
vissza az eredeti kérdéshez. Tehát melyik karbokáció stabilabb?,
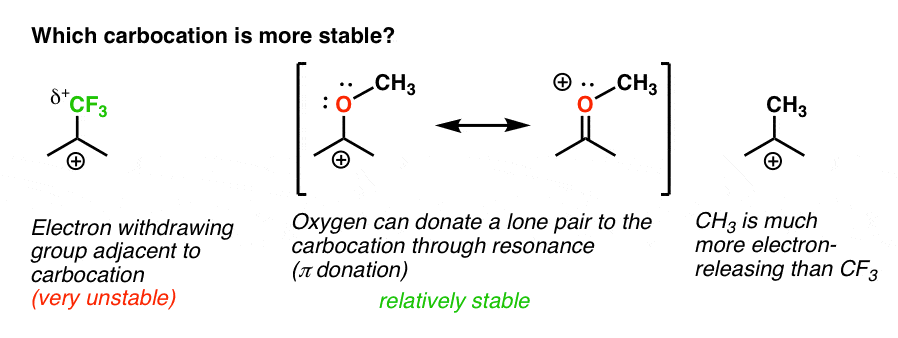
nyilvánvaló, hogy a szomszédos oxigénnel rendelkező, magányos párral rendelkező karbokáció sokkal stabilabb, mint egy elektron-visszavonó csoport, például a CF3 melletti karbokáció.
és ez magában foglalja az och3-hoz hasonló Orto -, para – rendező és a CF3-hoz hasonló meta-rendező közötti különbséget.
érdemes megjegyezni, hogy a legtöbb alkilcsoportnak (például a CH3-nak ) nincs magányos párja, de még mindig Orto -, para-rendezők., Ez egybevág azzal, amit tanultunk, mielőtt arról, hogy alkil csoportok általában stabilizálódik a carbocations – emlékezzünk vissza, hogy carbocation stabilitás általában növeli a helyettesítő
Tehát arról, hogy azok a para– termékek…
Miért para – előállított termékek nagyobb mértékben, mint ortho- ?
a válasz steric akadály.
A Para pozíció támadása kevésbé terheli a szubsztituenst,mint az Orto – pozíciók támadása.
akkor miért vannak a halogének Orto -, Para-Rendezők?
Ez hagy minket a kissé trükkös példa halogének.,
miért vannak fluor, klór, bróm és jód Orto-, para – rendezők, még akkor is, ha deaktiválják a csoportokat?
a válasz nem meglepő, ha követte, de ezt a következő hozzászólásig hagyjuk, mert ez már elég hosszú.
következő hozzászólás: miért halogens ortho -, para-rendezők?
Megjegyzések
1. Megjegyzés. Helyesebb azt mondani, hogy az Orto – és para – termékek dominálnak, mivel az ezekhez a termékekhez vezető átmeneti állapotok energiájukban alacsonyabbak, nem pedig maguk a közbenső termékek energiái., Végül is az átmeneti állapotok energiája határozza meg az aktiválási akadályt, ezért a reakciósebességet.
2. megjegyzés. Vagy hiperkonjugáció, amelyet a legtöbb tankönyv (Maitland Jones kivételével) általában elkerül.
kvíz magad!,/div>
 Kattintson Flip
Kattintson Flip

 Kattintson Flip
Kattintson Flip 
 Kattintson Flip
Kattintson Flip 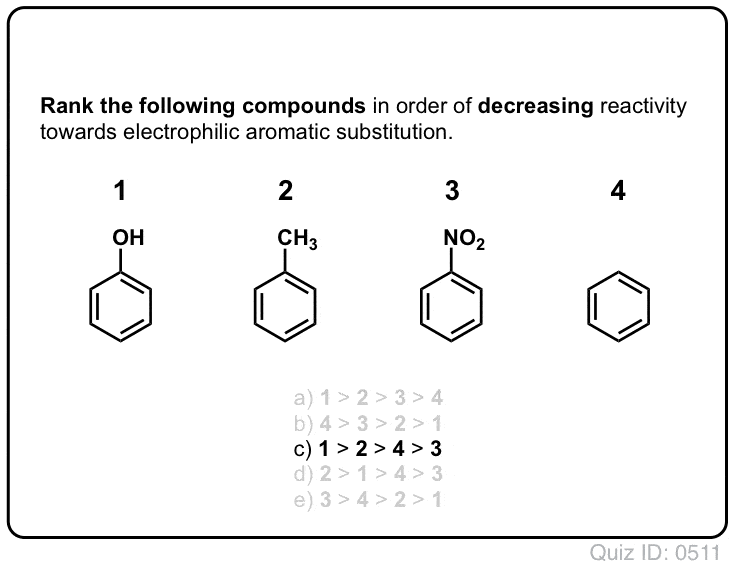
 Kattintson Flip
Kattintson Flip 
(Speciális) Hivatkozásokat, valamint a További Olvasást
- A., F. Holleman, Die direkte Einführung von Substituenten in den Benzolkern
Rec. Trav. Chim. Pays-Bas 1910, 12, 455-456
DOI: 10.1002/recl.19100291205
A. F. Holleman 1910–től azt mondta, hogy az Orto-para orientáció az aktiváláshoz, a meta orientáció pedig a deaktiváláshoz kapcsolódik. - – a szénláncok váltakozó hatásának jellege. XXIII. rész: a halogének rendellenes orientációja és az Orto–para Arány problémájára gyakorolt hatása, aromás szubsztitúcióban
Christopher Kelk Ingold és Charles Cyril Norrey Vass
J. Chem. Soc. 1928, 417-425
DOI: 10.,1039 / JR9280000417
Ez a tanulmány az 1,2-dihalobenzolok irányítóhatásait tárgyalja. - Egy észrevételek a sztérikus taszítást, valamint a hatások substituents a ortho : para arány aromás helyettesítő
P. B. D. de la Mare
J. Chem. Soc. 1949, 2871-2874
DOI: 10.1039/JR9490002871
ebben a cikkben a De La Mare különféle tényezőket tárgyal, amelyek a para túlsúlyát jelenthetik az Orto szelektivitás felett, miután az Orto termék hozamát 2-vel osztották (mivel 2 Orto pozíció van, de csak 1 para pozíció monoszubsztituált benzolokban)., - az alkilcsoportok térfogathatásai aromás vegyületekben. V. rész: a P-cymene monoszulfonációja
R. J. W. Le Fèvre
J. Chem. Soc. 1934, 1501-1502
DOI: 10.1039 / JR9340001501
A P-cymene-ben az elektrofil szulfonálás során nyert fő termék a 2-termék (Orto a metilcsoporthoz), valószínűleg a szterikumok miatt. - az alkilcsoportok hatása elektrofil kiegészítésekben és Szubsztitúciókban
COHN, H., HUGHES, E., JONES, M. and PEELING, M. G.
Nature 1952, 169, 291
DOI: 1038/169291a0
Ez a tanulmány a T-butilbenzol és a toluol nitrációját összehasonlító adatokkal rendelkezik., A T-butilbenzol sokkal p-rendezettebb, mint a toluol (79,5% para a T-butilbenzol vs. 40% para a toluol esetében), ami valószínűleg a szterikumok miatt következik be (az Orto megközelítést a bulkier t-butil csoport blokkolja). - izomerek eloszlása az etil – és Izopropilbenzol Mononitrációjában. További bizonyítékok az Izomereloszlás Szterikus hatására
Herbert C. Brown and W. Hallam Bonner
Journal of the American Chemical Society 1954, 76 (2), 605-606
DOI: 10.,A 1021 / ja01631a084
II. táblázat ebben a tanulmányban azt mutatja, hogy a monoalkilbenzolok nitrációjából nyert Orto-termék csökken, mivel az alkilcsoport nagyobb lesz (pl. a T-butilbenzol nitráláskor nagyon kevés Orto-terméket eredményez, mint a toluol). - – a szénláncok váltakozó hatásának jellege. XXII. rész: az aromás szubsztitúció valószínű orientációs mechanizmusának meghatározására tett kísérlet
Christopher Kelk Ingold és Florence Ruth Shaw
J. Chem. Soc. 1927, 2918-2926
DOI: 10.,1039 / JR9270002918
a befolyásos fizikai szerves kémikus, Prof. C. K. Ingold korai tanulmánya, amely szerint a halogénbenzolok induktív elektronkivonó, de egyidejűleg rezonancia-stabilizáló. - a Fluorobenzol elektrofil aromás Szubsztitúcióban és kapcsolódó jelenségekben fellépő rendellenes reaktivitása
Joel Rosenthal és David I., Schuster
Journal of Chemical Education 2003, 80 (6), 679
DOI: 1021/ed080p679
egy nagyon érdekes papír, alkalmas kíváncsi undergrads, és megvitatja valamit, hogy a legtöbb gyakorló szerves vegyészek tudni fogja empirikusan – fluorobenzol majdnem olyan reaktív, mint a benzol EAS vagy Friedel-kézműves reakciók, ami ellenintuitív, ha figyelembe vesszük az elektronikus hatások! - Szerves Kémia
N. Haworth, C. K. Ingold,T. A. Henry
Ann. Prog Képviselő. Chem. 1926, 23, 74-185
DOI: 10.1039/AR9262300074
egy korai tanulmány, amely az EAS irányításának hatásait tárgyalja. Pp., A 136 és a 137 olyan alakokat tartalmaz, amelyek az elektronok áramlását ábrázolják. Pg. A 140 meta-irányt tárgyalja, amely “ellentétes” okokból történik, mint o/p-irány alkilcsoportok szerint.