Tanulási Célok
- Összehasonlítani, pont mutáció pedig az olvasási mutációk
- Leírni a különbséget a missense, ostobaság, a csendes mutációk
- Leírni a különbséget a fény, sötét javítás
- Magyarázza, hogy a különböző anyagok törvény
- Magyarázza, hogy miért az Ames-teszt lehet felismerni rákkeltő
- Elemezni, sorozatok, DNS tárnia típusú mutációk
A mutáció egy öröklődő változás a DNS-szekvencia egy organizmus., Az így létrejövő szervezetnek, amelyet mutánsnak neveznek, felismerhető változása lehet a fenotípusban a vad típushoz képest, amely a természetben leggyakrabban megfigyelt fenotípus. A DNS-szekvencia változása transzkripció útján kerül az mRNS-re, és a transzlációs fehérje módosított aminosav-szekvenciájához vezethet. Mivel a fehérjék a sejtfunkciók túlnyomó többségét végzik, a fehérje aminosav-szekvenciájának változása a sejt és a szervezet megváltozott fenotípusához vezethet.,
A mutációk hatása a DNS szekvenciára
többféle mutáció létezik, amelyeket a DNS-molekula megváltoztatásának módja szerint osztályoznak. Az egyik típus, amelyet pontmutációnak neveznek, egyetlen bázist érint, és leggyakrabban akkor fordul elő, amikor az egyik bázist helyettesítik vagy helyettesítik egy másikval. A mutációk egy vagy több bázis hozzáadásával, beillesztésként vagy egy vagy több bázis eltávolításával, törlésként ismertek.
gondolj bele
- milyen típusú mutáció fordul elő, ha egy génnek két kevesebb nukleotidja van a szekvenciájában?,
A mutációk Fehérjeszerkezetre és funkcióra gyakorolt hatása
a pontmutációk számos hatással lehetnek a fehérjefunkcióra (1.ábra). A genetikai kód degenerálódásának következtében egy pontmutáció általában azt eredményezi, hogy ugyanazt az aminosavat beépítik a kapott polipeptidbe a szekvencia változása ellenére. Ez a változás nem lenne hatással a fehérje szerkezetére, ezért csendes mutációnak nevezik. A missense mutáció azt eredményezi, hogy egy másik aminosav beépül a kapott polipeptidbe., A missense mutáció hatása attól függ, hogy kémiailag mennyire különbözik az új aminosav a vad típusú aminosavtól. A megváltozott aminosav helye a fehérjén belül is fontos. Például, ha a megváltozott aminosav része az enzim aktív helyének, akkor a missense mutáció hatása jelentős lehet. Sok missense mutáció olyan fehérjéket eredményez, amelyek még mindig funkcionálisak, legalábbis bizonyos mértékig. Néha a missense mutációk hatásai csak bizonyos környezeti körülmények között nyilvánvalóak lehetnek; az ilyen missense mutációkat feltételes mutációknak nevezik., Ritkán a missense mutáció hasznos lehet. A megfelelő környezeti feltételek mellett ez a fajta mutáció szelektív előnyt jelenthet a szervezetnek. Még egy másik típusú pontmutáció, az úgynevezett nonszensz mutáció, átalakítja a kodon kódoló aminosav (egyfajta kodon) egy stop kodon (nonszensz kodon). A nonszensz mutációk olyan fehérjék szintézisét eredményezik, amelyek rövidebbek, mint a vad típus, és jellemzően nem működnek.
a törlések és Beillesztések különböző hatásokat is okoznak., Mert kodon alapján hármasok, a nukleotidok, betoldások, vagy törlése a csoport három nukleotid vezethet beillesztése vagy törlése egy vagy több aminosav, illetve nem okozhat jelentős hatást a keletkező fehérje működését. Azonban a frameshift mutációk, amelyeket számos nukleotid beillesztése vagy törlése okoz, amelyek nem három többszöröse, rendkívül problematikusak, mivel az olvasási keret eredményeinek eltolódása (1.ábra). Mivel a riboszómák hármas kodonokban olvassák az mRNS-t, a frameshift mutációk minden aminosavat megváltoztathatnak a mutáció pontja után., Az új olvasási keret tartalmazhat egy stop kodont is a kódolási sorozat vége előtt. Következésképpen a frameshift mutációkat tartalmazó génekből készült fehérjék szinte mindig nem működnek.
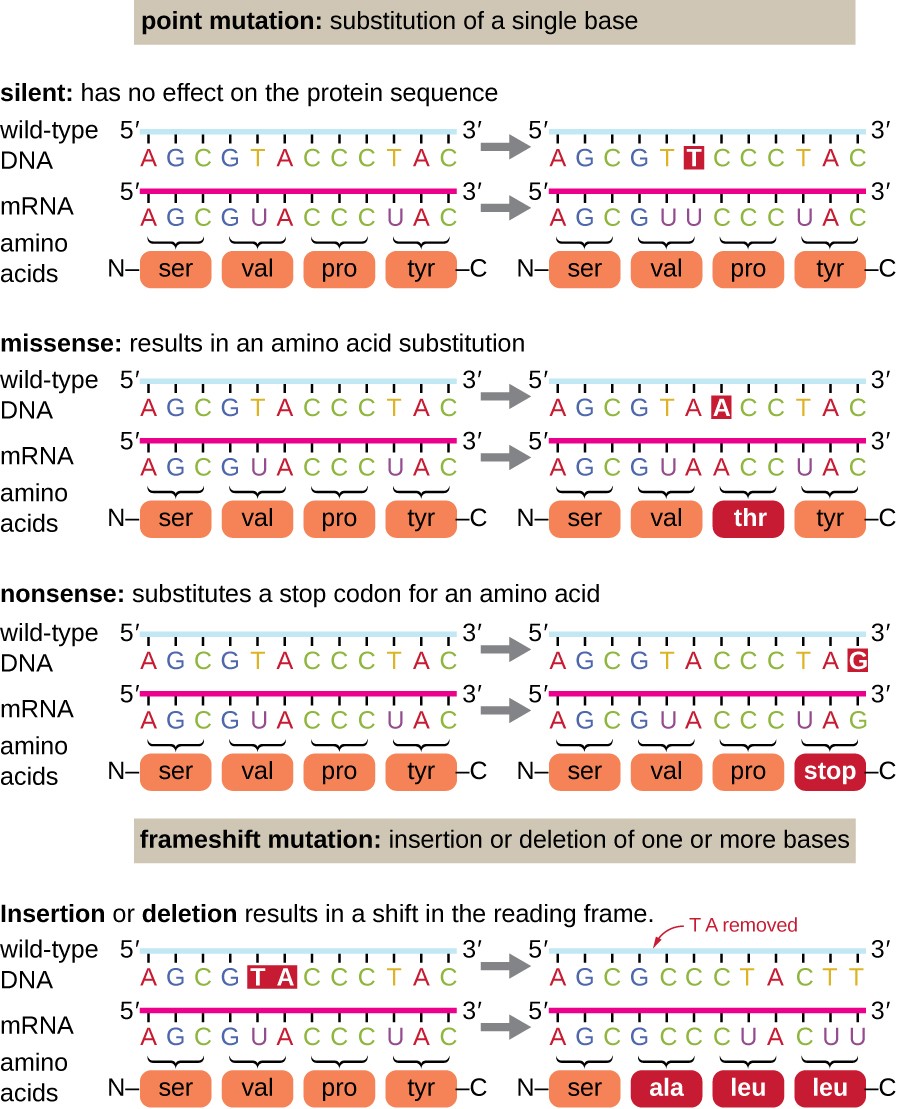
1.ábra. Kattintson a nagyobb képért. A mutációk a DNS által kódolt fehérjeszekvencia megváltozásához vezethetnek.
gondolj bele
- mi az oka annak, hogy egy fehérje génjének nukleotidváltozása nem befolyásolja az adott gén fenotípusát?,
- lehetséges-e három nukleotid együttes beillesztése az ötödik nukleotid után egy fehérjekódoló génbe, hogy a normálisnál rövidebb fehérjét termeljenek? Hogyan vagy hogyan nem?
hasznos mutáció
mivel 1981-ben a humán immunhiányos vírussal (HIV) való fertőzés első esetét jelentették, közel 40 millió ember halt meg HIV-fertőzésben, a szerzett immunhiányos szindrómát (AIDS) okozó vírusban., A vírus olyan helper T-sejteket céloz meg, amelyek kulcsszerepet játszanak a veleszületett és adaptív immunválasz áthidalásában, a szervezet fertőzésre adott válaszában általában részt vevő sejtek megfertőzésében és elpusztításában. Nincs gyógymód a HIV-fertőzésre, de sok gyógyszert fejlesztettek ki a vírus progressziójának lassítására vagy blokkolására. Bár az egyének szerte a világon fertőzöttek lehetnek, a 15-49 éves emberek körében a legmagasabb prevalencia a Szaharától délre eső Afrikában van, ahol 20-ból közel egy ember fertőzött, ami a fertőzések több mint 70% – át teszi ki világszerte (2.ábra)., Sajnos ez is része a világnak, ahol a leginkább hiányoznak a megelőzési stratégiák és a fertőzés kezelésére szolgáló gyógyszerek.

2.ábra. A HIV nagyon elterjedt a Szaharától délre eső Afrikában, de prevalenciája meglehetősen alacsony a világ más részein.
az elmúlt években a tudományos érdeklődést felkeltette néhány észak-európai ember felfedezése, akik ellenállnak a HIV-fertőzésnek. 1998-ban Stephen J. amerikai genetikus., O ‘ Brien a National Institutes of Health (NIH) és munkatársai több mint 4000 egyedből álló genetikai elemzésük eredményeit tették közzé. Ezek azt mutatták, hogy sok eurázsiai származású egyén (egyes etnikai csoportokban legfeljebb 14%) rendelkezik a CCR5-delta 32 nevű deléciós mutációval a CCR5 kódoló génben. A CCR5 a T-sejtek felszínén található coreceptor, amely a vírus számos törzséhez szükséges a gazdasejtbe való belépéshez. A mutáció olyan receptor termeléséhez vezet, amelyhez a HIV nem képes hatékonyan kötődni, így blokkolja a vírus bejutását., A mutációra homozigóta emberek nagymértékben csökkentették a HIV-fertőzésre való hajlamot, és a heterozigóta személyek is védelmet nyújtanak a fertőzéssel szemben.
nem világos, hogy az észak-európai származású emberek miért hordozzák ezt a mutációt, de prevalenciája Észak-Európában a legmagasabbnak tűnik, és a populációk folyamatosan csökkennek dél felé haladva. A kutatások azt mutatják, hogy a mutáció a HIV megjelenése óta jelen van, és az Európai populációkban a pestis vagy a himlő expozíciója miatt kiválasztható., Ez a mutáció megvédheti az egyéneket a pestis (a Yersinia pestis baktérium okozta) és a himlő (a variola vírus okozta) ellen, mivel ez a receptor is részt vehet ezekben a betegségekben. Ennek a mutációnak a kora vita tárgya, de becslések szerint 1875 és 225 évvel ezelőtt jelent meg, és valószínűleg Észak-Európából terjedt el a Viking inváziók révén.
Ez az izgalmas megállapítás új utakat eredményezett a HIV-kutatásban, beleértve olyan gyógyszerek keresését is, amelyek blokkolják a CCR5 kötődését a HIV-hez azoknál az egyéneknél, akiknek nincs mutációja., Bár lehetséges a DNS-vizsgálat annak meghatározására, hogy mely egyének hordozzák a CCR5-delta 32 mutációt, vannak dokumentált esetek, amikor az egyének homozigóta a HIV-fertőzés mutációjához. Ezért a mutáció DNS-vizsgálatát a közegészségügyi tisztviselők nem javasolják széles körben, hogy ne ösztönözzék a kockázatos viselkedést azoknál, akik a mutációt hordozzák. Mindazonáltal a HIV CCR5-hez való kötődésének gátlása továbbra is érvényes stratégia a HIV-fertőzöttek gyógyszeres terápiáinak fejlesztésére.,
A mutációk okai
a DNS-replikáció folyamatában bekövetkező hibák spontán mutációkat okozhatnak. A DNS-polimeráz hibaaránya egy hibás bázis / milliárd bázispár replikált. A mutagéneknek való kitettség indukált mutációkat okozhat, amelyek különböző típusú vegyi anyagok vagy sugárzás (1.táblázat). A mutagénnek való kitettség több mint 1000-szeresére növelheti a mutáció sebességét. A mutagének gyakran rákkeltő anyagok is, amelyek rákot okoznak. Míg azonban szinte minden rákkeltő anyag mutagén, nem minden mutagén feltétlenül rákkeltő.,
| 1.táblázat., to AT base pair | Point | ||||||
|---|---|---|---|---|---|---|---|
| Intercalating agents | |||||||
| Acridine orange, ethidium bromide, polycyclic aromatic hydrocarbons | Distorts double helix, creates unusual spacing between nucleotides | Introduces small deletions and insertions | Frameshift | ||||
| Ionizing radiation | |||||||
| X-rays, γ-rays | Forms hydroxyl radicals | Causes single- and double-strand DNA breaks | Repair mechanisms may introduce mutations | ||||
| X-rays, γ-rays | Modifies bases (e., | ||||||
| Nonionizáló sugárzás | |||||||
| ultraibolya | formák pirimidin (általában timin) dimerek | DNS replikációs hibákat okoz | Frameshift vagy point | ||||
chemical mutagens
a kémiai mutagének különböző típusai nukleozid analógokként vagy nukleotidbázisok módosításával közvetlenül kölcsönhatásba lépnek a DNS-vel., A nukleozid analógoknak nevezett vegyi anyagok szerkezetileg hasonlóak a normál nukleotid bázisokhoz, és a replikáció során beépíthetők a DNS-be (3.ábra). Ezek az alap analógok mutációkat indukálnak, mivel gyakran eltérő alap-párosítási szabályokkal rendelkeznek, mint az általuk helyettesített bázisok. Más kémiai mutagének módosíthatják a normál DNS-bázisokat, ami különböző bázis-párosítási szabályokat eredményez. Például a dinitrogénsav deaminálja a citozint, átalakítva uracillá. Uracil majd párba adenin egy későbbi körben a replikáció, ami az átalakítás egy GC bázispár egy AT bázispár., Dinitrogénsav is deaminálja adenin hipoxantin, amely bázis pár citozin helyett timin, ami az átalakítás egy ta bázispár egy CG bázispár.

3.ábra. Kattintson a nagyobb képért. a) A 2-aminopurin nukleozid (2AP) szerkezetileg az adenin nukleozid analógja, míg az 5-bromouracil (5BU) a timin nukleozid analógja. 2AP bázispár C-vel, egy AT bázispár konvertálása GC alappárra több replikációs forduló után., 5BU pár g-vel, egy AT bázispár konvertálása GC alappárra több replikációs forduló után. (b) A Dinitrogénsav egy másik típusú kémiai mutagén, amely módosítja a már meglévő nukleozid bázisok, mint a C előállításához U, amely bázis Párok A. Ez a kémiai módosítás, amint itt látható, eredményez konvertáló CG bázispár TA bázispár.
az interkaláló szerekként ismert kémiai mutagének eltérően működnek., Ezek a molekulák a DNS kettős spirál halmozott nitrogénbázisai közé csúsznak, torzítva a molekulát, és atipikus távolságot teremtve a nukleotid bázispárok között (4.ábra). Ennek eredményeként a DNS-replikáció során a DNS-polimeráz vagy kihagyhat több nukleotid replikációját (deléció létrehozása), vagy extra nukleotidokat helyezhet be (beillesztés létrehozása). Mindkét eredmény frameshift mutációhoz vezethet. Az égéstermékek, mint például a policiklusos aromás szénhidrogének, különösen veszélyes interkaláló szerek, amelyek mutációt okozó rákokhoz vezethetnek., Az interkaláló szerek etidium-bromid és akridin-narancs a laboratóriumban gyakran használják a DNS festésére vizualizáció céljából, és potenciális mutagének.

4.ábra. Intercalating anyagok, mint például a akridin be atipikus közötti távolság bázispár, amely a DNS-polimeráz bevezetéséről vagy törléséről vagy egy behelyezés, ami egy lehetséges olvasási mutáció.
sugárzás
Az ionizáló vagy nonionizáló sugárzásnak való kitettség mindegyik mutációt okozhat a DNS-ben, bár különböző mechanizmusok révén., Erős ionizáló sugárzás, mint a röntgen, gamma-sugarak okozhat az egyszeri, dupla szálú megszakad a DNS gerincét kialakulhatna hidroxil gyökök sugárzást (5.Ábra). Az ionizáló sugárzás bázisokat is módosíthat; például a citozin uracil-hoz történő deaminálása, hasonlóan a dinitrogénsav hatásához. Az ionizáló sugárterhelést mikrobák elpusztítására használják az orvostechnikai eszközök és élelmiszerek sterilizálására, mivel drámai, nem specifikus hatása van a DNS, a fehérjék és más sejtkomponensek károsodására (lásd fizikai módszerek használata a mikroorganizmusok szabályozására).,
a Nemionizáló sugárzás, mint az ultraibolya fény, nem elég energikus ahhoz, hogy ilyen típusú kémiai változásokat kezdeményezzen. A nemionizáló sugárzás azonban dimerképződést válthat ki két szomszédos pirimidin bázis, általában két timin között egy nukleotidszálon belül. A timin dimerképződés során a két szomszédos timin kovalensen összekapcsolódik, és ha nem javul, mind a DNS replikáció, mind a transzkripció ezen a ponton elakad. A DNS-polimeráz előfordulhat, és helytelenül replikálja a dimert, ami frameshift-hez vagy pontmutációkhoz vezethet.,

5.ábra. a) az ionizáló sugárzás egyszálú és kettős szálú törések kialakulásához vezethet a DNS cukor-foszfát gerincében, valamint a bázisok módosításához (nem látható). b) A Nemionizáló sugárzás, mint például az ultraibolya fény, timin dimerek képződéséhez vezethet, amelyek replikációt és transzkripciót okozhatnak, valamint frameshift vagy pontmutációkat vezethetnek be.
gondolj bele
- hogyan vezet be egy bázis analóg mutációt?,
- hogyan vezet be egy interkaláló szer mutációt?
- milyen típusú mutagén okozza a timin dimereket?
DNS Repair
a DNS replikáció folyamata nagyon pontos, de a hibák spontán előfordulhatnak, vagy mutagének indukálhatók. A korrigálatlan hibák súlyos következményekkel járhatnak a fenotípusra. A sejtek számos javítási mechanizmust fejlesztettek ki a továbbra is fennálló mutációk számának minimalizálása érdekében.,
lektorálás
a DNS-replikáció során bevezetett hibák nagy részét a legtöbb DNS-polimeráz azonnal korrigálja egy lektorálásnak nevezett függvényen keresztül. A lektorálás során a DNS-polimeráz beolvassa az újonnan hozzáadott alapot, biztosítva, hogy a következő hozzáadása előtt kiegészítse a sablonszál megfelelő alapját. Ha helytelen bázist adunk hozzá, az enzim egy vágást végez a rossz nukleotid felszabadítására, majd egy új bázist adunk hozzá.,
Mismatch Repair
a replikáció során bevezetett hibákat röviddel a replikációs gép áthelyezése után korrigálják. Ezt a mechanizmust nem megfelelő javításnak nevezik. A mechanizmusban részt vevő enzimek felismerik a helytelenül hozzáadott nukleotidot, kivágják, majd a megfelelő bázissal helyettesítik. Az egyik példa a metil-irányított eltérés javítása az E. coli-ban. A DNS hemimetilált. Ez azt jelenti,hogy a szülői szál metilálódik, míg az újonnan szintetizált lányszál nem. Néhány percet vesz igénybe az Új szál metilezése előtt., A MutS, MutL és MutH fehérjék kötődnek a hemimetilált helyhez, ahol a nem megfelelő nukleotid található. A MutH levágja a nemmetilált szálat (az új szálat). Az exonukleáz eltávolítja a szál egy részét (beleértve a helytelen nukleotidot is). A keletkezett rést ezután DNS-pol III és ligáz tölti ki.
timin dimerek javítása
mivel a timin dimerek előállítása gyakori (sok szervezet nem tudja elkerülni az ultraibolya fényt), mechanizmusok alakultak ki ezen elváltozások javítására., A nukleotidkiválasztás javításánál (más néven sötét javításnál) az enzimek eltávolítják a pirimidin dimert, és a megfelelő nukleotidokkal helyettesítik (6.ábra). Az E. coli-ban a DNS-t egy enzimkomplex szkenneli. Ha egy torzulást a kettős spirál található ez vezette a pirimidin dimer, az enzim komplex csökkenti a cukor-foszfát gerincét több bázisok felfelé, mind lefelé a dimer, illetve a szegmensben a DNS-e között a két vágás van, akkor enzimesen távolítani. A DNS pol I helyettesíti a hiányzó nukleotidokat a megfelelőekkel, a DNS-ligáz pedig lezárja a cukor-foszfát gerincének rését.,
a timin dimerek közvetlen javítása (más néven fényjavítás) a fotoreaktiválás folyamatában történik látható fény jelenlétében. Egy fotoláz nevű enzim felismeri a timin dimer által okozott DNS-hélix torzulását, és kötődik a dimerhez. Ezután látható fény jelenlétében a fotoláz enzim megváltoztatja a konformációt és szétszakítja a timin dimert, lehetővé téve a Timinek számára, hogy ismét helyesen alapozzák meg a párokat a kiegészítő szál adeninjeivel., Úgy tűnik, hogy a fotoreaktiváció minden szervezetben jelen van, kivéve a placenta emlősöket, beleértve az embereket is. A fotoreaktiválás különösen fontos az ultraibolya sugárzásnak krónikusan kitett szervezetek, például növények, fotoszintetikus baktériumok, algák és korallok számára, hogy megakadályozzák a timin dimerképződés által okozott mutációk felhalmozódását.

6.ábra. Kattintson a nagyobb képért. A baktériumoknak két mechanizmusa van a timin dimerek javítására., a) A nukleotidkiválasztás során egy enzimkomplexum felismeri a timin dimer körüli DNS-komplex torzulását, és levágja és eltávolítja a sérült DNS-szálat. A megfelelő nukleotidokat DNS pol I váltja fel, a nukleotidszálat pedig DNS-ligáz zárja le. b) a fotoreaktiválás során a fotoláz enzim kötődik a timin dimerhez, és látható fény jelenlétében szétszakítja a dimert, helyreállítva a Timinek bázispárosítását kiegészítő adeninekkel az ellenkező DNS-szálon.,
gondolj bele
- az eltérés javítása során hogyan ismeri fel az enzim, hogy melyik az új és melyik a régi szál?
- hogyan vezet be egy interkaláló szer mutációt?
- milyen típusú mutációt javít a fotoláz?
bakteriális mutánsok azonosítása
a bakteriális mutánsok azonosítására használt egyik gyakori technikát replika bevonatnak nevezik., Ezt a technikát a táplálkozási mutánsok, az úgynevezett auxotrofok kimutatására használják, amelyek mutációt mutatnak egy enzimet kódoló génben egy adott tápanyag bioszintézisében, például egy aminosavban. Ennek eredményeként, míg a vad típusú sejtek megtartják a képességüket, hogy normálisan növekedjenek egy olyan táptalajon, amelyben nincs specifikus tápanyag, az auxotrófok nem képesek ilyen táptalajon növekedni. Közben replika borítás (7. Ábra), a lakosság, a bakteriális sejtek mutagenized aztán bevonatú, mint az egyedi sejtek egy komplex, teljes tápértékű tányérra tenni, hogy növekszik a gyarmatokon., Ezekből a kolóniákból származó sejteket eltávolítják ebből a mesterlemezből, gyakran steril bársony segítségével. Ezt a bársonyot, amely cellákat tartalmaz, ugyanabban a tájolásban nyomják a különböző médiumok lemezeire. Legalább egy lemeznek táplálkozási szempontból teljesnek kell lennie annak biztosítása érdekében, hogy a sejtek megfelelően átkerüljenek a lemezek között. A többi lemezen nincsenek specifikus tápanyagok, így a kutató különféle auxotróf mutánsokat fedezhet fel, amelyek nem képesek specifikus tápanyagokat előállítani. A táplálkozási szempontból teljes lemez megfelelő kolóniájából származó sejtek felhasználhatók a mutáns további vizsgálat céljából történő helyreállítására.,

7.ábra. Az auxotróf mutánsok azonosítása, mint például a hisztidin auxotrofok, replika bevonattal történik. A mutagenezist követően hisztidin-auxotrofként azonosítják azokat a kolóniákat, amelyek táplálkozási szempontból teljes táptalajon nőnek, de nem hisztidinhiányos közegben.
gondolj rá
- miért vannak a sejtek táplálkozási szempontból teljes lemezen a tápanyaghiányos lemezek mellett, amikor mutánst keresnek?,
az Ames teszt
az Ames teszt, amelyet Bruce Ames (1928–) fejlesztett ki az 1970-es években, olyan módszer, amely baktériumokat használ az új kémiai vegyületek rákkeltő potenciáljának gyors, olcsó szűrésére. A vizsgálat a vegyület expozíciójával kapcsolatos mutációs arányt méri, amely, ha megemelkedik, azt jelezheti, hogy ennek a vegyületnek az expozíciója nagyobb rákkockázattal jár., Az Ames-teszt teszt a Salmonella typhimurium törzsét használja, amely hisztidin auxotroph, amely nem képes saját hisztidint szintetizálni a szintéziséhez szükséges lényeges gén mutációja miatt. A potenciális mutagénnek való kitettség után ezeket a baktériumokat egy hisztidinnel nem rendelkező közegbe vonják, és a hisztidin szintetizálására képes mutánsok számát rögzítik, és összehasonlítják a potenciális mutagén hiányában felmerülő ilyen mutánsok számával (8.ábra)., Azok a vegyi anyagok, amelyek mutagénebbek, több mutánsot eredményeznek a visszaállított hisztidin szintézissel az Ames-tesztben. Mivel sok vegyi anyag nem közvetlenül mutagén, hanem metabolizálódik mutagén formák májenzimek, patkány máj kivonat gyakran szerepel a kísérlet kezdetén, hogy utánozza a máj metabolizmusát. Az Ames-vizsgálat elvégzése után a mutagénként azonosított vegyületeket további modellekkel, köztük állatmodellekkel, például egerekkel és patkányokkal vizsgálják potenciális rákkeltő tulajdonságaik tekintetében.
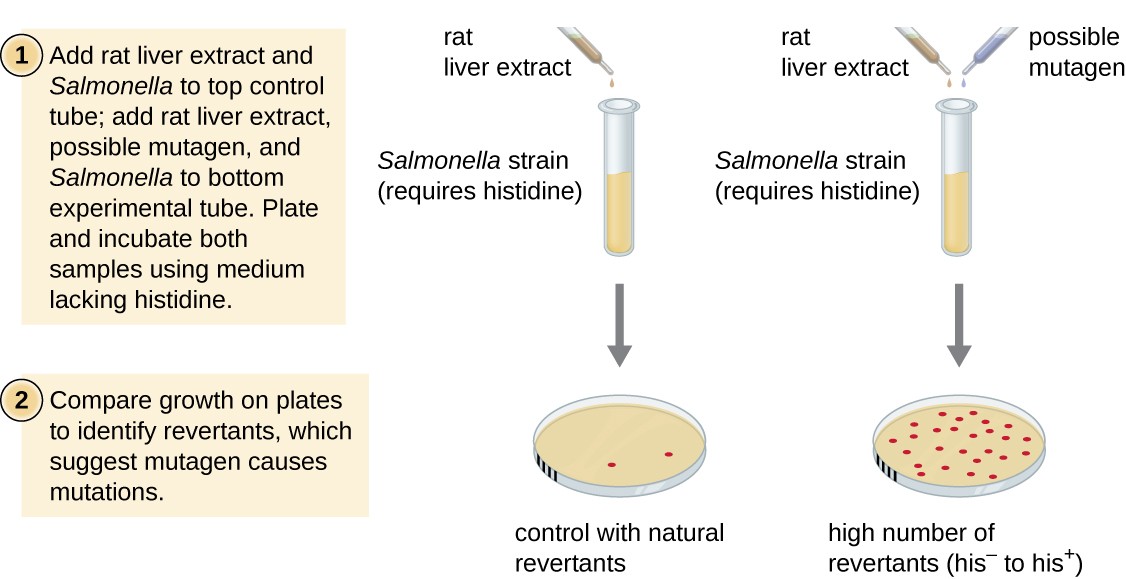
8.ábra., Az Ames-tesztet a mutagén, potenciálisan karcinogén vegyi anyagok azonosítására használják. A Salmonella hisztidin auxotroph-t használják vizsgálati törzsként, potenciális mutagén/karcinogénnek kitéve. A rendelkezésre álló hisztidin hiányában növekedésre képes reverziós mutánsok számát a potenciális mutagén hiányában felmerülő természetes reverziós mutánsok számához hasonlítjuk.
gondolj bele
- milyen mutációt alkalmaznak az Ames-teszt mutációs arányának mutatójaként?
- miért működhet az Ames-teszt karcinogenitási tesztként?,
kulcsfogalmak és összefoglaló
- a mutáció a DNS öröklődő változása. A mutáció a fehérje aminosav-szekvenciájának megváltozásához vezethet, ami befolyásolhatja annak működését.
- egy pontmutáció egyetlen bázispárt érint. Egy pontmutáció csendes mutációt okozhat, ha az mRNS kodon ugyanazt az aminosavat kódolja, missense mutáció, ha az mRNS kodon más aminosavat kódol, vagy értelmetlen mutáció, ha az mRNS kodon stop kodonná válik.,
- a Missense mutációk az új aminosav kémiájától és a proteinben való elhelyezkedésétől függően megtarthatják működésüket. A nonszensz mutációk csonka és gyakran nem működő fehérjéket termelnek.
- a frameshift mutáció számos olyan nukleotid beillesztéséből vagy törléséből származik, amely nem három többszöröse. Az olvasási keret változása a mutáció után minden aminosavat megváltoztat, és egy nem működő fehérjét eredményez.
- a spontán mutációk DNS-replikációs hibákon keresztül fordulnak elő, míg az indukált mutációk mutagénnek való kitettség révén fordulnak elő.,
- a mutagén szerek gyakran rákkeltőek, de nem mindig. Azonban szinte minden rákkeltő anyag mutagén.
- a kémiai mutagének közé tartoznak a bázis analógok és a meglévő bázisokat módosító vegyi anyagok. Mindkét esetben a mutációkat több DNS-replikáció után vezetik be.
- az ionizáló sugárzás, mint például a röntgensugarak és a γ-sugarak, a DNS foszfodiészter gerincének töréséhez vezet, és kémiailag is módosíthatja a bázis-párosítási szabályokat.,
- az ultraibolya fényhez hasonló Nonionizáló sugárzás pirimidin (timin) dimereket vezethet be, amelyek a DNS replikáció és transzkripció során frameshift vagy pontmutációkat vezethetnek be.
- a sejteknek mechanizmusaik vannak a természetben előforduló mutációk javítására. A DNS-polimeráz lektorálási aktivitással rendelkezik. Az eltérés javítása a helytelenül beépített bázisok javításának folyamata a DNS-replikáció befejezése után.
- a pirimidin dimerek is javíthatók., A nukleotidkiválasztás javításánál (dark repair) az enzimek felismerik a pirimidin dimer által bevezetett torzulást, és a sérült szálat a megfelelő bázisokkal helyettesítik, a sértetlen DNS-szálat mint sablont használva. A baktériumok és más szervezetek is használhatnak közvetlen javítást, amelyben a fotoláz enzim látható fény jelenlétében széttöri a pirimidineket.
- a teljes lemez növekedésének összehasonlítása és a specifikus tápanyagokat nem tartalmazó táptalajon a növekedés hiánya révén azonosíthatók az auxotrofoknak nevezett specifikus funkcióveszteség-mutánsok.,
- az Ames-teszt egy olcsó módszer, amely auxotróf baktériumokat használ egy kémiai vegyület mutagenitásának mérésére. A mutagenitás A karcinogén potenciál mutatója.
feleletválasztós
az alábbiak közül melyik a sorrend változása, amely stop kodon kialakulásához vezet?
- missense mutáció
- nonszensz mutáció
- deléciós mutáció
csendes mutáció
válasz
a pirimidin dimerek kialakulása az alábbiak közül melyikből származik?
- spontán hibák által DNS-polimeráz
- expozíció a gamma-sugárzás
- ultraibolya sugárzás
- expozíció intercalating ügynökök
az alábbiak közül melyik példa a frameshift mutációra?
- egy kodon törlése
- missense mutáció
- csendes mutáció
- egy nukleotid törlése
válasz
az alábbiak közül melyik a DNS-javítás típusa, amelyben a timin dimereket közvetlenül lebontják a fotoláz enzim?,
- közvetlen javítás
- nukleotid kimetszés, javítás
- mismatch repair
- lektorálás
az alábbiak közül melyik igaz az Ames tesztre?
- az újonnan képződött auxotróf mutánsok azonosítására szolgál.
- a helyreállított bioszintetikus aktivitással rendelkező mutánsok azonosítására szolgál.
- a spontán mutánsok azonosítására szolgál.,
- a fotoreaktivációs aktivitással nem rendelkező mutánsok azonosítására szolgál.
töltse ki az üres
egy kémiai mutagént, amely szerkezetileg hasonló a nukleotidhoz, de eltérő bázispárosítási szabályokkal rendelkezik,_______.,
a timin dimerek felosztásához használt könnyű javításhoz használt enzimet ________ _ – nek nevezzük.
a természetben leggyakrabban megfigyelt szervezet fenotípusát ________ – nek nevezik.,
True/False
a rákkeltő anyagok jellemzően mutagének.
Gondolni
Miért valószínűbb, hogy betoldások a törlések lesz több káros, hogy egy sejt, mint pontmutációk?,
miért gondolja, hogy az Ames-teszt előnyösebb, mint az állati modellek használata a kémiai vegyületek mutagenitás céljából történő szűrésére?
kritikus gondolkodás
Az alábbiakban több olyan DNS-szekvencia található, amelyek mutálódnak a vad típusú szekvenciához képest: 3′-T A C T G A C T G A C G A T C-5′. Képzeljük el, hogy mindegyik egy olyan DNS-molekula egy része, amely elválasztott a transzkripció előkészítése során, tehát csak a sablon szálat látja., Építeni a komplementer DNS-szekvenciák (jelezve, 5′, 3′ vége) minden mutálódott DNS-szekvencia, majd átvezeti (jelezve, 5′, 3′ vége) a sablon szál, valamint a fordítás a mrns molekulák segítségével a genetikai kód, a felvétel a kapott aminosav-szekvencia (jelezve a N C termini). Milyen típusú mutáció mindegyik?,>
Komplementer DNS-szekvencia:
mrns sorrend átírt a sablon:
Aminosav-szekvenciát, a peptid:
a mutáció Típusa:
Komplementer DNS-szekvencia:
mrns sorrend átírt a sablon:
Aminosav-szekvenciát, a peptid:
a mutáció Típusa: