Bevezetés
Szőrös sejtes leukémia (HCL) egy B-sejtes limfoid neoplázia. A HCL morfológiai, immunofenotípusos és molekuláris jellemzői miatt különbözik a többi B-sejtes daganattól. Fő jellemzője a monoklonális B-sejtek felhalmozódása, amelynek felszínén hajszerű nyúlványok találhatók, elsősorban a perifériás vérben, a csontvelőben és a lépben. 1958-ban írta le Bournoncle et al. Azonban leukémiás retikuloendotheliosisnak nevezték.,1 A” szőrös sejtek ” kifejezést 1996-ban Schrek et al.2 ma az Egészségügyi Világszervezet B-sejtes nem-Hodgkin limfómaként osztályozza.3
meghatározás
a HCL ritka, krónikus, lymphoproliferatív B-sejtes rendellenesség. Fő jellemzői a citoplazmatikus megnyúlások, amelyek szőrös szempontot adnak a sejteknek.
etiológia
bár vannak különböző vizsgálatok, amelyek összefüggést mutatnak bizonyos hatóanyagoknak és HCL-nek való kitettség között, etiológiáját nem állapították meg egyértelműen, ami az alacsony előfordulási gyakorisága miatt magyarázható., A pozitív kapcsolatnak bizonyuló szerek között szerepel a növényvédőszerek,4 herbicid, ásványi olaj, ácsként vagy mezőgazdasági termelőként végzett munka.4-7 a közelmúltban pozitív kapcsolatot írtak le a mérettel, 5 míg a dohányzásnak fordított kapcsolata van, különösen a férfiaknál.8 a védettséget biztosító specifikus mechanizmus nem ismert; mindazonáltal a dohányzás a gyulladásos mechanizmusok súlyosságának csökkentését javasolta9, és hogy a nikotin apoptózist indukál a limfocitákban.10
Epidemiológia
a HCL az összes leukémia 2-3% – át képviseli. Évente 600 új esetet jelentettek az Egyesült Államokban (3.,2 eset millió lakosonként). A medián életkor a diagnózisnál 52 éves, és gyakoribb a férfiaknál, mint a nőknél, 4:1 arányban; magasabb előfordulási gyakorisággal a fehér populációban, különösen az Askenazi zsidók körében.3 Mexikóban a HCL az összes leukémia 1, 12% – át képviseli. Az ország északi részén azonban akár 1, 83% – ot is képvisel,hasonlóan az Egyesült Államok 11, 12
Fiziopathology
HCL információihoz, krónikus, lymphoproliferatív B – sejtes rendellenesség. Sejtjeinek azonban nincs B-sejtes alpopulációja, eredete vitatott., Az immunglobulinok (Ig) változó régiók génjeinek elemzése olyan eszköz, amelyet a limfoid sejtek klonális eredetének felfedezésére használnak.13 az esetek több mint 85% – ában szomatikus mutációkat találunk a HCL-sejtek Ig változó régióiban,14,15, ami azt jelzi, hogy az érintett sejtek áthaladtak a csíraközponton vagy a limfoid perifériás szerveken.16 a HCL-sejtek körülbelül 40% – a együtt expresszál több, klonálisan rokon Ig-izotípust.17
bizonyíték arra utal, hogy a genomikus expressziós profiljuk miatt a B-sejtek memóriájában a csírát követő központ származik.,18,19 a memória B-sejtek eredete kompatibilis a HCL kromoszómás kölcsönös transzlokáció hiányával.20 a CD27 hiánya jellemző a HCL-ben. Ez egy pontot jelent a B-sejtek memóriájában való eredetének hipotézisével szemben.21 ugyanakkor negatív CD27 memória B-sejteket figyeltek meg.22 mivel a nyirokcsomó-szeretet ritka, azt javasolták, hogy a HCL eredetű sejt valószínűleg a csontvelőben vagy a lépben található, mivel ezek általában a leginkább érintett helyek. A HCL sejtek a lép marginális zónájához hasonló expressziós profilt mutatnak.,23
a HCL jellegzetes megjelenése a béta-aktin expressziónak köszönhető, amely a kortikális citoszkeletonban található F-aktinra polimerizálódik.A leukocitákra jellemző 24 PP52 foszfoprotein kapcsolódik az F-aktinhoz, és felelős a hajszerű vetületek támogatásáért.Másrészt a HCL génszekvenálása a közelmúltban azonosította a BRAF V600E mutáció jelenlétét szinte minden betegségben szenvedő betegben, más B-sejtes lymphoid malignus betegségekben hiányzik.26,27 BRAF-mutáció aktiválja a MAPK-utat, elősegítve a növekedést, a túlélést és a HCL-sejtek differenciálódását.,28
klinikai bemutatás és laboratóriumi eredmények
a betegség klinikai lefolyása független. A legtöbb beteg általában gyengeséget és fáradtságot mutat, mint a betegség kezdetén uralkodó tüneteket.29 néha ismétlődő fertőzések fordulnak elő. A fisical vizsgálati eredmények a következők: splenomegalia 96% – ban, hepatomegalia 58% – ban, lymphadenopathia csak 35% – ban. Ezek a duzzadt nyirokcsomók ritkán fordulnak elő a periférián; mindazonáltal általában jelen vannak a hasban, és képalkotó vizsgálatokkal kimutathatók.,30
a betegség előrehaladott stádiumában fájdalmat találunk a bal felső kvadránsban, fertőzésekben, lázban, vérzésben és/vagy fogyásban. Ez azonban nem gyakori a kezelés elérhetősége és hatékonysága miatt.30,31 a klinikai tünetek a lépben, a májban és a csontvelőben lévő szőrös sejtek felhalmozódásának következményei (1.táblázat).32
klinikai tünetek.,
| Lépben | Máj | csontvelő | Nyirokcsomók |
|---|---|---|---|
| A sejtek felhalmozódnak a vörös pép, valamint atrophia a fehér cellulóz. Később az úgynevezett “pszeudo-sinusoidokat” alkotják a vörös pép endothel sejtjeinek fokozott vaszkuláris csatornákkal történő helyettesítésével, hozzájárulva a vérszegénységhez. | itt felhalmozódnak a máj sinusoidjaiban, valamint a portális traktusban., Az utóbbiban fibrózis van a bőséges hialuronsav miatt, amely stimulálja a szőrös sejteket fibronektin termelésére, a megfelelő fibrózissal. | ezen a területen kiterjedt fibrózis és hematopoiesis szuppresszió alakul ki. A legfontosabb tényező a szőrös sejtek kölcsönhatása az extracelluláris mátrix hialuronsavjával, fibroblasztikus növekedési faktorokat (FGF) generálva, valamint a rosszindulatú sejtek stimulálása fibronektin előállítására és szekréciójára. | általában a betegség hiánya. A szőrös sejtek bejutására szolgáló receptorok hiánya., |
Respect to lab studies, it is frequent to observe anemia in 85%, thrombocytopenia in 60.80% and leukopenia in 60% due to hypersplenism and bone marrow infiltration.30
Differential diagnosis
HCL must be differentiated from other indolent lymphoid malignancies such as prolymphocytic leukemia, splenic marginal zone lymphoma, mantle cell lymphoma and HCL variant (HCL-v)., Az utóbbi az esetek 10% – ában fordul elő 70 éves medián életkorral, és a klasszikus szőrös sejtes leukémiával való hasonlóság ellenére a CD25 és CD123 immunofenotípusos markerek hiányában eltérnek egymástól. A differenciáldiagnózis másik módja a standard HCL kezelésre adott válasz hiánya, valamint a BRAF v600f gén mutációinak nem létezése.30
diagnosztikai módszerek
a HCL diagnózis általában biopsziával és csontvelő-aspirációval történik, immunofenotípusos jellemzéssel kombinálva áramlási citometrián keresztül.,33 fontos rámutatni, hogy ez a patológia általában aldiagnosztizált, és klinikai gyanút igényel, valamint a megfelelő technológia alkalmazása a probléma megoldására. Mint korábban említettük, a legtöbb beteg (70-90%) pancytopeniát mutat, leukopeniával (
×109/L), vérszegénységgel (g/dL), neutropeniával (×109/L), monocytopeniával (×109/L) és thrombocytopeniával (×109/L). Csak 10% és 20% között van mérsékelt leukocitózis (>10×109/L). A HCL-ben szenvedő betegek emelkedett IL-2R (CD25) szérumszintet mutatnak, ami korrelál a betegség aktivitási fokával.,34 egyéb vizsgálat, amelyet a diagnózis felállításakor figyelembe kell venni, a szérum immunglobulin szint, valamint az IgVH gén és a BRAF V600E szomatikus mutációk.32 néhány HCL kórszövettani és immunofenotípusos jellemző a következő:
- •
lymphocyta flow cytometria perifériás vérben vagy csontvelőben CD19, CD20, FMC7, CD11c, CD103, CD25, HC2, CD22, sIg, CD79a és CD123 kifejezésekkel, négy fő és specifikus markerrel: CD11c, CD103, CD25 és CD123.34 a negatív markerek általában CD5, cd23, CD10, cd79b és cd27.,32
- •
A CD200 erős kifejeződése jellemző a HCL-re, és hasznos lehet a nehéz esetek diagnosztizálásában.34
- •
a tűvel történő csontvelő-aspiráció nehéz lehet, és gyakran nem produktív vagy “száraz”. A csontvelő biopsziában megfigyelhetjük a fibrózist, sejtes “sült tojás” megjelenéssel, amelyet a magok és a bőséges citoplazma közötti széles terek okoznak. A CD20 és a TRAP (tartarát-rezisztens savas foszfatáz), a DBA-4 és az annexin A1 immunhisztokémiai analízisei jellemzően pozitívak.,32
Andrulis et al. irányított egy tanulmányt, ahol a hatékonyság a VE1 antitest BRAF V600E kimutatására számoltak be, valamint HCL azonosítás más szervezetek. Sőt, egy tanulmány által végzett Uppal et al. 88% – os érzékenységet és 97% – os specificitást talált a mutáció kimutatására az említett ellenanyaggal.34
a jelenlegi kezelés
a HCL rendszeresen indolens fejlődést mutat. A várakozás és a megfigyelés jó lehetőség a tünetmentes betegek számára, mivel a korai kezelés nem nyújt semmilyen előnyt az ilyen esetek túlélési arányában., Mindenesetre a betegség progressziója a legtöbb betegben komplikációkhoz vezet a cytopeniák és a splenomegalia következtében; azaz vérszegénység, vérzések, visszatérő fertőzések stb. Az általános gyakorlatban a kezelést meg kell kezdeni, ha a 2.táblázatban felsorolt kritériumok bármelyike előfordul.35 a kezelés megkezdésének elmulasztásáról szóló döntés meghozatalakor az első év során háromhavonta, majd azt követően hathavonta klinikai és laboratóriumi ellenőrzést kell végezni.,A 35 HCL-kezelés nem tekinthető gyógyításnak, de a jelenlegi kezelési stratégiák képesek hosszú távú remissziók elérésére, ezáltal növelve a globális túlélési arányokat (1.algoritmus).36-39
a kezelés megkezdésének kritériumai.
1. Tüneti splenomegalia
2. Cytopenia, amely magában foglalja a következők legalább egyikét:
-Hemoglobin g / dL
-vérlemezkék ×109 / L
-neutrofilek ×109 / l
3., Súlyos fertőzések
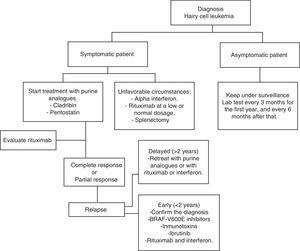
diagram a szőrös sejtes leukémiában szenvedő beteg kezelésére.
purin analógok
1960-ban a súlyos kombinált immunhiányos szindrómában szenvedő gyermekek 30% – ánál hiányzott a deamináz adenozin enzim (ADA).,40 továbbá felfedezték, hogy a deoxiadenozin-trifoszfát forma felhalmozódása felelős a limfociták csökkenéséért.41 E megfigyelések szem előtt tartásával olyan gyógyszereket fejlesztettek ki, amelyek képesek visszafordíthatatlanul kötődni az ADA-hoz vagy antagonizálni a hatását. A purin analógokkal végzett kezelés után a dezoxiadenozin-trifoszfát felhalmozódása a DNS-javítás szakadását és gátlását eredményezi, ami sejtes apoptózissá alakul.,42
Pentosztatin
más néven 2′-deoxycoformycin (DCF), Streptomyces antibioticus és ADA inhibitorok egyik terméke, amelyet először 1980-ban vezettek be a HCL-kezelés első purin analógjaként. A 3,37,39,43,44. táblázatban a specifikus vizsgálatok a pentosztatinra adott válaszarányt mutatják. A pentosztatin intravénás alkalmazása 4 mg/m2 arányban, kéthetente egyszer, amíg a teljes választ el nem érik az Egyesült Államokban.a Pentosztatin biztonságos azoknál a betegeknél, akiknél a kreatinin világítása >60ml/perc. Azonban dóziscsökkentésre van szükség, ha ez a tisztulás 40-60 ml/perc között van.,32 a beteg hidratálása 1,5 L intravénás oldattal ajánlott minden pentosztatin ciklusban.30
a globális válasz 88% és 96% között változik, míg a teljes válasz 44% és 81% között. Flinn et al. becsült túlélési aránya 5, illetve 10 év 90%, illetve 81%, Az átlagos követési időtartam 9, 3 év.45 a Pentosztatin általában jól tolerálható, és a leggyakoribb mellékhatások a vérszegénység, thrombocytopenia és neutropenia.,46 ennek ellenére a pentosztatin szignifikánsan csökkentette a CD4+ és a CD8+ limfocitaszámokat, ami növelheti a másodlagos malignitásokat és a fertőzések előfordulását.47,48
kladribin
2-klorodeoxiadenozin (CdA) néven ismert. A 4,49–52.táblázatban a vizsgálatok hatékonyságát jelzik. A leggyakrabban használt rendszer 0,1 mg/kg/nap folyamatos infúzióban történő beadását jelenti 7 napig. Egy nem randomizált vizsgálatban bizonyítékot találtak arra vonatkozóan, hogy az infúziók közötti válasz-és toxicitási tartományokban (24h és 2H) nem volt statisztikailag szignifikáns különbség.,53 egy Másik randomizált vizsgálatban a napi kontra heti kladribin adminisztráció; nem voltak jelentős megállapítások a válasz, a túlélés, a globális, illetve toxicitás árak.54 egy másik vizsgálat kimutatta, hogy a heti program csökkentette a fertőzések kockázatát.55 a szubkután adagolás egyik előnye az, hogy a legtöbb esetben nem igényel kórházi kezelést. 0, 14 mg/nap 5 napig 95% – os válaszarány, 56 hasonló az intravénás alkalmazáshoz. A subcutan heti programokban hasonló a terápiás válasz és a toxicitási arány, mint a naponta.,57 egyetlen kladribin ciklussal akár 100% – os globális válasz is elérhető, a teljes válaszarány pedig 77% – ról 95% – ra változik.49-52 Jehn et al. 12 éves, 79% – os globális túlélésről számoltak be.36 általában a kladribin jól tolerálható, a cytopeniák és a láz a leggyakoribb káros hatások.
vizsgálatok a kladribin hatékonyságáról HCL esetekben.,
| Study | Patients | Follow-up | Plan | % CR | % PR | % GR | Outcome |
|---|---|---|---|---|---|---|---|
| Robak (1999) | 97 | 36 months | 2h infusion IV 0.12mg/kg/d 5 days |
77.3 | 18.,6 | 95.9 | Progression-free survival: 37.4 months |
| Rosenberg (2014) | 83 | NA | Continuous infusion IV 0.1mg/kg/d 7 days |
88 | 12 | 100 | Average global survival: 231 months |
| Goodman (2003) | 207 | 7 years | Continuous infusion IV 0.1mg/kg/d 7 days |
95 | 5 | 100 | Global survival at 108 months: 97% |
| Chadha (2005) | 86 | 9.7 years | Continuous infusion IV 0.,1mg/kg/d 7 days |
79 | 21 | 100 | Global survival at 12 years: 87% |
RC: complete response, RP: partial response, RG: global response.
Until now, there are no randomized prospective studies comparing pentostatin versus cladribine, in part because of the great efficiency of both drugs and due to low HCL incidence., Ennek ellenére vannak retrospektív tanulmányok, amelyek bizonyítják, hogy mindkét gyógyszer hasonló hatékonysággal rendelkezik a teljes válasz és a betegségtől mentes túlélés szempontjából.
egyéb kezelések
a purin analógok továbbra is a kezelés első vonala, de a HCL patofiziológiával kapcsolatos új felfedezések különböző terápiás célokkal rendelkező gyógyszerek létrehozásához vezettek. Ezek a gyógyszerek kutatás alatt állnak, egyesek ígéretes eredményeket mutattak.
Rituximab
mivel a HCL egy B-sejtes malignitás, logikus egy monoklonális antitest alkalmazása CD20 ellen, mint például a rituximab., Foglalkoztatott, mint egy önálló gyógyszer, rituximab elérheti a teljes válasz az árak a 10-54% a betegek egy HCL visszaesés, a 375mg/m2 adagolás hetente egyszer 4-8 hét.58,59 Else et al. retrospektíven felülvizsgáltak 18 olyan beteget, akiket purin analógokkal kezeltek rituximab-tal kombinációban, mint a kezelés második vonalát, miután purin analógokkal kezelték őket egyetlen hatóanyagként. Minden beteg reagált, a teljes válaszarány 89% volt.60
Rituximab hetente 375 mg/m2-en, 8 héten át, kezdeti kezelésként 5 adag beadása után.,A 6 mg/m2 kladribin 2-h IV infúzióval 5 napig 100% – os teljes választ eredményez.61 különleges vagy kedvezőtlen helyzetekben 100 mg rituximab hetente 4-6 hétig használható. Ez kevésbé költséges és általában hatékony, különösen akkor, ha interferonnal kombinálják.
míg a purin analógok nem képesek a HCL kiküszöbölésére, mivel a kladribin beadása után észlelt minimális maradék betegség (MRD) mindig erősen CD20+, az MRD felszámolása rituximab alkalmazásával érhető el. Rivandi et al., egy előzetes vizsgálatban bebizonyosodott, hogy a rituximab a hagyományos dózisokban 8 hétig nagy aktivitással jár, 13 betegben megszünteti az MRD-t, amikor 4 héttel a kladribin beadása után alkalmazzák.62
Vemurafenib
a korábban leírtak szerint a BRAF V600E mutáció a HCL genetikai kulcsa. Ezért ez egy terápiás cél, amelyet az elmúlt években tanulmányoztak. A Vemurafenib egy BRAF v600e orális inhibitor. Tiacci et al., egy tanulmányt, hogy az intézkedés Vemurafenib tevékenység biztonsági betegek HLC, aki visszaesett a kezelés után a purin analógok vagy tűzálló, hogy a közigazgatás, a purin analógok. A globális válaszarány 96% és a teljes válaszarány 35% volt, a relapszusmentes túlélés átlaga 19 hónap volt. A mellékhatások kiütés, arthralgia és ízületi gyulladás voltak.63
mivel pozitív összefüggést figyeltek meg a Vemurafenib alkalmazása és a bőrgyógyászati malignitások kialakulása között, a bőr gyakori feltárása javasolt.,
Ibrutinib
a Burton tirozin-kináz szelektív és irreverzibilis inhibitora beavatkozik a B-sejt jelátviteli útvonalába.64 a közelmúltban megkezdődött az ibrutinib klinikai vizsgálata HCL relapszusban szenvedő betegeknél. Az előzetes hatásossági és biztonságossági adatok olyan káros hatásokat mutatnak, mint a kitörések, a hasmenés és az arthralgia. Ez a klinikai vizsgálat jelenleg az Egyesült Államok több központjában zajlik (NCT01841723).
Immunotoxinok
a monoklonális antitest citotoxicitás növelése érdekében olyan technikákat hoztak létre, amelyek megkönnyítik az antitest–toxin vagy antitest–gyógyszer konjugátumok előállítását., Az immunotoxin egy bakteriális toxin (azaz Pseudomonas exotoxin vagy diftéria) és egy monoklonális antitest változó frakciója közötti fúzió, amelynek specifikus célpontja a neoplasztikus sejtek, például a CD25 vagy a CD22 felületén található. Ez a toxin a neoplasztikus sejt belsejében szabadul fel, és gátolja a fehérjeszintézist.A 65
BL22 a P. exotoxin PE38 csonka alakjával fuzionált CD22 elleni immunotoxin. Egy fázis II klinikai vizsgálatban a BL22-T 36 HCL relapszus vagy refrakter betegség esetén vizsgálták., Egy ciklus után (kétnaponta 40 mg/kg, három adag) a teljes válaszarány 25%, a globális válaszarány pedig 50% volt. Ezek a válaszok 47% – os teljes válaszarány és 72% – os globális válaszarány javultak az ismételt kezelés után (csak cytopeniás betegeknél). Két betegnél urémiás hemolitikus szindróma alakult ki anélkül, hogy a plazmaferezisre vissza kellene térni.66 ezt követően a moxetumomab pasudotoxot a BL22 módosított változataként fejlesztették ki, nagyobb affinitással és citotoxicitással., Egy I. fázisú vizsgálatban, amelyben 28, HCL relapszusban és rezisztenciában szenvedő beteg vett részt, 86% – os globális válaszarányt értek el, beleértve a betegek 46% – ánál a tartós teljes válaszarányt.67
Terápiás lehetőségek kedvezőtlen körülmények
bár HCL kezelik a legtöbb fejlett országban a kladribin, valamint pentostatin, tény, hogy ezek a gyógyszerek nem csak drága, nem állnak rendelkezésre a Mexikói sok országban a korlátozott erőforrások., Tehát az ilyen típusú körülmények között vannak más megfizethető terápiás lehetőségek is, kedvező eredményekkel
az alfa-Interferon a HCL betegkezeléshez először 1984-ben került bevezetésre. Napjainkban használata korlátozott, elsősorban a purin analógok nagy hatékonysága miatt. Másrészt az alacsony gazdasági erőforrásokkal rendelkező országokban ez egy olcsó lehetőség, amely hasonló eredményeket mutatott a kladribinéhoz a globális túlélés szempontjából. Ruiz-Delgado et al., összehasonlító vizsgálatot végzett az alfa-interferon (n=18) és a kladribin (n=11) között, ahol a globális túlélés különbsége mindkét csoport között nem volt statisztikailag szignifikáns; 94% 217 hónap az interferon csoportban, 91% pedig 133 hónap a kladribin csoportban.68 a központunkban végzett vizsgálatban kilenc HCL-beteg három IFN mega-egységet kapott hetente háromszor 12 héten keresztül, majd 8 héten keresztül ismét kezelést kaptak, amikor leukémia reaktiválódott, vagy évente 10 hónapos megfigyelés után., Minden betegnek hematológiai remissziója volt 12 hetes kezelés előtt. Ez a terápiás lehetőség olcsóbb, hatékony és összehasonlítható az IFN-kezelés más formáival az ilyen típusú leukémiában szenvedő betegek kezelésében és fenntartásában.69 lehetséges az interferon rituximabbal történő kombinálása a toxikus hatások növelése és a hatékonyság javítása nélkül.
a splenectomia volt az első olyan beavatkozás, amely jelentősen megváltoztatta a betegek túlélését. Ma ritkán használják., Fájdalmas, masszív splenomegáliában (>10cm a bordaszél alatt) és a csontvelő minimális infiltrációjában, vagy interferon-és purin-analógokkal való kezelésre refrakter betegeknél ajánlott.33 retrospektív vizsgálat szerint a teljes válaszarány 40-62%, az átlagos túlélési arány 5 év alatt 68%.70,71 Lad et al. közzétett egy retrospektív vizsgálatot, köztük 24 HCL-diagnózisban szenvedő beteget, két csoportra osztották őket: 17 beteg kladribint kapott, 7 pedig splenectomizált., A splenectomiás csoportban a betegek 75% – a teljes remissziót mutatott,94% – uk a kladribin csoportban. Mindkét csoport összehasonlításakor érdekes megállapítás volt, hogy nem figyeltek meg statisztikailag szignifikáns különbséget a leukémia-mentes túlélés és a globális túlélés tekintetében.72
prognózis
A betegek túlélési ideje a diagnózis felállítását követően 4 évvel a kezelés ismertetése előtt volt, a cytopeniákból származó szövődmények, köztük vérzések és fertőzések miatt. Ezt követően, amikor a splenectomiát első vonalbeli kezelésként kezelték, a teljes válasz 40-62% volt, a túlélési arány pedig 5 év 61-68% volt., Ezután az alfa-interferont használták az első gyógyszerként, amelynek előnyei voltak a HCL kezelésében. Ennek ellenére a teljes válaszarány alacsony volt, 10% – on.73
ma purin analógokkal (pentosztatin és kladribin) a teljes válasz a 10 éves medián túlélés esetén a betegek legfeljebb 80% – ánál jelentkezik. A globális válaszarány 96-100%, a teljes válaszarány 80% , a túlélési arány pedig 10 év, 85-100% között mozog.74 ennek ellenére a HCL-ben szenvedő betegek jelentős része nem reagál a kezelésre, vagy rezisztenssé válik., A betegek legfeljebb 48% – a visszaesik a következő 15 évben.75 a HCL betegek jövője nagyon kedvező. A kihívás az, hogy ezt a rosszindulatú daganatot a lehető leghamarabb azonosítsuk, és megfelelően kezeljük a rendelkezésre álló erőforrások felhasználásával.
összeférhetetlenség
a szerzőknek nincs érdekellentétük.