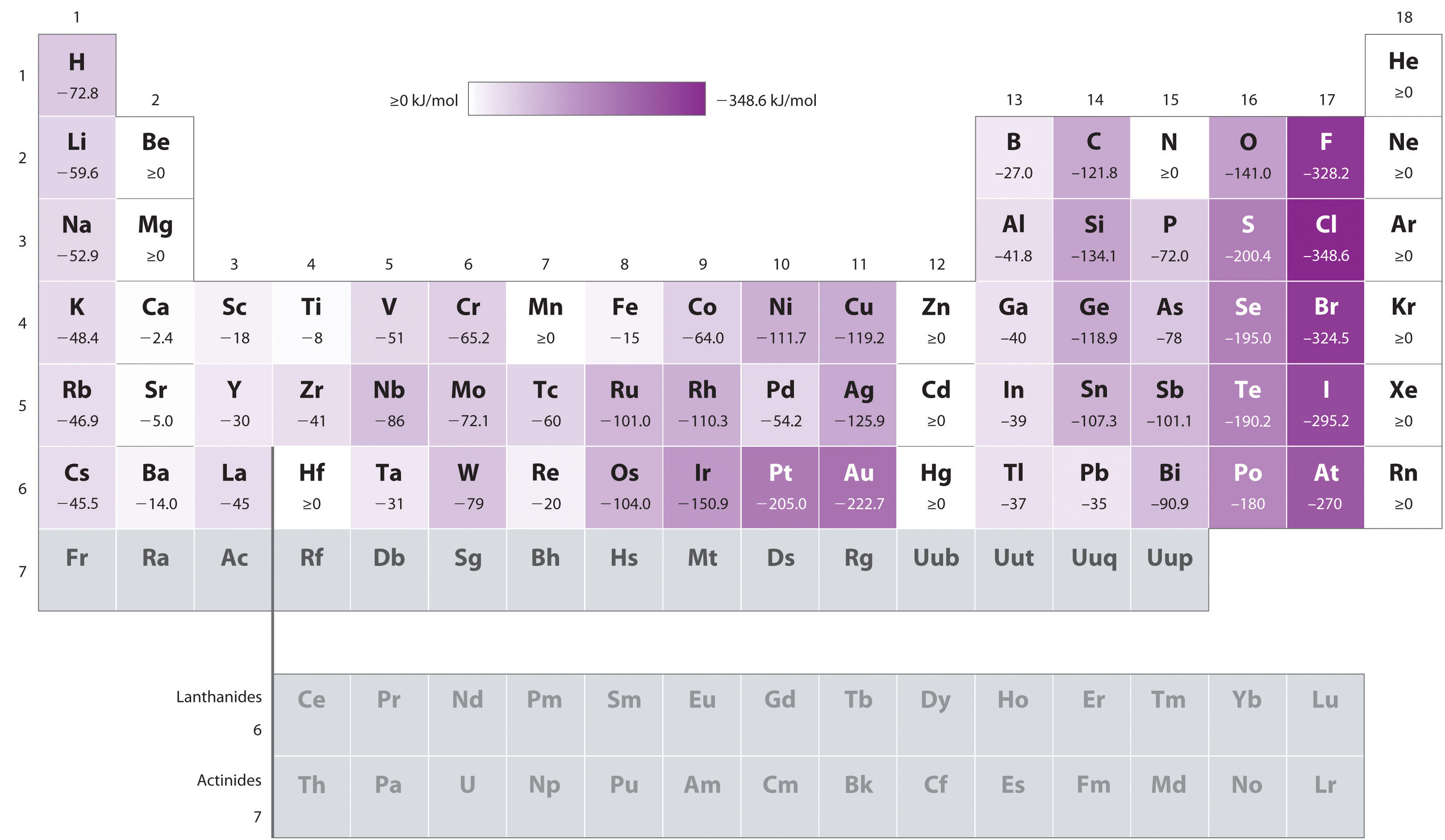
Gli atomi con i raggi più grandi, che hanno le energie di ionizzazione più basse (affinità per i propri elettroni di valenza), hanno anche la più bassa affinità per un elettrone aggiunto. Ci sono, tuttavia, due grandi eccezioni a questa tendenza:
- Le affinità di elettroni degli elementi da B a F nella seconda riga della tavola periodica sono meno negative di quelle degli elementi immediatamente sotto di loro nella terza riga., Apparentemente, l’aumento delle repulsioni elettrone–elettrone sperimentate dagli elettroni confinati agli orbitali 2p relativamente piccoli supera l’aumentata attrazione elettrone–nucleo a brevi distanze nucleari. Il fluoro, pertanto, ha un’affinità inferiore per un elettrone aggiunto rispetto al cloro. Di conseguenza, gli elementi della terza fila (n = 3) hanno le affinità elettroniche più negative. Più in basso di una colonna, l’attrazione per un elettrone aggiunto diminuisce perché l’elettrone sta entrando in un orbitale più distante dal nucleo., Anche le repulsioni elettrone–elettrone diminuiscono perché gli elettroni di valenza occupano un volume maggiore di spazio. Questi effetti tendono ad annullarsi a vicenda, quindi i cambiamenti nell’affinità elettronica all’interno di una famiglia sono molto più piccoli dei cambiamenti nell’energia di ionizzazione.
- Le affinità elettroniche dei metalli alcalino-terrosi diventano più negative da Be a Ba. La separazione di energia tra l’ns2 riempito e le subshell np vuote diminuisce con l’aumentare di n, in modo che la formazione di un anione dagli elementi più pesanti diventa energeticamente più favorevole.,
Le equazioni di secondo e più elevato di elettroni affinità sono analoghe a quelle per il secondo e superiore le energie di ionizzazione:
\
\
Come abbiamo visto, la prima affinità elettronica può essere maggiore o uguale a zero o negativo, a seconda della configurazione elettronica dell’atomo. Al contrario, la seconda affinità elettronica è sempre positiva perché l’aumento delle repulsioni elettrone–elettrone in un dianione è molto maggiore dell’attrazione del nucleo per gli elettroni extra., Per esempio, il primo affinità elettronica di ossigeno è -141 kJ/mol, ma il secondo affinità elettronica è +744 kJ/mol:
\
\
Così la formazione di azoto gassoso (\(O^{2−}\)) ione è energeticamente molto sfavorevole (stimato, con l’aggiunta di passaggi):
\
Mentre il primo elettrone affinità può essere negativo, positivo o pari a zero, secondo elettrone affinità sono sempre positivi.,
Se è necessaria energia per formare sia cationi caricati positivamente che polianioni monatomici, perché si formano composti ionici come \(MgO\), \(Na_2S\) e \(Na_3P\)? Il fattore chiave nella formazione di composti ionici stabili sono le interazioni elettrostatiche favorevoli tra i cationi e gli anioni nel sale cristallino.
Esempio \(\PageIndex{1}\): Affinità di elettroni contrastanti di Sb, Se e Te
In base alle loro posizioni nella tavola periodica, quale di Sb, Se o Te prevederesti di avere l’affinità elettronica più negativa?,
Dato: tre elementi
Richiesto: elemento con affinità elettronica più negativa
Strategia:
- Individuare gli elementi nella tavola periodica. Usa le tendenze nelle affinità degli elettroni che scendono da una colonna per gli elementi dello stesso gruppo. Allo stesso modo, usa le tendenze delle affinità degli elettroni da sinistra a destra per gli elementi nella stessa riga.
- Posiziona gli elementi in ordine, elencando prima l’elemento con l’affinità elettronica più negativa.,
Soluzione:
A Sappiamo che le affinità degli elettroni diventano meno negative scendendo una colonna (tranne che per le affinità degli elettroni anomalmente basse degli elementi della seconda riga), quindi possiamo prevedere che l’affinità degli elettroni di Se è più negativa di quella di Te. Sappiamo anche che le affinità degli elettroni diventano più negative da sinistra a destra attraverso una riga e che gli elementi del gruppo 15 tendono ad avere valori meno negativi del previsto., Poiché Sb si trova a sinistra di Te e appartiene al gruppo 15, prevediamo che l’affinità elettronica di Te sia più negativa di quella di Sb. L’ordine complessivo è Se< Te< Sb, quindi Se ha l’affinità elettronica più negativa tra i tre elementi.