In primo luogo è necessario conoscere il numero di elettroni di valenza. Puoi farlo (1) disegnando la configurazione elettronica per elemento o (2) consultando la tua tavola periodica.,
Se si è scelto di disegnare la configurazione elettronica per elemento, si avrà qualcosa di simile a questo:
#N# (numero atomico = 7) : #1s^2# #colore (rosso) (2s^2)# #colore (rosso) (2p^3)# (5 ultraperiferiche elettroni)
#O# (numero atomico = 8) : #1s^2# #colore (rosso) (2s^2)# #colore (rosso) (2p^4)# (6 ultraperiferiche elettroni)
Se si sceglie di consultare la vostra tavola, basta notare che #N# appartengono al Gruppo 5A mentre #O# appartiene al Gruppo 6A. Il gruppo numero indica il numero di ultraperiferiche elettroni.,
Ora che conosci il numero di elettroni di valenza per elemento, devi calcolare gli elettroni di valenza totali per lo ion #NO_3^”-1″#.
5 + (3 x 6) = 23 elettroni
Ma poiché l’intera molecola ha una carica -1, è necessario aggiungere anche questo. Quindi il numero totale di elettroni di valenza è 24.
La prossima cosa da fare è disegnare. Normalmente, il primo elemento nella formula chimica è l’atomo centrale. In questo caso, l’atomo #N # è circondato da tre atomi# O#.,
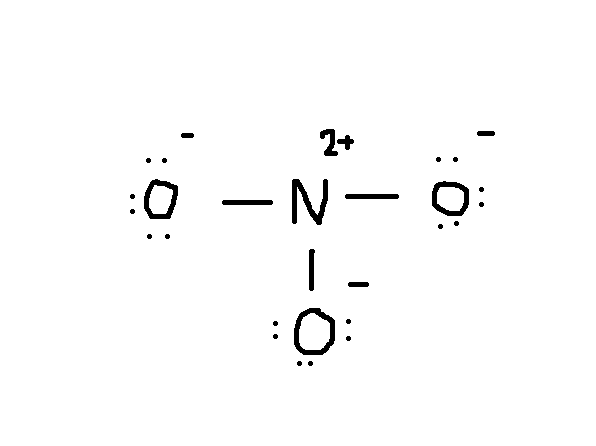
Si noti che anche la coppia solitaria di elettroni da #O# è inclusa nel diagramma. Se si conta il numero totale di elettroni sul disegno sopra, è già 24 elettroni (la linea singola conta come 2 elettroni). Ma questo disegno ha violato la regola dell’ottetto poiché l’atomo centrale ha solo 6 elettroni invece del numero corretto 8. Quindi cosa fare?
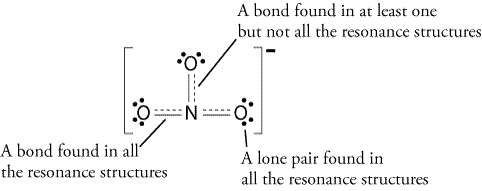
Aggiungere un altro legame, ma dove?,
Pertanto, la risonanza struttura sarebbe simile a questa: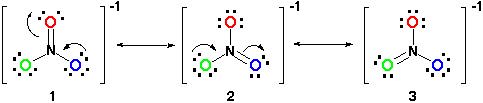
Tutte le strutture di risonanza sono corrette, dal momento che segue la regola dell’ottetto e tutti hanno un numero totale di 24 elettroni. Basta prendere nota che l’unico legame in movimento è il legame pi (#pi#) o in parole povere, il doppio legame e una delle coppie di elettroni da #O# atomo.