La luce ha le particelle e le proprietà delle onde allo stesso tempo. Allo stesso modo, de Broglie (Francia, 1892 – 1987) pensava che cose come gli elettroni che finora erano stati considerati particelle potessero possedere anche la natura ondulatoria (1932). Questa è l’idea delle onde di de Broglie o onde di materia di de Broglie.,
Consideriamo un atomo di idrogeno con la teoria quantistica di Bohr. In questa teoria, la condizione quantistica per determinare gli stati stazionari dell’atomo sembra affermare che la circonferenza dell’orbita dell’elettrone che ruota attorno al nucleo dovrebbe essere un multiplo integrale della lunghezza d’onda dell’onda di de Broglie dell’elettrone.
Questa condizione quantistica dice che l’onda di de Broglie dell’elettrone deve essere un’onda stazionaria continua attorno al nucleo.,
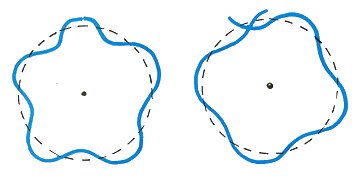
Nella figura a destra, l’onda di de Broglie non si collega senza problemi, perché la circonferenza non è un multiplo integrale della lunghezza d’onda. Vale a dire, la figura giusta non mostra un’onda di de Broglie corretta in un atomo di idrogeno.