Obiettivi di Apprendimento
- Confrontare le mutazioni puntiformi e le mutazioni frameshift
- Descrivere le differenze tra missense, nonsense e silenzioso mutazioni
- Descrivere le differenze tra la luce e il buio di riparazione
- Spiegare come diversi mutageni atto
- Spiegare perché il test di Ames può essere utilizzato per rilevare sostanze cancerogene
- Analizzare sequenze di DNA e di identificare esempi di tipi di mutazioni
una mutazione è Un cambiamento ereditabile nella sequenza del DNA di un organismo., L’organismo risultante, chiamato mutante, può avere un cambiamento riconoscibile nel fenotipo rispetto al tipo selvaggio, che è il fenotipo più comunemente osservato in natura. Un cambiamento nella sequenza del DNA è conferito a mRNA con la trascrizione e può condurre ad una sequenza alterata dell’amminoacido in una proteina sulla traduzione. Poiché le proteine svolgono la stragrande maggioranza delle funzioni cellulari, un cambiamento nella sequenza di aminoacidi in una proteina può portare ad un fenotipo alterato per la cellula e l’organismo.,
Effetti delle mutazioni sulla sequenza del DNA
Esistono diversi tipi di mutazioni che vengono classificate in base al modo in cui la molecola del DNA viene alterata. Un tipo, chiamato mutazione puntiforme, colpisce una singola base e più comunemente si verifica quando una base viene sostituita o sostituita da un’altra. Le mutazioni derivano anche dall’aggiunta di una o più basi, nota come inserzione, o dalla rimozione di una o più basi, nota come delezione.
Pensaci
- Che tipo di mutazione si verifica quando un gene ha due nucleotidi in meno nella sua sequenza?,
Effetti delle mutazioni sulla struttura e sulla funzione delle proteine
Le mutazioni puntiformi possono avere un’ampia gamma di effetti sulla funzione delle proteine (Figura 1). Come conseguenza della degenerazione del codice genetico, una mutazione del punto provocherà comunemente lo stesso amminoacido che è incorporato nel polipeptide risultante malgrado il cambiamento di sequenza. Questo cambiamento non avrebbe alcun effetto sulla struttura della proteina, ed è quindi chiamato una mutazione silenziosa. Una mutazione missense provoca un aminoacido differente che è incorporato nel polipeptide risultante., L’effetto di una mutazione missense dipende da quanto chimicamente diverso il nuovo amminoacido è dall’amminoacido wild-type. Anche la posizione dell’amminoacido modificato all’interno della proteina è importante. Ad esempio, se l’amminoacido modificato fa parte del sito attivo dell’enzima, l’effetto della mutazione missense può essere significativo. Molte mutazioni missense provocano proteine che sono ancora funzionali, almeno in una certa misura. A volte gli effetti delle mutazioni missense possono essere solo evidenti in determinate condizioni ambientali; tali mutazioni missense sono chiamate mutazioni condizionali., Raramente, una mutazione missense può essere utile. Nelle giuste condizioni ambientali, questo tipo di mutazione può dare all’organismo che lo ospita un vantaggio selettivo. Ancora un altro tipo di mutazione puntuale, chiamata mutazione senza senso, converte un codone che codifica un amminoacido (un codone di senso) in un codone di stop (un codone senza senso). Le mutazioni senza senso provocano la sintesi delle proteine che sono più corte del tipo selvaggio e tipicamente non funzionali.
Anche le cancellazioni e gli inserimenti causano vari effetti., Poiché i codoni sono triplette di nucleotidi, inserzioni o delezioni in gruppi di tre nucleotidi possono portare all’inserimento o alla cancellazione di uno o più amminoacidi e non possono causare effetti significativi sulla funzionalità della proteina risultante. Tuttavia, le mutazioni del frameshift, causate da inserzioni o eliminazioni di un numero di nucleotidi che non sono un multiplo di tre, sono estremamente problematiche perché uno spostamento nei risultati del frame di lettura (Figura 1). Poiché i ribosomi leggono l’mRNA in codoni tripletti, le mutazioni di frameshift possono cambiare ogni amminoacido dopo il punto della mutazione., Il nuovo frame di lettura può anche includere un codone di arresto prima della fine della sequenza di codifica. Di conseguenza, le proteine fatte dai geni che contengono le mutazioni di frameshift sono quasi sempre non funzionali.
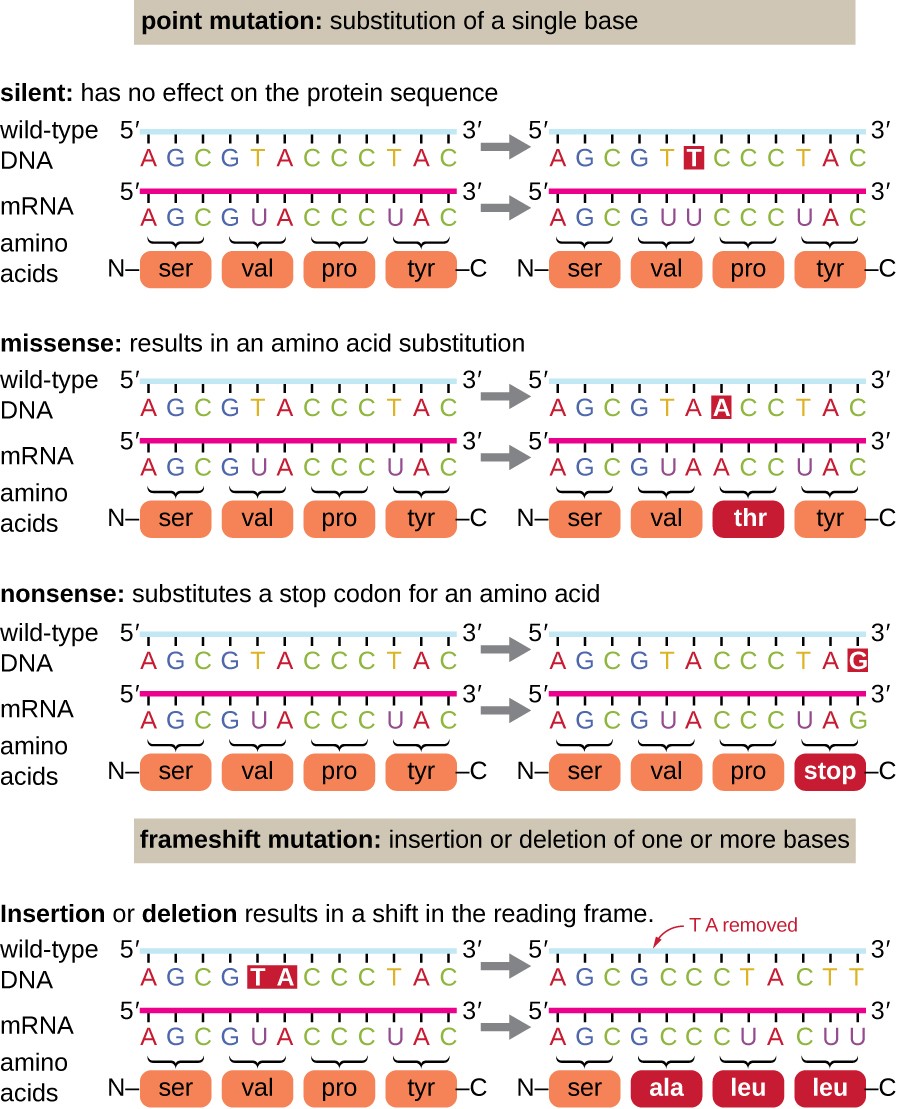
Figura 1. Clicca per ingrandire l’immagine. Le mutazioni possono portare a cambiamenti nella sequenza proteica codificata dal DNA.
Pensaci
- Quali sono le ragioni per cui un cambiamento nucleotidico in un gene per una proteina potrebbe non avere alcun effetto sul fenotipo di quel gene?,
- È possibile per un inserimento di tre nucleotidi insieme dopo il quinto nucleotide in un gene proteina-codificante per produrre una proteina che è più breve del normale? Come o come no?
Una mutazione benefica
Dal momento che il primo caso di infezione da virus dell’immunodeficienza umana (HIV) è stato segnalato nel 1981, quasi 40 milioni di persone sono morte per infezione da HIV, il virus che causa la sindrome da immunodeficienza acquisita (AIDS)., Il virus si rivolge alle cellule T helper che svolgono un ruolo chiave nel colmare la risposta immunitaria innata e adattativa, infettando e uccidendo le cellule normalmente coinvolte nella risposta del corpo alle infezioni. Non esiste una cura per l’infezione da HIV, ma molti farmaci sono stati sviluppati per rallentare o bloccare la progressione del virus. Sebbene individui in tutto il mondo possano essere infettati, la più alta prevalenza tra le persone di 15-49 anni è nell’Africa sub-sahariana, dove quasi una persona su 20 è infetta, rappresentando più del 70% delle infezioni in tutto il mondo (Figura 2)., Sfortunatamente, questa è anche una parte del mondo in cui le strategie di prevenzione e i farmaci per trattare l’infezione sono i più carenti.

Figura 2. L’HIV è molto diffuso nell’Africa sub-sahariana, ma la sua prevalenza è piuttosto bassa in alcune altre parti del mondo.
Negli ultimi anni, l’interesse scientifico è stato suscitato dalla scoperta di alcuni individui del nord Europa resistenti all’infezione da HIV. Nel 1998, il genetista americano Stephen J., O’Brien presso il National Institutes of Health (NIH) e colleghi hanno pubblicato i risultati della loro analisi genetica di oltre 4.000 individui. Questi hanno indicato che molti individui di discendenza eurasiatica (fino al 14% in alcuni gruppi etnici) hanno una mutazione di delezione, chiamata CCR5-delta 32, nel gene che codifica CCR5. CCR5 è un corecettore trovato sulla superficie delle cellule T che è necessario per molti ceppi del virus di entrare nella cellula ospite. La mutazione porta alla produzione di un recettore a cui l’HIV non può legarsi efficacemente e quindi blocca l’ingresso virale., Le persone omozigoti per questa mutazione hanno notevolmente ridotto la suscettibilità all’infezione da HIV, e coloro che sono eterozigoti hanno una certa protezione dalle infezioni pure.
Non è chiaro perché le persone di origine nordeuropea, in particolare, portino questa mutazione, ma la sua prevalenza sembra essere più alta nel nord Europa e diminuisce costantemente nelle popolazioni man mano che ci si sposta a sud. La ricerca indica che la mutazione è stata presente da prima della comparsa dell’HIV e potrebbe essere stata selezionata nelle popolazioni europee a seguito dell’esposizione alla peste o al vaiolo., Questa mutazione può proteggere gli individui dalla peste (causata dal batterio Yersinia pestis) e dal vaiolo (causato dal virus variola) perché questo recettore può anche essere coinvolto in queste malattie. L’età di questa mutazione è una questione di dibattito, ma le stime suggeriscono che è apparso tra 1875 anni a 225 anni fa, e potrebbe essere stato diffuso dal Nord Europa attraverso invasioni vichinghe.
Questa scoperta entusiasmante ha portato a nuove strade nella ricerca sull’HIV, tra cui la ricerca di farmaci per bloccare il legame CCR5 all’HIV in individui che non hanno la mutazione., Anche se il test del DNA per determinare quali individui portano la mutazione CCR5-delta 32 è possibile, ci sono casi documentati di individui omozigoti per la mutazione contrarre l’HIV. Per questo motivo, il test del DNA per la mutazione non è ampiamente raccomandato dai funzionari della sanità pubblica in modo da non incoraggiare comportamenti a rischio in coloro che portano la mutazione. Tuttavia, inibire il legame dell’HIV con CCR5 continua ad essere una valida strategia per lo sviluppo di terapie farmacologiche per le persone infette da HIV.,
Cause di mutazioni
Errori nel processo di replicazione del DNA possono causare mutazioni spontanee. Il tasso di errore della DNA polimerasi è una base errata per miliardo di coppie di basi replicate. L’esposizione ai mutageni può causare mutazioni indotte, che sono vari tipi di agenti chimici o radiazioni (Tabella 1). L’esposizione a un mutageno può aumentare il tasso di mutazione più di 1000 volte. I mutageni sono spesso anche cancerogeni, agenti che causano il cancro. Tuttavia, mentre quasi tutti gli agenti cancerogeni sono mutageni, non tutti i mutageni sono necessariamente cancerogeni.,
| Tabella 1., to AT base pair | Point | |||
|---|---|---|---|---|
| Intercalating agents | ||||
| Acridine orange, ethidium bromide, polycyclic aromatic hydrocarbons | Distorts double helix, creates unusual spacing between nucleotides | Introduces small deletions and insertions | Frameshift | |
| Ionizing radiation | ||||
| X-rays, γ-rays | Forms hydroxyl radicals | Causes single- and double-strand DNA breaks | Repair mechanisms may introduce mutations | |
| X-rays, γ-rays | Modifies bases (e.,g., deaminating C a U) | Converte il GC a base di coppia | Punto | |
| dalle radiazioni non-ionizzanti | ||||
| Ultravioletti | Moduli pirimidina (di solito timina) dimeri | Cause di replicazione del DNA errori | Frameshift o punto | |
Chimici Mutageni
Diversi tipi di sostanze chimiche mutagene di interagire direttamente con il DNA sia agendo come analoghi nucleosidici o per la modifica di basi nucleotidiche., Le sostanze chimiche chiamate analoghi nucleosidici sono strutturalmente simili alle normali basi nucleotidiche e possono essere incorporate nel DNA durante la replicazione (Figura 3). Questi analoghi di base inducono mutazioni perché spesso hanno regole di accoppiamento di base diverse rispetto alle basi che sostituiscono. Altri mutageni chimici possono modificare le normali basi del DNA, determinando diverse regole di accoppiamento delle basi. Ad esempio, l’acido nitroso deamina la citosina, convertendola in uracile. L’uracile si accoppia quindi con l’adenina in un successivo ciclo di replicazione, con conseguente conversione di una coppia di basi GC in una coppia di basi AT., L’acido nitroso deamina anche l’adenina in ipoxantina, che si accoppia con la citosina invece della timina, determinando la conversione di una coppia di basi TA in una coppia di basi CG.

Figura 3. Clicca per ingrandire l’immagine. (a) il nucleoside 2-aminopurina (2AP) strutturalmente è un analogo nucleosidico al nucleoside adenina, mentre il 5-bromouracile (5BU) è un analogo nucleosidico al nucleoside timina. Coppie di basi 2AP con C, convertendo una coppia di basi AT in una coppia di basi GC dopo diversi round di replica., 5BU si accoppia con G, convertendo una coppia di base AT in una coppia di base GC dopo diversi round di replica. (b) L’acido nitroso è un diverso tipo di mutageno chimico che modifica basi nucleosidiche già esistenti come C per produrre U, che coppie di basi con A. Questa modifica chimica, come mostrato qui, si traduce nella conversione di una coppia di basi CG in una coppia di basi TA.
I mutageni chimici noti come agenti intercalanti funzionano in modo diverso., Queste molecole scivolano tra le basi azotate impilate della doppia elica del DNA, distorcendo la molecola e creando una spaziatura atipica tra coppie di basi nucleotidiche (Figura 4). Di conseguenza, durante la replicazione del DNA, la DNA polimerasi può saltare la replica di diversi nucleotidi (creando una delezione) o inserire nucleotidi extra (creando un inserimento). Entrambi i risultati possono portare a una mutazione frameshift. I prodotti della combustione come gli idrocarburi policiclici aromatici sono agenti intercalanti particolarmente pericolosi che possono portare a tumori causati da mutazioni., Gli agenti intercalanti ethidium bromide e acridine orange sono comunemente usati in laboratorio per macchiare il DNA per la visualizzazione e sono potenziali mutageni.

Figura 4. Gli agenti intercalanti, come l’acridina, introducono una spaziatura atipica tra le coppie di basi, con conseguente DNA polimerasi che introduce una delezione o un’inserzione, portando a una potenziale mutazione del frameshift.
Radiazioni
L’esposizione a radiazioni ionizzanti o non ionizzanti può indurre mutazioni nel DNA, sebbene con meccanismi diversi., Forti radiazioni ionizzanti come i raggi X e i raggi gamma possono causare rotture a singolo e doppio filamento nella spina dorsale del DNA attraverso la formazione di radicali idrossilici all’esposizione alle radiazioni (Figura 5). Le radiazioni ionizzanti possono anche modificare le basi; ad esempio, la deaminazione della citosina in uracile, analoga all’azione dell’acido nitroso. L’esposizione alle radiazioni ionizzanti viene utilizzata per uccidere i microbi per sterilizzare dispositivi medici e alimenti, a causa del suo drammatico effetto non specifico nel danneggiare il DNA, le proteine e altri componenti cellulari (vedere Utilizzo di metodi fisici per controllare i microrganismi).,
Le radiazioni non ionizzanti, come la luce ultravioletta, non sono abbastanza energetiche per avviare questi tipi di cambiamenti chimici. Tuttavia, le radiazioni non ionizzanti possono indurre la formazione di dimeri tra due basi pirimidiniche adiacenti, comunemente due timine, all’interno di un filamento di nucleotidi. Durante la formazione del dimero della timina, le due timine adiacenti diventano legate covalentemente e, se lasciate non riparate, sia la replicazione del DNA che la trascrizione sono bloccate a questo punto. La DNA polimerasi può procedere e replicare il dimero in modo errato, potenzialmente portando a mutazioni del frameshift o del punto.,

Figura 5. (a) Le radiazioni ionizzanti possono portare alla formazione di rotture a filamento singolo e a doppio filamento nella spina dorsale zucchero-fosfato del DNA, nonché alla modifica delle basi (non mostrata). (b) Le radiazioni non ionizzanti come la luce ultravioletta possono portare alla formazione di dimeri di timina, che possono bloccare la replicazione e la trascrizione e introdurre mutazioni di frameshift o puntiformi.
Pensaci
- In che modo un analogo di base introduce una mutazione?,
- In che modo un agente intercalante introduce una mutazione?
- Che tipo di mutageno causa dimeri di timina?
Riparazione del DNA
Il processo di replicazione del DNA è estremamente preciso, ma gli errori possono verificarsi spontaneamente o essere indotti da mutageni. Errori non corretti possono portare a gravi conseguenze per il fenotipo. Le cellule hanno sviluppato diversi meccanismi di riparazione per ridurre al minimo il numero di mutazioni che persistono.,
Correzione di bozze
La maggior parte degli errori introdotti durante la replicazione del DNA sono prontamente corretti dalla maggior parte delle DNA polimerasi attraverso una funzione chiamata correzione di bozze. Nella correzione di bozze, la DNA polimerasi legge la base appena aggiunta, assicurandosi che sia complementare alla base corrispondente nel filo del modello prima di aggiungere quello successivo. Se è stata aggiunta una base errata, l’enzima effettua un taglio per rilasciare il nucleotide sbagliato e viene aggiunta una nuova base.,
Riparazione mancata corrispondenza
Alcuni errori introdotti durante la replica vengono corretti poco dopo lo spostamento del macchinario di replica. Questo meccanismo è chiamato riparazione disallineamento. Gli enzimi coinvolti in questo meccanismo riconoscono il nucleotide aggiunto in modo errato, lo accendono e lo sostituiscono con la base corretta. Un esempio è la riparazione della mancata corrispondenza metil-diretta in E. coli. Il DNA è emimetilato. Ciò significa che il filo parentale è metilato mentre il filo della figlia appena sintetizzato non lo è. Ci vogliono diversi minuti prima che il nuovo filo sia metilato., Le proteine MutS, MutL e MuTh si legano al sito emimetilato in cui si trova il nucleotide errato. MuTh taglia il filo non metilato (il nuovo filo). Un’esonucleasi rimuove una parte del filo (incluso il nucleotide errato). Il divario formato viene quindi riempito da DNA pol III e ligasi.
Riparazione di dimeri di timina
Poiché la produzione di dimeri di timina è comune (molti organismi non possono evitare la luce ultravioletta), i meccanismi si sono evoluti per riparare queste lesioni., Nella riparazione dell’escissione nucleotidica (chiamata anche riparazione oscura), gli enzimi rimuovono il dimero pirimidinico e lo sostituiscono con i nucleotidi corretti (Figura 6). In E. coli, il DNA viene scansionato da un complesso enzimatico. Se si riscontra una distorsione nella doppia elica introdotta dal dimero pirimidinico, il complesso enzimatico taglia la spina dorsale zucchero-fosfato diverse basi a monte ea valle del dimero e il segmento di DNA tra questi due tagli viene quindi rimosso enzimaticamente. DNA pol I sostituisce i nucleotidi mancanti con quelli corretti e DNA ligasi sigilla il divario nella spina dorsale zucchero-fosfato.,
La riparazione diretta (chiamata anche riparazione della luce) dei dimeri di timina avviene attraverso il processo di fotoreattivazione in presenza di luce visibile. Un enzima chiamato fotoliasi riconosce la distorsione nell’elica del DNA causata dal dimero della timina e si lega al dimero. Quindi, in presenza di luce visibile, l’enzima fotoliasi cambia conformazione e rompe il dimero della timina, consentendo alle timine di basare nuovamente correttamente la coppia con le adenine sul filo complementare., La fotoreattivazione sembra essere presente in tutti gli organismi, ad eccezione dei mammiferi placentari, compresi gli esseri umani. La fotoreattivazione è particolarmente importante per gli organismi cronicamente esposti alle radiazioni ultraviolette, come piante, batteri fotosintetici, alghe e coralli, per prevenire l’accumulo di mutazioni causate dalla formazione di dimeri di timina.

Figura 6. Clicca per ingrandire l’immagine. I batteri hanno due meccanismi per riparare i dimeri di timina., (a) Nella riparazione dell’escissione nucleotidica, un complesso enzimatico riconosce la distorsione nel complesso del DNA attorno al dimero della timina e taglia e rimuove il filamento di DNA danneggiato. I nucleotidi corretti sono sostituiti da DNA pol I e il filamento nucleotidico è sigillato dalla DNA ligasi. b) Nella fotoreattivazione, l’enzima fotoliasi si lega al dimero della timina e, in presenza di luce visibile, rompe il dimero, ripristinando l’accoppiamento di base delle timine con adenine complementari sul filamento di DNA opposto.,
Pensaci
- Durante la riparazione della mancata corrispondenza, come fa l’enzima a riconoscere quale è il nuovo e quale è il vecchio filamento?
- In che modo un agente intercalante introduce una mutazione?
- Che tipo di mutazione ripara la fotoliasi?
Identificazione dei mutanti batterici
Una tecnica comune utilizzata per identificare i mutanti batterici è chiamata replica plating., Questa tecnica viene utilizzata per rilevare mutanti nutrizionali, chiamati auxotrofi, che hanno una mutazione in un gene che codifica un enzima nella via di biosintesi di un nutriente specifico, come un amminoacido. Di conseguenza, mentre le cellule wild-type mantengono la capacità di crescere normalmente su un mezzo privo del nutriente specifico, gli auxotrofi non sono in grado di crescere su tale mezzo. Durante la placcatura replica (Figura 7), una popolazione di cellule batteriche viene mutagenizzata e quindi placcata come singole cellule su una piastra completa nutrizionalmente complessa e lasciata crescere in colonie., Le cellule di queste colonie vengono rimosse da questa piastra principale, spesso usando velluto sterile. Questo velluto, contenente celle, viene quindi premuto con lo stesso orientamento su lastre di vari supporti. Almeno una piastra dovrebbe anche essere nutrizionalmente completa per garantire che le cellule vengano trasferite correttamente tra le piastre. Le altre piastre mancano di nutrienti specifici, consentendo al ricercatore di scoprire vari mutanti auxotrofi incapaci di produrre nutrienti specifici. Le cellule della colonia corrispondente sulla piastra nutrizionalmente completa possono essere utilizzate per recuperare il mutante per ulteriori studi.,

Figura 7. L’identificazione dei mutanti auxotrophic, come auxotrophs dell’istidina, è fatta facendo uso della placcatura della replica. Dopo la mutagenesi, le colonie che crescono su un mezzo nutrizionalmente completo ma non su un mezzo privo di istidina sono identificate come auxotrofi di istidina.
Pensaci
- Perché le cellule vengono placcate su una piastra nutrizionalmente completa oltre alle piastre carenti di nutrienti quando si cerca un mutante?,
Il test Ames
Il test Ames, sviluppato da Bruce Ames (1928–) negli anni ‘ 70, è un metodo che utilizza batteri per uno screening rapido e poco costoso del potenziale cancerogeno di nuovi composti chimici. Il test misura il tasso di mutazione associato all’esposizione al composto, che, se elevato, può indicare che l’esposizione a questo composto è associata a un maggiore rischio di cancro., Il test Ames utilizza come organismo di prova un ceppo di Salmonella typhimurium che è un istidina auxotroph, incapace di sintetizzare la propria istidina a causa di una mutazione in un gene essenziale richiesto per la sua sintesi. Dopo l’esposizione a un potenziale mutageno, questi batteri vengono placcati su un mezzo privo di istidina e il numero di mutanti che riacquistano la capacità di sintetizzare l’istidina viene registrato e confrontato con il numero di tali mutanti che si presentano in assenza del potenziale mutageno (Figura 8)., Le sostanze chimiche che sono più mutagene porteranno più mutanti con la sintesi di istidina ripristinata nel test di Ames. Poiché molte sostanze chimiche non sono direttamente mutagene ma sono metabolizzate in forme mutagene dagli enzimi epatici, l’estratto di fegato di ratto è comunemente incluso all’inizio di questo esperimento per imitare il metabolismo del fegato. Dopo il test Ames, i composti identificati come mutageni vengono ulteriormente testati per le loro potenziali proprietà cancerogene utilizzando altri modelli, inclusi modelli animali come topi e ratti.
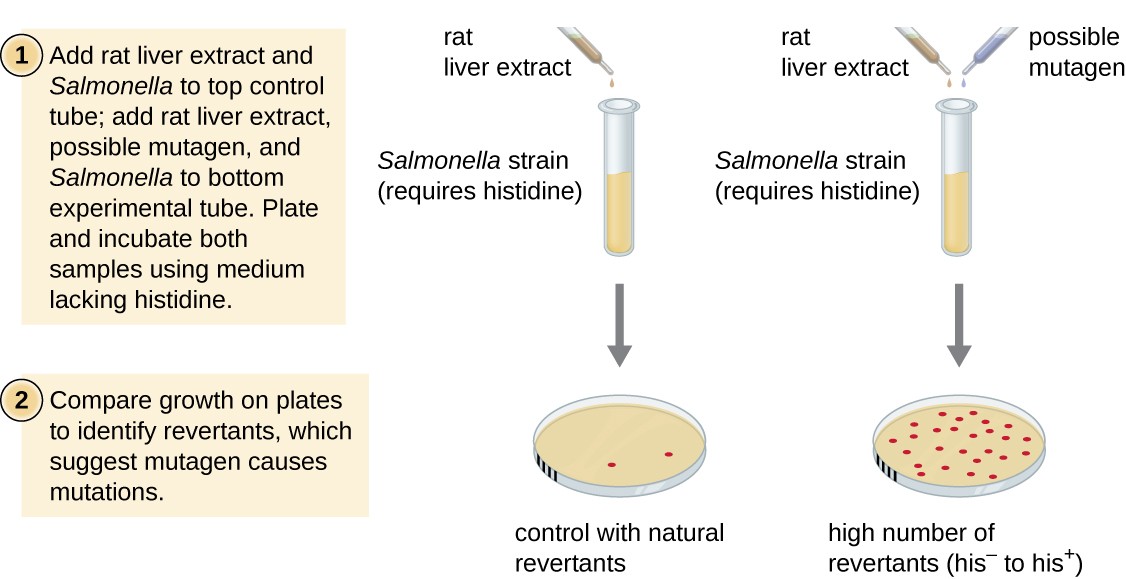
Figura 8., Il test Ames viene utilizzato per identificare sostanze chimiche mutagene e potenzialmente cancerogene. Una Salmonella istidina auxotroph è usato come ceppo di prova, esposto ad un potenziale mutageno/cancerogeno. Il numero di mutanti di reversione in grado di crescere in assenza di istidina fornita viene contato e confrontato con il numero di mutanti di reversione naturali che si presentano in assenza del potenziale mutageno.
Pensaci
- Quale mutazione viene utilizzata come indicatore del tasso di mutazione nel test Ames?
- Perché il test Ames può funzionare come test per la cancerogenicità?,
Concetti chiave e sommario
- Una mutazione è un cambiamento ereditario nel DNA. Una mutazione può portare a un cambiamento nella sequenza amminoacidica di una proteina, influenzando possibilmente la sua funzione.
- Una mutazione puntiforme colpisce una singola coppia di basi. Una mutazione puntuale può causare una mutazione silenziosa se il codone dell’mRNA codifica per lo stesso amminoacido, una mutazione missense se il codone dell’mRNA codifica per un aminoacido diverso, o una mutazione senza senso se il codone dell’mRNA diventa un codone di arresto.,
- Le mutazioni missense possono mantenere la funzione, a seconda della chimica del nuovo amminoacido e della sua posizione nella proteina. Mutazioni nonsense producono proteine troncate e spesso non funzionali.
- Una mutazione frameshift deriva da un inserimento o cancellazione di un numero di nucleotidi che non è un multiplo di tre. Il cambiamento nel telaio di lettura altera ogni amminoacido dopo il punto della mutazione e si traduce in una proteina non funzionale.
- Le mutazioni spontanee avvengono attraverso errori di replicazione del DNA, mentre le mutazioni indotte avvengono attraverso l’esposizione a un mutageno.,
- Gli agenti mutageni sono spesso cancerogeni ma non sempre. Tuttavia, quasi tutti gli agenti cancerogeni sono mutageni.
- I mutageni chimici includono analoghi di base e sostanze chimiche che modificano le basi esistenti. In entrambi i casi, le mutazioni vengono introdotte dopo diversi cicli di replicazione del DNA.
- Le radiazioni ionizzanti, come i raggi X e i raggi γ, portano alla rottura della spina dorsale del fosfodiestere del DNA e possono anche modificare chimicamente le basi per alterare le loro regole di accoppiamento delle basi.,
- Le radiazioni non ionizzanti come la luce ultravioletta possono introdurre dimeri di pirimidina (timina), che, durante la replicazione e la trascrizione del DNA, possono introdurre mutazioni di frameshift o puntiformi.
- Le cellule hanno meccanismi per riparare le mutazioni naturali. La DNA polimerasi ha attività di correzione di bozze. La riparazione della mancata corrispondenza è un processo per riparare le basi incorporate in modo errato dopo che la replica del DNA è stata completata.
- I dimeri di pirimidina possono anche essere riparati., Nella riparazione dell’escissione nucleotidica (riparazione scura), gli enzimi riconoscono la distorsione introdotta dal dimero della pirimidina e sostituiscono il filo danneggiato con le basi corrette, usando il filo di DNA intatto come modello. Batteri e altri organismi possono anche utilizzare la riparazione diretta, in cui l’enzima fotoliasi, in presenza di luce visibile, rompe le pirimidine.
- Attraverso il confronto tra la crescita sulla piastra completa e la mancanza di crescita su supporti privi di nutrienti specifici, possono essere identificati mutanti specifici di perdita di funzione chiamati auxotrofi.,
- Il test Ames è un metodo economico che utilizza batteri auxotrofi per misurare la mutagenicità di un composto chimico. La mutagenicità è un indicatore del potenziale cancerogeno.
Scelta multipla
Quale dei seguenti è un cambiamento nella sequenza che porta alla formazione di un codone di stop?
- missense mutation
- nonsense mutation
- silent mutation
- deletion mutation
La formazione di dimeri pirimidinici risulta da quale dei seguenti?
- spontanea errori da DNA polimerasi
- l’esposizione a radiazioni gamma
- l’esposizione a radiazione ultravioletta
- l’esposizione a intercalante agenti
Quale dei seguenti è un esempio di mutazione frameshift?
- una delezione di un codone
- mutazione missenso
- mutazione
- eliminazione di un nucleotide
Quale dei seguenti è il tipo di riparazione del DNA in cui i dimeri di timina sono direttamente suddivisi dall’enzima fotoliasi?,
- riparazione diretta
- nucleotide excision repair
- la mancata riparazione
- revisione
Quale dei seguenti riguardo al test Ames è vero?
- È usato per identificare mutanti auxotrofi di nuova formazione.
- È usato per identificare i mutanti con attività biosintetica ripristinata.
- È usato per identificare mutanti spontanei.,
- Viene utilizzato per identificare i mutanti privi di attività di fotoreattivazione.
Riempire il vuoto
Un mutageno chimico che è strutturalmente simile a un nucleotide ma ha diverse regole di accoppiamento di base è chiamato ________.,
L’enzima utilizzato nella riparazione leggera per dividere i dimeri di timina è chiamato ________.
Il fenotipo di un organismo che è più comunemente osservato in natura è chiamato ________.,
Vero/Falso
Gli agenti cancerogeni sono in genere mutageni.
Pensaci
Perché è più probabile che le inserzioni o le eliminazioni siano più dannose per una cellula rispetto alle mutazioni puntuali?,
Perché pensi che il test Ames sia preferibile all’uso di modelli animali per esaminare i composti chimici per la mutagenicità?
Pensiero critico
Di seguito sono riportate diverse sequenze di DNA che sono mutate rispetto alla sequenza wild-type: 3′-T A C T G A C T G A C G A T C-5′. Immagina che ognuno sia una sezione di una molecola di DNA che si è separata in preparazione per la trascrizione, quindi stai solo vedendo il filo del modello., Costruire le sequenze di DNA complementari (indicando 5′ e 3′ estremità) per ogni sequenza di DNA mutato, quindi trascrivere (indicando 5 ‘e 3’ estremità) i filamenti modello e tradurre le molecole di mRNA utilizzando il codice genetico, registrando la sequenza amminoacidica risultante (indicando i termini N e C). Che tipo di mutazione è ciascuno?,>
il DNA Complementare sequenza:
sequenza di mRNA trascritto da template:
sequenza di Aminoacidi, peptidi di:
il Tipo di mutazione:
il DNA Complementare sequenza:
sequenza di mRNA trascritto da template:
sequenza di Aminoacidi, peptidi di:
il Tipo di mutazione: