Il modo in cui gli elementi interagiscono tra loro dipende da come sono disposti i loro elettroni e da quante aperture per gli elettroni esistono nella regione più esterna in cui gli elettroni sono presenti in un atomo. Gli elettroni esistono a livelli di energia che formano gusci intorno al nucleo. Il guscio più vicino può contenere fino a due elettroni. Il guscio più vicino al nucleo viene sempre riempito per primo, prima che qualsiasi altro guscio possa essere riempito. L’idrogeno ha un elettrone; pertanto, ha solo un punto occupato all’interno del guscio più basso., L’elio ha due elettroni; pertanto, può riempire completamente il guscio più basso con i suoi due elettroni. Se guardi la tavola periodica, vedrai che l’idrogeno e l’elio sono gli unici due elementi nella prima riga. Questo perché hanno solo elettroni nel loro primo guscio. Idrogeno ed elio sono gli unici due elementi che hanno il guscio più basso e nessun altro guscio.
Il secondo e il terzo livello di energia possono contenere fino a otto elettroni. Gli otto elettroni sono disposti in quattro coppie e una posizione in ogni coppia viene riempita con un elettrone prima che tutte le coppie siano completate.,
Guardando di nuovo la tavola periodica (Figura 1), noterai che ci sono sette righe. Queste righe corrispondono al numero di shell che hanno gli elementi all’interno di quella riga. Gli elementi all’interno di una particolare riga hanno un numero crescente di elettroni mentre le colonne procedono da sinistra a destra. Sebbene ogni elemento abbia lo stesso numero di gusci, non tutti i gusci sono completamente pieni di elettroni. Se guardi la seconda fila della tavola periodica, troverai litio (Li), berillio (Be), boro (B), carbonio (C), azoto (N), ossigeno (O), fluoro (F) e neon (Ne)., Questi hanno tutti elettroni che occupano solo il primo e il secondo guscio. Il litio ha un solo elettrone nel suo guscio più esterno, il berillio ha due elettroni, il boro ne ha tre e così via, finché l’intero guscio non viene riempito con otto elettroni, come nel caso del neon.
Non tutti gli elementi hanno abbastanza elettroni per riempire i loro gusci più esterni, ma un atomo è al suo massimo stabile quando tutte le posizioni degli elettroni nel guscio più esterno sono riempite., A causa di questi posti vacanti nei gusci più esterni, vediamo la formazione di legami chimici o interazioni tra due o più elementi uguali o diversi che provocano la formazione di molecole. Per ottenere una maggiore stabilità, gli atomi tenderanno a riempire completamente i loro gusci esterni e si legheranno con altri elementi per raggiungere questo obiettivo condividendo elettroni, accettando elettroni da un altro atomo o donando elettroni ad un altro atomo., Poiché i gusci più esterni degli elementi con numeri atomici bassi (fino al calcio, con numero atomico 20) possono contenere otto elettroni, questo è indicato come la regola dell’ottetto. Un elemento può donare, accettare o condividere elettroni con altri elementi per riempire il suo guscio esterno e soddisfare la regola dell’ottetto.
Quando un atomo non contiene un numero uguale di protoni ed elettroni, è chiamato ion. Poiché il numero di elettroni non è uguale al numero di protoni, ogni ion ha una carica netta. Gli ioni positivi si formano perdendo elettroni e sono chiamati cationi., Gli ioni negativi si formano guadagnando elettroni e sono chiamati anioni.
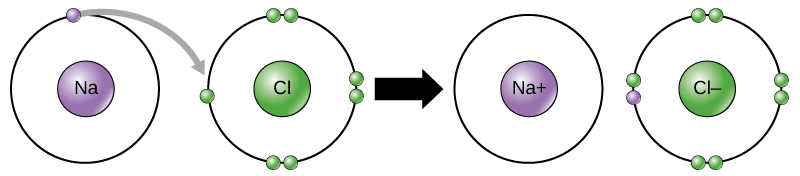
Ad esempio, il sodio ha solo un elettrone nel suo guscio più esterno. Ci vuole meno energia per il sodio per donare che un elettrone di quanto non faccia per accettare altri sette elettroni per riempire il guscio esterno. Se il sodio perde un elettrone, ora ha 11 protoni e solo 10 elettroni, lasciandolo con una carica complessiva di +1. Ora è chiamato uno ion di sodio.
L’atomo di cloro ha sette elettroni nel suo guscio esterno. Ancora una volta, è più efficiente dal punto di vista energetico per il cloro guadagnare un elettrone che perderne sette., Pertanto, tende a guadagnare un elettrone per creare uno ion con 17 protoni e 18 elettroni, dandogli una carica negativa netta (-1). Ora è chiamato chloride cloruro. Questo movimento di elettroni da un elemento all’altro è indicato come trasferimento di elettroni. Come Figura 1 illustra, un atomo di sodio (Na) ha solo un elettrone nel suo guscio più esterno, mentre un atomo di cloro (Cl) ha sette elettroni nel suo guscio più esterno. Un atomo di sodio donerà il suo unico elettrone per svuotare il suo guscio, e un atomo di cloro accetterà quell’elettrone per riempire il suo guscio, diventando cloruro., Entrambi gli ioni ora soddisfano la regola dell’ottetto e hanno gusci più esterni completi. Poiché il numero di elettroni non è più uguale al numero di protoni, ciascuno è ora uno ion e ha una carica +1 (sodio) o -1 (cloruro).

Legami ionici
Esistono quattro tipi di legami o interazioni: legami ionici, covalenti, idrogeno e interazioni di van der Waals. I legami ionici e covalenti sono forti interazioni che richiedono un apporto energetico maggiore per rompersi. Quando un elemento dona un elettrone dal suo guscio esterno, come nell’esempio dell’atomo di sodio sopra, si forma uno ion positivo (Figura 2). L’elemento che accetta l’elettrone è ora caricato negativamente., Poiché le cariche positive e negative si attraggono, questi ioni rimangono insieme e formano un legame ionico, o un legame tra ioni. Gli elementi si legano insieme all’elettrone da un elemento rimanendo prevalentemente con l’altro elemento. Quando gli ioni Na+ e Cl si combinano per produrre NaCl, un elettrone da un atomo di sodio rimane con gli altri sette dall’atomo di cloro e gli ioni sodio e cloruro si attraggono in un reticolo di ioni con una carica netta zero.,
Legami covalenti
Un altro tipo di forte legame chimico tra due o più atomi è un legame covalente. Questi legami si formano quando un elettrone è condiviso tra due elementi e sono la forma più forte e più comune di legame chimico negli organismi viventi. I legami covalenti si formano tra gli elementi che compongono le molecole biologiche nelle nostre cellule., A differenza dei legami ionici, i legami covalenti non si dissociano nell’acqua.
È interessante notare che chimici e biologi misurano la forza del legame in modi diversi. I chimici misurano la forza assoluta di un legame (la forza teorica) mentre i biologi sono più interessati a come il legame si comporta in un sistema biologico, che di solito è acquoso (a base d’acqua). Nell’acqua, i legami ionici si separano molto più facilmente dei legami covalenti, quindi i biologi direbbero che sono più deboli dei legami covalenti. Se guardi in un libro di testo di chimica, vedrai qualcosa di diverso., Questo è un ottimo esempio di come le stesse informazioni possono portare a risposte diverse a seconda della prospettiva da cui le stai visualizzando.
Gli atomi di idrogeno e ossigeno che si combinano per formare molecole d’acqua sono legati insieme da legami covalenti. L’elettrone dell’atomo di idrogeno divide il suo tempo tra il guscio esterno dell’atomo di idrogeno e il guscio esterno incompleto dell’atomo di ossigeno. Per riempire completamente il guscio esterno di un atomo di ossigeno, sono necessari due elettroni da due atomi di idrogeno, da cui il pedice “2” in H2O., Gli elettroni sono condivisi tra gli atomi, dividendo il loro tempo tra di loro per “riempire” il guscio esterno di ciascuno. Questa condivisione è uno stato di energia inferiore per tutti gli atomi coinvolti che se esistessero senza i loro gusci esterni riempiti.
Esistono due tipi di legami covalenti: polari e non polari. I legami covalenti non polari si formano tra due atomi dello stesso elemento o tra diversi elementi che condividono gli elettroni allo stesso modo. Ad esempio, un atomo di ossigeno può legarsi con un altro atomo di ossigeno per riempire i loro gusci esterni., Questa associazione è non polare perché gli elettroni saranno equamente distribuiti tra ciascun atomo di ossigeno. Due legami covalenti si formano tra i due atomi di ossigeno perché l’ossigeno richiede due elettroni condivisi per riempire il suo guscio più esterno. Gli atomi di azoto formeranno tre legami covalenti (chiamati anche triple covalenti) tra due atomi di azoto perché ogni atomo di azoto ha bisogno di tre elettroni per riempire il suo guscio più esterno. Un altro esempio di legame covalente non polare si trova nella molecola di metano (CH4). L’atomo di carbonio ha quattro elettroni nel suo guscio più esterno e ne ha bisogno di altri quattro per riempirlo., Ottiene questi quattro da quattro atomi di idrogeno, ogni atomo fornisce uno. Questi elementi condividono tutti gli elettroni allo stesso modo, creando quattro legami covalenti non polari (Figura 3).
In un legame covalente polare, gli elettroni condivisi dagli atomi trascorrono più tempo più vicino a un nucleo che all’altro nucleo. A causa della distribuzione disuguale di elettroni tra i diversi nuclei, si sviluppa una carica leggermente positiva (δ+) o leggermente negativa (δ–). I legami covalenti tra atomi di idrogeno e ossigeno nell’acqua sono legami covalenti polari., Gli elettroni condivisi trascorrono più tempo vicino al nucleo di ossigeno, dandogli una piccola carica negativa, di quanto trascorrano vicino ai nuclei di idrogeno, dando a queste molecole una piccola carica positiva.

I legami idrogeno
I legami ionici e covalenti sono legami forti che richiedono una notevole energia per rompersi. Tuttavia, non tutti i legami tra gli elementi sono legami ionici o covalenti. Possono anche formarsi legami più deboli. Queste sono attrazioni che si verificano tra cariche positive e negative che non richiedono molta energia per rompersi. Due legami deboli che si verificano frequentemente sono legami idrogeno e interazioni di van der Waals. Questi legami danno origine alle proprietà uniche dell’acqua e alle strutture uniche del DNA e delle proteine.,
Quando si formano legami covalenti polari contenenti un atomo di idrogeno, l’atomo di idrogeno in quel legame ha una carica leggermente positiva. Questo perché l’elettrone condiviso viene tirato più forte verso l’altro elemento e lontano dal nucleo di idrogeno. Poiché l’atomo di idrogeno è leggermente positivo (δ+), sarà attratto dalle cariche parziali negative vicine (δ–). Quando ciò accade, si verifica una debole interazione tra la carica δ+ dell’atomo di idrogeno di una molecola e la carica δ dell’altra molecola. Questa interazione è chiamata legame idrogeno., Questo tipo di legame è comune; ad esempio, la natura liquida dell’acqua è causata dai legami idrogeno tra le molecole d’acqua (Figura 4). I legami idrogeno conferiscono all’acqua le proprietà uniche che sostengono la vita. Se non fosse per il legame di idrogeno, l’acqua sarebbe un gas piuttosto che un liquido a temperatura ambiente.

I legami idrogeno possono formarsi tra molecole diverse e non sempre devono includere una molecola d’acqua. Gli atomi di idrogeno nei legami polari all’interno di qualsiasi molecola possono formare legami con altre molecole adiacenti. Ad esempio, i legami idrogeno tengono insieme due lunghi filamenti di DNA per dare alla molecola di DNA la sua caratteristica struttura a doppio filamento. I legami idrogeno sono anche responsabili di alcune delle strutture tridimensionali delle proteine.,
Interazioni di van der Waals
Come i legami idrogeno, le interazioni di van der Waals sono attrazioni deboli o interazioni tra molecole. Si verificano tra atomi polari, legati in modo covalente, in diverse molecole. Alcune di queste attrazioni deboli sono causate da cariche parziali temporanee formate quando gli elettroni si muovono attorno a un nucleo. Queste interazioni deboli tra le molecole sono importanti nei sistemi biologici.