Nel post precedente abbiamo introdotto ortho- ,para – and meta – directors nella sostituzione aromatica elettrofila. In precedenza abbiamo coperto il meccanismo della sostituzione aromatica elettrofila e abbiamo dimostrato che il meccanismo procede attraverso un intermedio di carbocation.,
Oggi, stiamo andando a legare questi due concetti insieme, e cercare di dimostrare che se un sostituente è un orto-, para – o meta – direttore dipende da come il sostituente influenza la stabilità del carbocation intermedio.
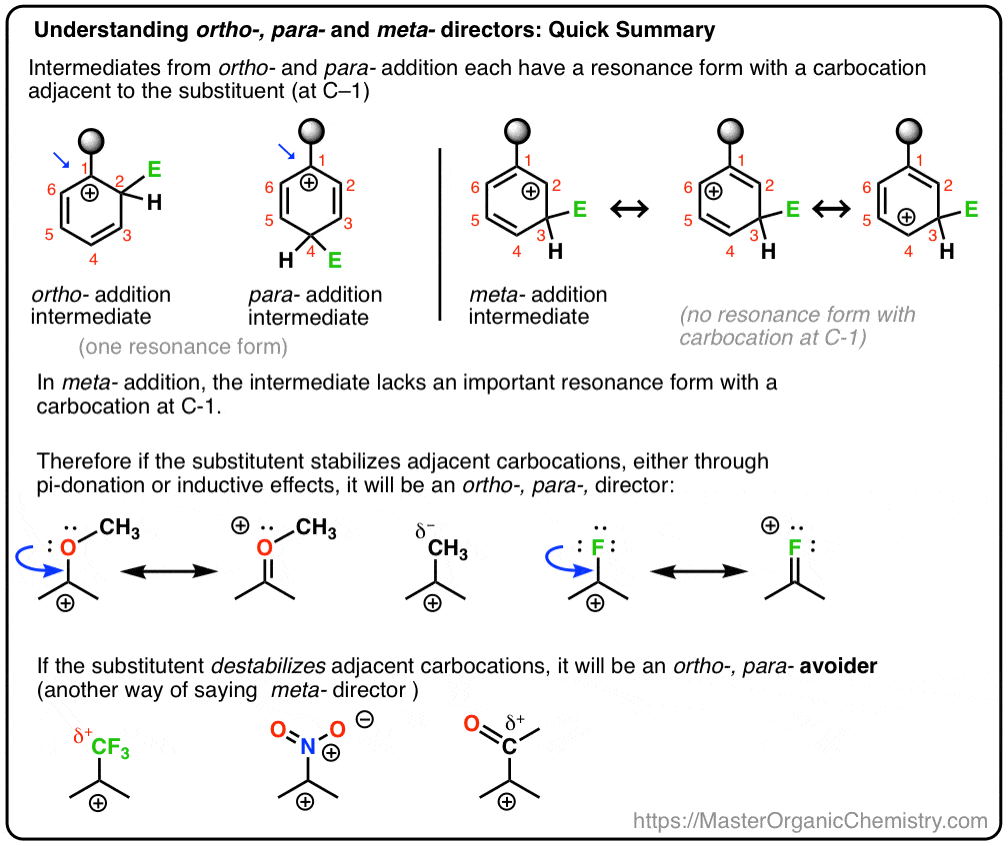
E vedremo anche perché un nome alternativo per meta – director potrebbe essere, “ortho-, para – avoider”. :- )
Sommario
- Le carbocazioni sono stabilizzate da atomi adiacenti con coppie solitarie
- Caso di studio #1: Un orto -, para-Direttore (OCH3)
- Sì, l’ossigeno è elettronegativo., Ma la donazione della sua coppia solitaria più che compensa!
- Il diagramma dell’energia di reazione per un direttore Orto Para
- Caso di studio #2: Un meta-direttore (CF3).
- Ciò che chiamiamo “meta-Direttori” è più simile a “orto -, para-Avoiders”
- Il diagramma dell’energia di reazione per un meta-Direttore
- Quindi perché gli alogeni sono Orto -, Para-Direttori?
- Note
- Quiz!,
- (Avanzato) Riferimenti e ulteriori letture
I carbocati sono stabilizzati da atomi adiacenti con coppie solitarie
Ripensiamo a quali fattori aumentano la stabilità dei carbocati.
Le carbocazioni sono specie povere di elettroni con sei elettroni nel loro guscio di valenza. Quindi, qualsiasi sostituente che può donare densità elettronica verso il carbocation si stabilizzerà. Ciò include:
- sostituenti a rilascio di elettroni che possono agire come “sigma-donatori” (ad es., molti gruppi alchilici, che donano densità elettronica attraverso effetti induttivi)
- atomi adiacenti con coppie solitarie che possono agire come” donatori di pi”alla carbocation
- legami C–C pi adiacenti che possono stabilizzare la carbocation attraverso la delocalizzazione della carica (”stabilizzazione della risonanza”, in altre parole).
E fattori che destabilizzano le carbocazioni?
- qualsiasi sostituente che rimuove la densità elettronica da un carbocation, come forti gruppi di ritiro degli elettroni.
Quindi ecco un rapido quiz., Dato tutto ciò che è scritto sopra, quale delle due carbocazioni sottostanti sarà più stabile?
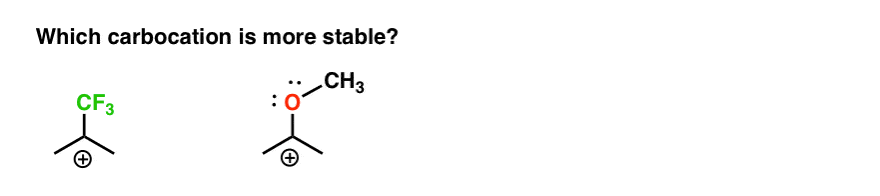
Se riesci a rispondere bene a questa domanda, sei la maggior parte della strada verso la comprensione della differenza tra orto-, para – e meta – direttori.
Esaminiamo due casi di studio. Esamineremo una generica reazione di sostituzione aromatica elettrofila del benzene con un orto -, para-direttore (metossibenzene) ed esamineremo gli intermedi che si ottengono dall’attacco alle posizioni orto, meta e para., Quindi eseguiremo lo stesso esercizio con un meta– regista (trifluorometilbenzene).
Nel processo, speriamo di capire perché methoxybenzene favorisce orto – e para– prodotti mentre trifluorometilbenzene favorisce il meta – prodotto.
Case Study #1: Un orto-,para – Director (OCH3)
La sostituzione elettrofila aromatica del metossibenzene tende a dare prodotti orto – e para con pochissimo meta -., Ecco cosa succede nella nitrazione, ad esempio:
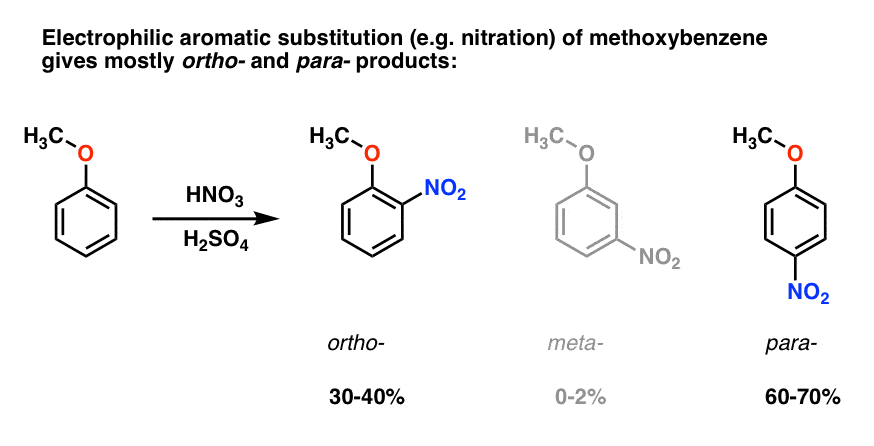
Il para – prodotto domina (60-70%), con ortho – close dietro (30-40%) e solo una traccia del meta– .
Perché?
3. Sì, l’ossigeno è elettronegativo. Ma la donazione della sua coppia solitaria più che compensa!
Ecco il percorso che porta al prodotto orto., Rompiamo un legame C-C pi e formiamo un nuovo legame C-E (dove E è destinato a rappresentare un elettrofilo generico), generando una carbocation stabilizzata dalla risonanza:
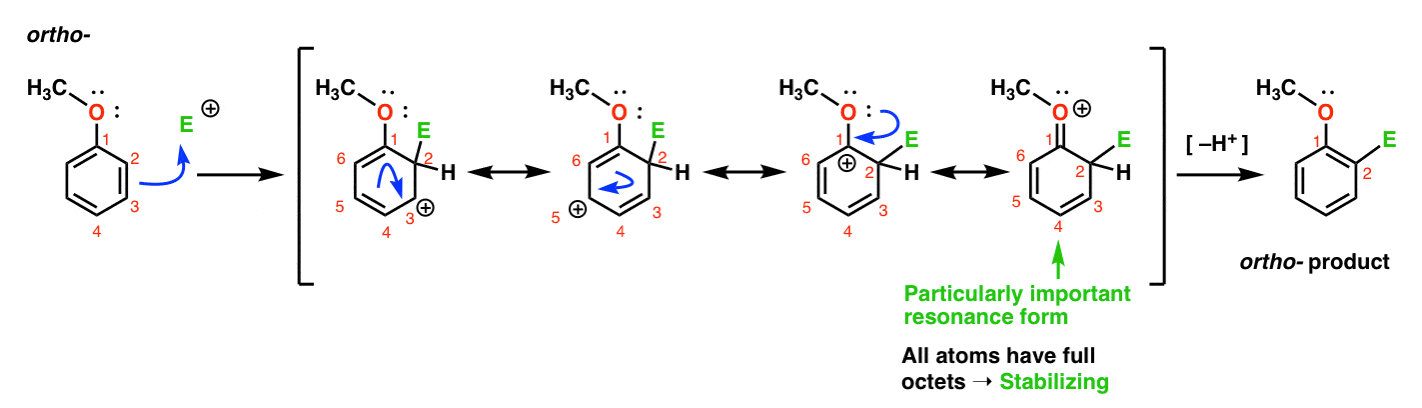
Se guardi da vicino, dovresti notare che possiamo formare quattro forme di risonanza . Tre di loro portano carbocazioni complete (su C1, C3 e C5), ma è la quarta – la forma di risonanza dove c’è un legame C=O pi – che è particolarmente importante. Perché? In questa forma di risonanza, tutti gli atomi di carbonio hanno un ottetto pieno di elettroni., Questo perché l’ossigeno direttamente legato all’anello può donare una coppia solitaria alla carbocation adiacente, formando un legame pi. Questo è un esempio di donazione pi.
Ecco il percorso per l’attacco dell’elettrofilo alla meta-posizione. Nota la differenza!
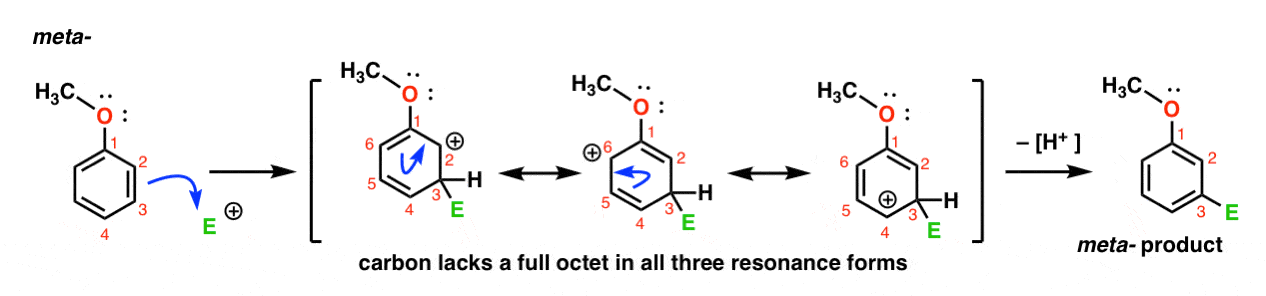
L’attacco dell’elettrofilo a C-3 provoca una carbocalizzazione che può essere delocalizzata tramite risonanza a C2, C4 e C6. Tuttavia, non c’è modo di “spostare” la carbocation su C1, il che significa che non esiste una forma di risonanza ragionevole in cui tutti gli atomi abbiano ottetti completi.,
Questo rende l’intermedio meta – carbocation molto meno stabile rispetto all’intermedio orto – carbocation.
Infine, ecco la reazione che porta al para – prodotto:
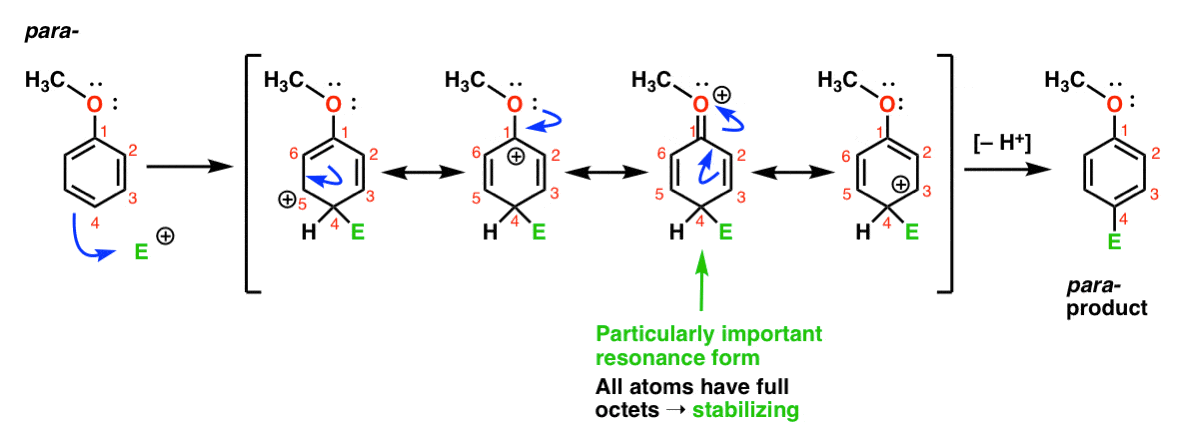
Qui possiamo ancora disegnare forme di risonanza con carbocazioni su C1, C3 e C5, così come una quarta forma di risonanza in cui l’atomo di ossigeno collegato dona una coppia di elettroni alla carbocazione su C1, risultando in un ottetto completo al carbonio. Questa è una situazione essenzialmente la stessa dell’orto – intermedio.,
Quindi, analizzando le forme di risonanza (e segna la mia parola, potresti essere chiesto di fare lo stesso su un test nel prossimo futuro) possiamo vedere che le carbocazioni intermedie risultanti dall’ortho – e para– addizione sono considerevolmente più stabili dell’intermedio dalla meta– addizione.
Questo spiega perché i prodotti orto e para dominano e il meta – prodotto è minore.
Potrebbe essere utile visualizzarlo disegnando un diagramma dell’energia di reazione.
4., Il diagramma dell’energia di reazione Per un direttore Orto Para
Lo stato di transizione che porta ai prodotti orto – e para – addizione è molto più basso in energia rispetto al meta– .
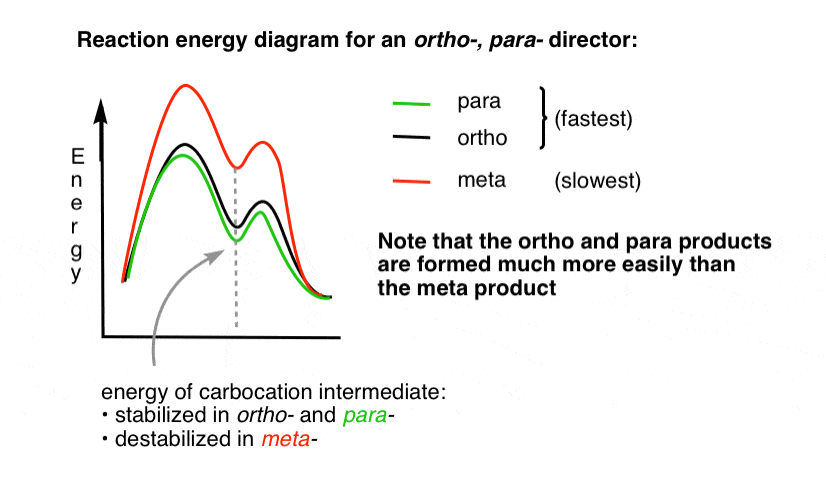
Una domanda: perché pensi che il para – potrebbe essere favorito (ad esempio 60% -70% di rendimento per il para – prodotto della nitrazione, sopra, contro il 30-40% per orto–) anche se ci sono due ortoposizioni e solo un para -?
Pensaci per un minuto e lo affronteremo di seguito.
5. Caso di studio #2: Un meta-direttore (CF3).
Quindi, per quanto riguarda CF3?, Perché dà meta – prodotti? Facciamo lo stesso tipo di analisi.
Ecco il percorso che porta al prodotto orto. Come per l’orto-intermedio sopra, possiamo disegnare tre forme di risonanza posizionando la carbocation su C1, C3 e C5, rispettivamente.
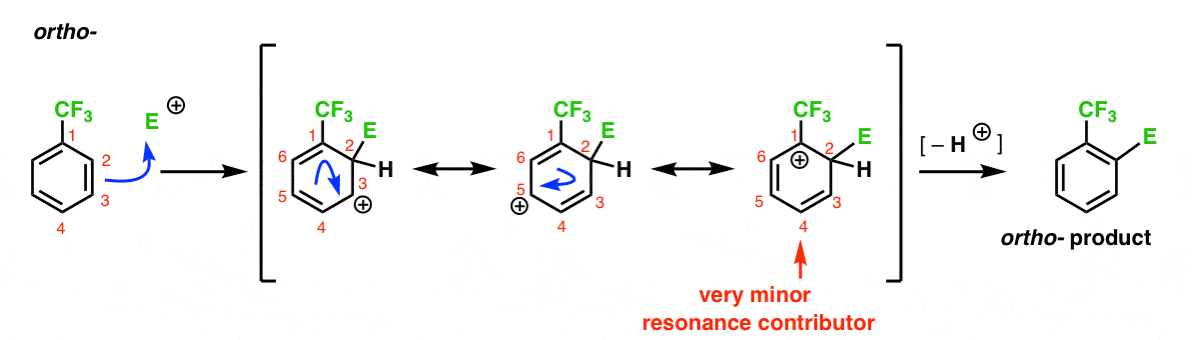
Quindi cosa c’è di diverso in questo caso?
Ciò che è diverso è la presenza di un forte gruppo di ritiro di elettroni (CF3) in C1, e questo cambia completamente il gioco della palla.
Come abbiamo detto, le carbocazioni sono destabilizzate dai vicini che ritirano la densità di elettroni., Pertanto ci aspetteremmo che questo sia un contributore di risonanza molto minore, con il risultato che la carica positiva viene delocalizzata solo su C3 e C5.
Abbiamo notato che CF3 è un meta-regista. È ragionevole pensare che ci sia qualcosa nel meta – che lo rende particolarmente stabile. Analizzando l’intermedio per il meta– prodotto qui sotto, puoi capire perché?
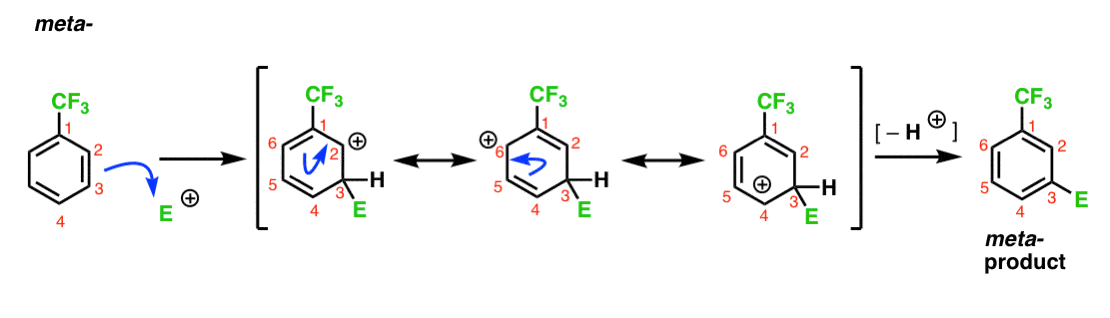
Hmmm. Non c’è intermedio dove un carbonio ha un ottetto pieno. Non ci sono forme di risonanza particolarmente stabili.
È una specie di “meh”, vero?
6., Quelli che chiamiamo ” meta-Direttori “Sono più simili a”orto-, para– Avoiders”
D’altra parte, non ci sono nemmeno forme di risonanza particolarmente instabili. Poiché la carica positiva è localizzata su C2, C4 e C6, viene evitata una situazione in cui la carica positiva è direttamente adiacente al gruppo CF3 che ritira l’elettrone. E la carica positiva viene quindi delocalizzata bene su tutto l’anello, a differenza della situazione ortopedia, sopra.
Quindi è un intermedio “meno cattivo” rispetto all’ortho-.,
Infine, il para – intermedio ha lo stesso problema dell’orto- ; un intermedio con una carica positiva su C1, adiacente al CF3.
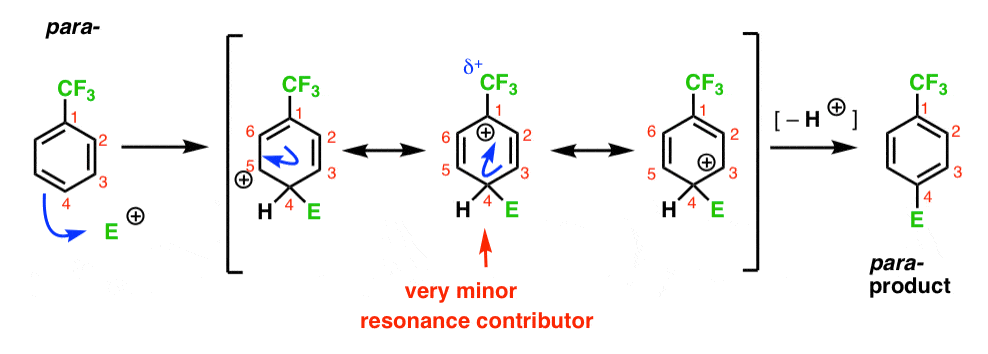
Ciò si traduce in solo due importanti forme di risonanza, che portano a un intermedio di carbocation meno delocalizzato (e quindi meno stabile).
Linea di fondo: l’intermedio di meta carbocation è più stabile dell’orto o dei para– intermedi.
Ma non è perché il sostituente stesso ha alcun effetto stabilizzante sul meta– intermedio. .,
Direi che è più utile pensare al meta – come meno instabile dell’orto – e del para– .
In questo modo, non è tanto che CF3 sia un meta – regista, tanto che è un “orto– , para– avoider. “
7. Il diagramma dell’energia di reazione per un meta-direttore
Ecco uno schizzo del diagramma dell’energia di reazione:
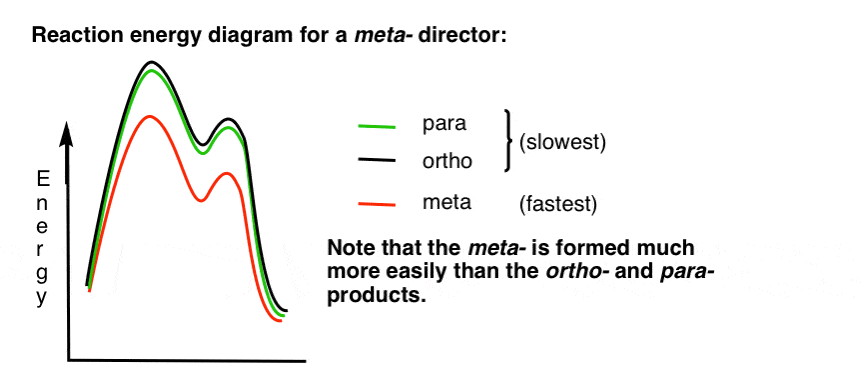
Va bene.
Torna alla nostra domanda originale. Quindi quale carbocation è più stabile?,
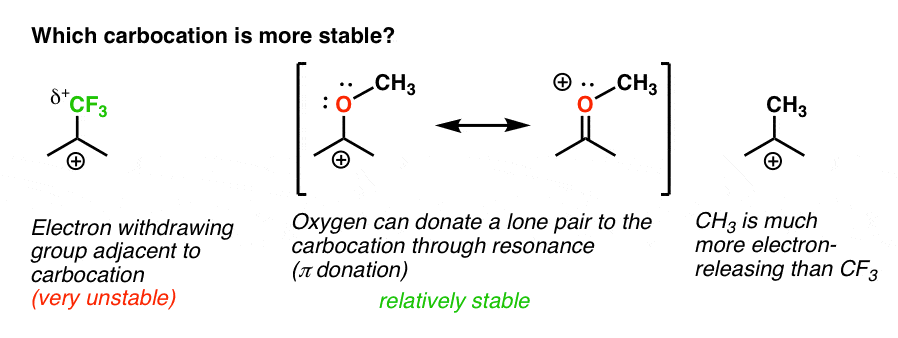
Chiaramente, la carbocation con un ossigeno adiacente che porta una coppia solitaria è molto più stabile di una carbocation adiacente a un gruppo di ritiro degli elettroni come CF3.
E che comprende la differenza tra un orto-, para – regista come OCH3 e un meta – regista come CF3.
Vale la pena notare che la maggior parte dei gruppi alchilici (come CH3 ) manca di una coppia solitaria, ma sono ancora orto-, para – direttori., Questo è coerente con tutto ciò che abbiamo imparato prima su come i gruppi alchilici si stanno generalmente stabilizzando per i carbocation-ricordiamo che la stabilità della carbocation generalmente aumenta con la sostituzione
Quindi su quei para-prodotti Why
Perché i para – prodotti sono prodotti ad un tasso maggiore di ortho- ?
La risposta è ostacolo sterico.
L’attacco alla posizione para è meno gravato dal sostituente rispetto all’attacco alle posizioni orto.
Allora perché gli alogeni sono Orto -, Para-Direttori?
Questo ci lascia con l’esempio un po ‘ complicato di alogeni.,
Perché fluoro, cloro, bromo e iodio sono orto -, para – direttori anche se stanno disattivando i gruppi?
La risposta non dovrebbe sorprendere se hai seguito, ma lasceremo questo fino al prossimo post, perché questo è già abbastanza lungo.
Prossimo post: Perché gli alogeni sono orto -, para-direttori?
Note
Nota 1. È più corretto dire che ortho – e para-prodotti dominano perché gli stati di transizione che portano a questi prodotti sono più bassi di energia, piuttosto che le energie degli intermedi stessi., Dopo tutto, è l’energia degli stati di transizione che determina la barriera di attivazione, e quindi la velocità di reazione.
Nota 2. O iperconiugazione, che la maggior parte dei libri di testo (con la notevole eccezione di Maitland Jones) generalmente evitano.
Quiz te stesso!,/div>
 fare Clic per Flip
fare Clic per Flip

 fare Clic per Flip
fare Clic per Flip 
 fare Clic per Flip
fare Clic per Flip 
 fare Clic per Flip
fare Clic per Flip 
(Avanzato) bibliografia
- A., F. Holleman, Die direkte Einführung von Substituten in den Benzolkern
Rec. Trav. Chim. Pays-Bas 1910, 12, 455-456
DOI: 10.1002/recl.19100291205
A. F Holleman da 1910 ha detto che l’orientamento orto–para è associato con l’attivazione e meta orientamento con disattivazione. - Alcune osservazioni riguardanti l’ostacolo sterico e gli effetti dei sostituenti sul rapporto orto : para nella sostituzione aromatica
P. B. D. de la Mare
J. Chem. Soc. 1949, 2871-2874
DOI: 10.1039/JR9490002871
In questo articolo, de la Mare discute vari fattori che possono spiegare una predominanza di para sulla selettività orto, dopo aver diviso la resa del prodotto orto per 2 (poiché ci sono 2 posizioni orto ma solo 1 posizione para in benzeni monosostituiti)., - Effetti di volume dei gruppi alchilici nei composti aromatici. Parte V. La monosolfonazione di p-cimene
R. J. W. Le Fèvre
J. Chem. Soc. 1934, 1501-1502
DOI: 10.1039 / JR9340001501
In p-cimene, il prodotto principale ottenuto sulla solfonazione elettrofila è il 2-prodotto (orto al gruppo metilico), probabilmente dovuto a sterics. - Effetti dei gruppi alchilici nelle aggiunte e sostituzioni elettrofile
COHN, H., HUGHES, E., JONES, M. e PEELING, MG
Nature 1952, 169, 291
DOI: 1038/169291a0
Questo articolo ha dati che confrontano la nitrazione di t-butilbenzene e toluene., Il T-butilbenzene è molto più p-directing del toluene (79,5% para per t-butilbenzene vs. 40% para per toluene), che è probabilmente dovuto a sterici (l’approccio orto è bloccato dal gruppo t-butilico più ingombrante). - Distribuzione degli isomeri nella mononitrazione di etil-e isopropilbenzene. Ulteriori prove per un effetto sterico nella distribuzione degli isomeri
Herbert C. Brown e W. Hallam Bonner
Journal of the American Chemical Society 1954, 76 (2), 605-606
DOI: 10.,1021 / ja01631a084
La tabella II in questo articolo illustra che il prodotto orto ottenuto dalla nitrazione dei monoalchilbenzeni diminuisce man mano che il gruppo alchilico aumenta (ad esempio il t-butilbenzene produce pochissimo prodotto orto dopo la nitrazione rispetto al toluene). - La reattività anomala del fluorobenzene nella sostituzione elettrofila aromatica e fenomeni correlati
Joel Rosenthal e David I., Schuster
Journal of Chemical Education 2003, 80 (6), 679
DOI: 1021/ed080p679
Un documento molto interessante, adatto a studenti curiosi, e discute qualcosa che la maggior parte dei chimici organici praticanti saprà empiricamente – il fluorobenzene è quasi reattivo come il benzene nelle reazioni EAS o Friedel-Crafts, che è controintuitivo quando si considerano gli effetti elettronici! - Chimica organica
N. Haworth, C. K. Ingold, T. A. Henry
Ann. Rep. Prog. Chimica. 1926, 23, 74-185
DOI: 10.1039/AR9262300074
Un documento iniziale che discute gli effetti di regia in EA. Pp., 136 e 137 contengono figure che raffigurano il flusso di elettroni. P.g. 140 discute meta-direzione, che si verifica per le ragioni ‘opposte’ come o / p-direzione da gruppi alchilici.
i — – La natura dell’effetto alternato nelle catene di carbonio. Parte XXIII. Orientamento anomalo da alogeni,e la sua incidenza sul problema del rapporto orto-para, in sostituzione aromatica
Christopher Kelk Ingold e Charles Cyril Norrey Vass
J. Chem. Soc. 1928, 417-425
DOI: 10.,1039 / JR9280000417
Questo documento discute dirigere effetti in 1,2-dihalobenzenes.
i — – La natura dell’effetto alternato nelle catene di carbonio. Parte XXII. Un tentativo di definire ulteriormente il probabile meccanismo di orientamento nella sostituzione aromatica
Christopher Kelk Ingold e Florence Ruth Shaw
J. Chem. Soc. 1927, 2918-2926
DOI: 10.,1039 / JR9270002918
Un primo articolo dell’influente chimico organico fisico, Prof. CK Ingold, affermando che gli alogenobenzeni sono induttivamente ritirati dagli elettroni ma contemporaneamente stabilizzanti la risonanza.