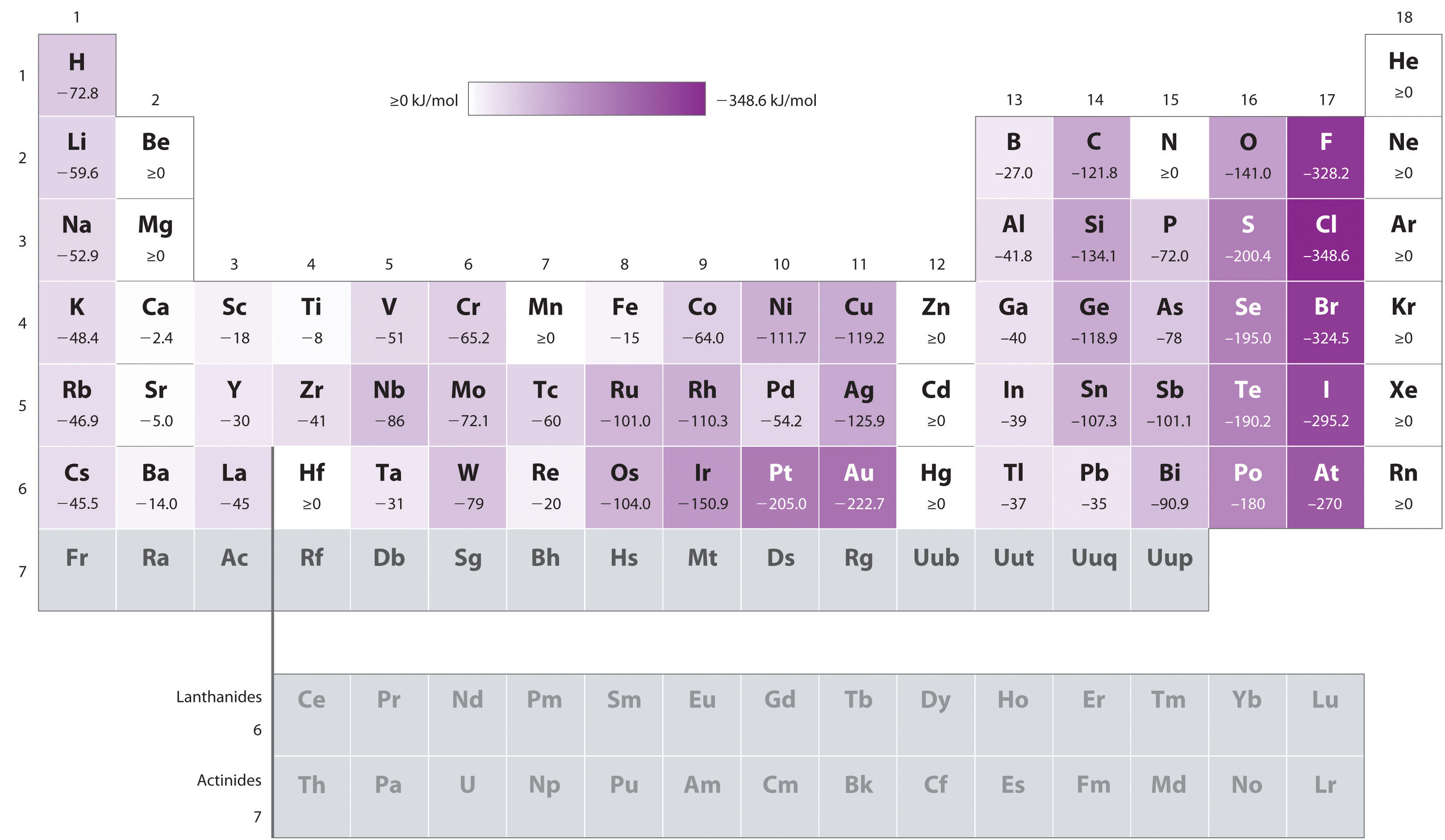
Atomer med den største radier, som har den laveste ionisering energier (affinitet for sin egen valence elektroner), har også de laveste affinitet for en ekstra elektron. Det er imidlertid to viktige unntak fra denne trenden:
- elektronet slektskap elementer B til F i den andre raden av den periodiske tabellen er mindre negativ enn de av elementene umiddelbart under dem i tredje rad., Angivelig, økt elektron–elektron repulsions oppleves av elektroner begrenset til relativt små 2p orbitals overvinne den økte elektron–kjernen attraksjon på kort kjernefysiske avstander. Fluor har derfor en lavere affinitet for en ekstra elektron enn klor. Derfor elementer av den tredje raden (n = 3) har den mest negative electron slektskap. Lenger ned en kolonne, attraksjon for en ekstra elektron reduseres fordi elektron går inn i en orbital mer fjernt fra kjernen., Elektron–elektron repulsions også redusere fordi valence elektroner okkupere et større volum av plass. Disse effektene har en tendens til å avbryte hverandre, slik at endringene i electron tilhørighet i en familie er mye mindre enn endringene i ionisering energi.
- elektronet slektskap av alkalisk jord metaller bli mer negativt fra Være til Ba. Energi avstanden mellom fylt ns2 og tom np subshells avtar med økende n, slik at dannelsen av et anion fra tyngre grunnstoffer blir energisk mer gunstig.,
ligningene for andre og høyere electron slektskap er analoge til de andre og høyere ionisering energier:
\
\
Som vi har sett, den første elektron affinitet kan være større enn eller lik null eller negativ, avhengig av elektron konfigurasjonen av atom. I kontrast, den andre elektron affinitet er alltid positiv, fordi den økte elektron–elektron repulsions i en dianion er langt større enn den attraksjonen av kjernen for ekstra elektroner., For eksempel, den første elektron affinitet for oksygen er -141 kJ/mol, men den andre elektron affinitet +744 kJ/mol:
\
\
Dermed dannelsen av en gassformig nitrogenoksid (\(O^{2−}\)) ion er energisk ganske ugunstige (beregnet ved å legge begge trinn):
\
Mens første elektron slektskap kan være negative, positive eller null, andre electron slektskap er alltid positiv.,
Hvis energi er nødvendig for å danne både positivt ladet kationer og monatomic polyanions, hvorfor ioniske forbindelser som \(MgO\), \(Na_2S\), og \(Na_3P\) form i det hele tatt? Den avgjørende faktor i dannelsen av stabil ioniske forbindelser er gunstig elektrostatiske interaksjoner mellom kationer og anioner i krystallinsk salt.
Eksempel \(\PageIndex{1}\): Kontrasterende Electron Slektskap Sb, Se og Te
Basert på deres plassering i det periodiske system, som Sb, Se eller Te vil du forutsi å ha den mest negative electron tilhørighet?,
Gitt: tre elementer
Bedt om: element med mest negative electron affinitet
Strategi:
- Finn elementene i det periodiske system. Bruk trender i electron slektskap går ned i en kolonne for elementer i den samme gruppen. På samme måte, bruke trender i electron slektskap fra venstre til høyre for elementer i samme rad.
- Plassere elementene i rekkefølge, oppføring element med de mest negative electron affinitet første.,
Løsning:
Vi vet at electron slektskap bli mindre negativ går ned i en kolonne (bortsett fra anomalously lave electron slektskap av elementene i den andre raden), så vi kan forutsi at elektronet affinitet av Se er mer negative enn Te. Vi vet også at electron slektskap bli mer negativt fra venstre til høyre over en rad, og at gruppen 15 elementer tendens til å ha verdier som er mindre negativ enn forventet., Fordi Sb er plassert til venstre for Te og hører til gruppe 15, vi spår at elektronet affinitet av Te er mer negative enn at Sb. Den samlede ordren Se < Te < Sb, så Se har de mest negative electron tilhørighet blant de tre elementene.