Første du trenger å vite antall av valence elektroner. Du kan gjøre dette ved å (1) tegning av den electron-konfigurasjonen per element, eller (2) å rådføre deg med periodiske tabellen.,
Hvis du valgte å trekke den electron-konfigurasjonen per element, vil du ha noe som dette:
#N# (atomnummer = 7) : #1^2# #farge (rød) (2s^2)# #farge (rød) (2p^3)# (5 ytterste elektroner)
#O# (atomnummer = 8) : #1^2# #farge (rød) (2s^2)# #farge (rød) (2p^4)# (6 ytterste elektroner)
Hvis du velger å ta kontakt med din periodiske tabellen, bare legg merke til at #N# tilhører Gruppe 5A mens #O# tilhører Gruppen 6A. Gruppen tallet angir antall ytterste elektroner.,
Nå som du kjenner nummeret av valence elektroner per element, må du beregne den totale valence elektroner for #NO_3^»-1″# ion.
5 + (3 x 6) = 23 elektroner
Men siden hele molekylet har en -1 lade, må du legge til denne også. Så det totale antall av valence elektroner er 24.
Den neste tingen å gjøre er å tegne. Normalt er det første elementet i den kjemiske formelen er den sentrale atom. I dette tilfellet, #N# atom er å være omgitt av tre #O# atomer.,
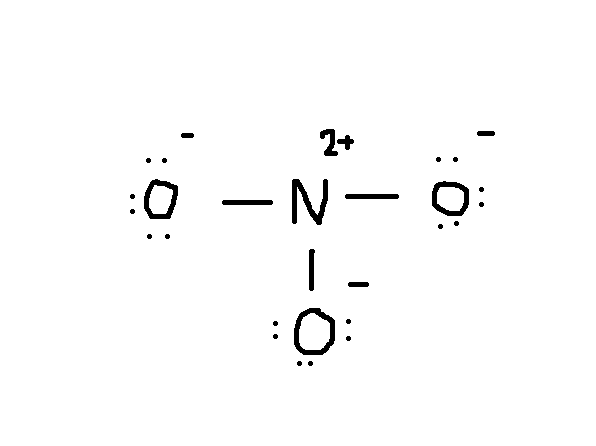
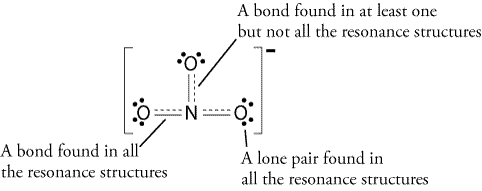
legg Merke til at lone par av elektroner fra #O# er også inkludert i diagrammet. Hvis du telle det totale antallet elektroner på over tegningen, det er allerede 24 elektroner (én linje teller som 2 elektroner). Men denne tegningen har brutt octet regelen siden den sentrale atom bare har 6 elektroner i stedet for det korrekte tallet 8. Så hva skal du gjøre?
Legg til en annen bond, men hvor?,
Derfor, resonans struktur ville se ut som dette: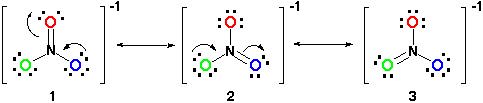
Alle resonans strukturer er riktig siden det alle følger octet-regelen og alle har et totalt antall av 24 elektroner. Bare ta oppmerksom på at den eneste bond beveger seg er pi (#pi#) obligasjonslån eller i lekmann sikt, dobbeltbindingen og en av de electron par fra #O# atom.