Mål
- Sammenlign punkt mutasjoner og frameshift mutasjoner
- Beskrive forskjellene mellom missense, tull, og stille mutasjoner
- Beskrive forskjellene mellom lys og mørke reparasjon
- Forklare hvordan ulike mutagens handle
- Forklar hvorfor Ames-test kan brukes til å oppdage kreftfremkallende stoffer
- Analyser, som er sekvenser av DNA og identifisere eksempler på typer av mutasjoner
En mutasjon er en heritable endring i DNA-sekvensen til en organisme., Den resulterende organisme, som kalles en mutant, kan ha en gjenkjennelig endring i fenotypen i forhold til wild-type, som er fenotypen oftest observert i naturen. En endring i DNA-sekvensen er overdratt til mRNA gjennom transkripsjon, og kan føre til en endret aminosyre-sekvensen i et protein på oversettelsen. Fordi proteiner utfører de aller fleste av cellulære funksjoner, en endring i aminosyre-sekvensen i et protein kan føre til en endret fenotypen for celle-og organisme.,
Virkninger av Mutasjoner på DNA-Sekvens
Det finnes flere typer av mutasjoner som er klassifisert i henhold til hvordan DNA-molekylet er endret. Den ene typen, kalt et punkt mutasjon, påvirker en enkelt base og oppstår som oftest når en base byttes eller erstattes av en annen. Mutasjoner også være et resultat av tillegg av ett eller flere baser, som er kjent som en innsetting eller fjerning av en eller flere baser, kjent som en sletting.
Tenk på Det
- Hva type av en mutasjon oppstår når et gen har to færre nukleotider i sin sekvens?,
Virkninger av Mutasjoner på Protein Struktur og Funksjon
Punkt mutasjoner kan ha en rekke virkninger på protein funksjon (Figur 1). Som en konsekvens av degenererthet av den genetiske koden, et punkt mutasjon vil ofte resultere i den samme aminosyre blir innlemmet i den resulterende polypeptid på tross av den sekvensen du vil endre. Denne endringen vil ikke ha noen effekt på protein s struktur, og er derfor kalt en stille mutasjon. En missense mutasjon resultater i en annen aminosyre blir innlemmet i den resulterende polypeptid., Effekten av en missense mutasjon avhenger av hvor kjemisk forskjellige ny aminosyre er fra wild-type aminosyre. Plasseringen av endret aminosyre i proteinet er også viktig. For eksempel, hvis endret aminosyre er en del av enzymet er aktivt området, så effekten av missense mutasjon kan være betydelig. Mange missense mutasjoner resulterer i proteiner som fortsatt er funksjonell, i hvert fall til en viss grad. Noen ganger effekten av missense mutasjoner kan være bare tilsynelatende under visse miljøforhold, slik missense mutasjoner er kalt betinget mutasjoner., Sjelden, et missense mutasjon kan være gunstig. Under de rette forholdene, denne type mutasjon kan gi organismen som havner det en selektiv fordel. Ennå en annen type punkt mutasjon, som kalles en nonsense mutasjon, konverterer et codon koding en aminosyre (en følelse codon) til en stopp codon (en tull codon). Tull mutasjoner resulterer i syntese av proteiner som er kortere enn vill-type og vanligvis ikke i bruk.
Sletting og innsetting også gi ulike virkninger., Fordi codons er trillinger av nukleotider, innsetting eller sletting i grupper på tre nukleotider kan føre til innsetting eller sletting av en eller flere aminosyrer og kan ikke føre til betydelige effekter på den resulterende protein funksjonalitet. Imidlertid, frameshift mutasjoner, forårsaket ved innsetting eller sletting av en rekke nukleotider som ikke er et multiplum av tre er svært problematisk fordi en endring i lesing ramme resultater (Figur 1). Fordi ribosomes les mRNA i trilling codons, frameshift mutasjoner kan endre seg hver aminosyre etter punktet av mutasjon., Den nye lesing kan det hende at rammen inkluderer også en stopp codon før slutten av den kodende sekvensen. Følgelig, proteiner laget av gener som inneholder frameshift mutasjoner er nesten alltid formålsløse.
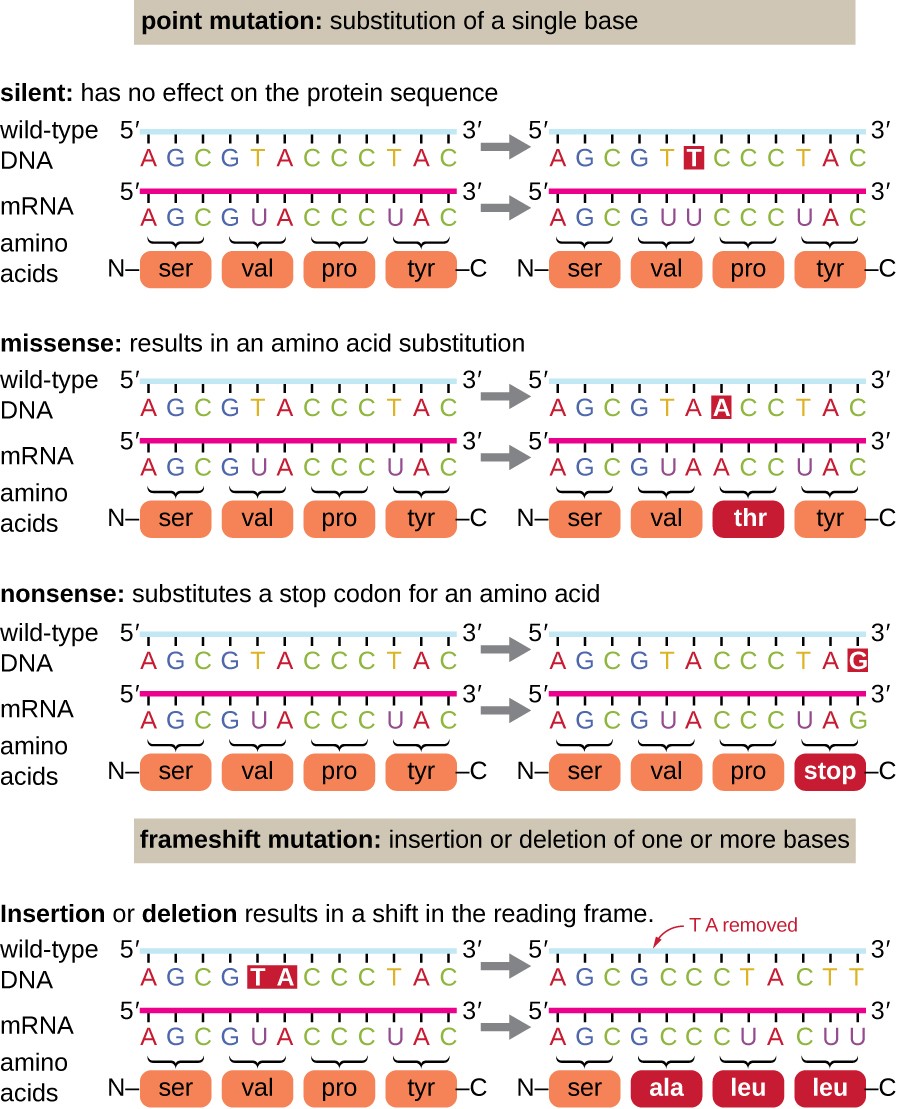
Figur 1. Klikk for større bilde. Mutasjoner kan føre til endringer i protein sekvens er kodet av DNA.
Tenk på Det
- Hva er grunnene til at en nukleotid endring i et gen for et protein som kanskje ikke har noen effekt på fenotypen av at genet?,
- Er det mulig for en innsetting av tre nukleotider sammen etter den femte nukleotid i en protein-kodende gener for å produsere et protein som er kortere enn normalt? Hvordan eller hvor det ikke?
En Gunstig Mutasjon
Siden det første tilfellet av infeksjon med humant immunsviktvirus (HIV) som ble rapportert i 1981, nesten 40 millioner mennesker har dødd av HIV, viruset som forårsaker ervervet immunsvikt syndrom (AIDS)., Viruset mål hjelper T-celler som spiller en sentral rolle i å bygge bro mellom det medfødte og det adaptive immunforsvaret, infisere og drepe celler som normalt er involvert i kroppens svar på infeksjoner. Det er ingen kur for HIV-smitte, men mange stoffer har blitt utviklet for å redusere eller blokkere utviklingen av virus. Selv om enkeltpersoner over hele verden, kan bli infisert, den høyeste prevalensen blant folk 15-49 år er i Afrika sør for Sahara, der nesten en person i 20-en er infisert, sto for mer enn 70% av infeksjonene verden over (Figur 2)., Dessverre, dette er også en del av verden hvor forebyggende strategier og legemidler til behandling av infeksjon er den mest mangler.

Figur 2. HIV er utbredt i Afrika sør for Sahara, men dens utbredelse er ganske lav i enkelte andre deler av verden.
I de siste årene, vitenskapelig interesse har blitt pirret av oppdagelsen av et fåtall personer fra nord-Europa som er resistente mot HIV-smitte. I 1998, American genetiker Stephen J., O ‘ Brien ved National Institutes of Health (NIH) og kolleger publiserte resultatene av sin genetiske analyser av mer enn 4000 personer. Disse viste at mange individer av Asiatisk avstamning (opp til 14% i noen etniske grupper) har en sletting mutasjon, kalt CCR5-delta 32, i genkode CCR5. CCR5 er en coreceptor funnet på overflaten av T-celler som er nødvendig for mange stammer av viruset å angi verts-cellen. Mutasjonen fører til produksjon av en reseptor som HIV kan ikke effektivt å binde og dermed blokkerer viral oppføring., Folk homozygote for denne mutasjonen har sterkt redusert risiko for HIV-infeksjon, og de som er heterozygote har noen beskyttelse mot infeksjon i tillegg.
Det er ikke klart hvorfor mennesker av nord-Europeisk herkomst, spesielt, bærer denne mutasjonen, men dens utbredelse synes å være størst i nord-Europa, og stadig nedgang i bestander som man beveger seg sørover. Forskning viser at mutasjonen har vært til stede siden før HIV dukket opp, og kan ha blitt valgt i den Europeiske populasjoner som et resultat av eksponering til plage eller kopper., Denne mutasjonen kan beskytte individer fra pesten (forårsaket av bakterien Yersinia pestis) og kopper (forårsaket av variola virus) fordi denne reseptoren kan også være involvert i disse sykdommer. Alder av denne mutasjonen er en del av debatten, men anslag tyder på at det dukket opp mellom 1875 år til 225 år siden, og kan ha blitt spredt fra Nord-Europa gjennom Viking invasjoner.
Denne spennende å finne på, har ført til nye muligheter i HIV-forskning, inkludert jakt etter stoff til å blokkere CCR5 binding til HIV i personer som mangler mutasjon., Selv om DNA-testing for å finne ut hvilke individer som bærer CCR5-delta 32 mutasjonen er mulig, det er dokumentert tilfeller av personer homozygote for mutasjonen å pådra seg HIV. For denne grunn, DNA-testing for mutasjon er ikke mye som er anbefalt av offentlige helsemyndigheter, slik som å ikke oppmuntre til risikofylt atferd, i de som bærer mutasjonen. Likevel, å hemme bindingen av HIV til CCR5 fortsetter å være en gyldig strategi for utvikling av stoffet terapi for de som blir smittet med HIV.,
Årsakene til Mutasjoner
Feil i prosessen av DNA replikering kan forårsake spontane mutasjoner oppstår. Feilraten av DNA-polymerase er en feil base per milliard base par replikert. Eksponering for mutagens kan føre til induserte mutasjoner, som er ulike typer av kjemiske midler, eller stråling (Tabell 1). Eksponering for en mutagen kan øke frekvensen av mutasjon mer enn 1000-brett. Mutagens er ofte også kreftfremkallende stoffer, legemidler som kan forårsake kreft. Imidlertid, mens nesten alle kreftfremkallende stoffer er mutagene, ikke alle mutagens er nødvendigvis kreftfremkallende stoffer.,
| Tabell 1., to AT base pair | Point | |||
|---|---|---|---|---|
| Intercalating agents | ||||
| Acridine orange, ethidium bromide, polycyclic aromatic hydrocarbons | Distorts double helix, creates unusual spacing between nucleotides | Introduces small deletions and insertions | Frameshift | |
| Ionizing radiation | ||||
| X-rays, γ-rays | Forms hydroxyl radicals | Causes single- and double-strand DNA breaks | Repair mechanisms may introduce mutations | |
| X-rays, γ-rays | Modifies bases (e.,g., deaminating C-U) | Konverterer GC til PÅ base par | Punkt | |
| Nonionizing radiation | ||||
| Ultrafiolett | Skjemaer pyrimidin (vanligvis innhold av tymin) dimers | Fører til DNA-replikasjon feil | Frameshift eller punkt | |
Kjemisk Mutagens
Ulike typer kjemiske mutagens samhandle direkte med DNA-enten ved å opptre som nucleoside analogs eller ved å endre nukleotid baser., Kjemikalier kalles nucleoside analogs er strukturelt lik normal nukleotid baser og kan bli innarbeidet i DNA under replikasjon (Figur 3). Disse base analogs forårsake mutasjoner fordi de ofte har forskjellige base-sammenkobling regler enn baser de erstatter. Andre kjemiske mutagens kan endre normal DNA-baser, noe som resulterer i ulike base-sammenkobling regler. For eksempel, lystgass syre deaminates cytosine, konvertere den til uracil. Uracil deretter par med adenine i en påfølgende runde med replikering, noe som resulterer i konvertering av GC-base-par til en base blir VED et par., Lystgass acid også deaminates adenine å hypoxanthine, som base par med cytosine i stedet for innhold av tymin, noe som resulterer i konvertering av en TA utgangspunkt par til en CG base-par.

Figur 3. Klikk for større bilde. (a) 2-aminopurine nucleoside (2AP) strukturelt er en nucleoside analog til adenine nucleoside, mens 5-bromouracil (5BU) er en nucleoside analog til innhold av tymin nucleoside. 2AP base par med C, konvertere en base blir VED et par til en GC-base-par etter flere runder med replikering., 5BU par med G, konvertere en base blir VED et par til en GC-base-par etter flere runder med replikering. (b) Lystgass syre er en annen type kjemiske mutagen som endrer allerede eksisterende nucleoside baser som C for å produsere U, som base par med A. Dette kjemisk modifikasjon, som vist her, resultater i å konvertere en CG base par til a TA base-par.
Kjemisk mutagens kjent som intercalating agenter jobber annerledes., Disse molekylene skyv mellom stablet nitrogenholdige baser i DNA-dobbel helix, forvrenge molekyl og skape atypisk avstanden mellom nukleotid base-par (Figur 4). Som et resultat, under DNA replikasjon, DNA polymerase kan enten hoppe over kopiere flere nukleotider (opprette en sletting), eller sette inn ekstra nukleotider (opprette en innsetting). Enten utfallet kan føre til en frameshift mutasjon. Forbrenning produkter som polysykliske aromatiske hydrokarboner er spesielt farlig intercalating agenter som kan føre til mutasjon-forårsaket kreft., Den intercalating agenter etidiumbromid og acridine oransje er vanligvis brukes i laboratoriet til å flekken DNA for visualisering og er potensielle mutagens.

Figur 4. Intercalating agenter, for eksempel acridine, introdusere atypisk avstanden mellom base-par, noe som resulterer i DNA polymerase å innføre enten en sletting eller en innsetting, som fører til en potensiell frameshift mutasjon.
Stråling
Eksponering for enten ioniserende eller nonionizing radiation kan forårsake mutasjoner i DNA, selv om det av ulike mekanismer., Sterk ioniserende stråling som røntgen og gamma-stråler kan føre enkel – og dobbel-strandet brudd i DNA-ryggraden gjennom dannelsen av hydroksyl-radikaler på stråling (Figur 5). Ioniserende stråling kan også endre baser, for eksempel deamination av cytosine til uracil, analogt til virkningen av lystgass syre. Ioniserende stråling er brukt til å drepe mikrober til å sterilisere medisinsk utstyr og mat, på grunn av sin dramatiske uspesifikk effekt i å skade DNA, proteiner og andre cellulære komponenter (se Bruke Fysiske Metoder for å Kontrollere Mikroorganismer).,
Nonionizing radiation, som ultrafiolett lys, er ikke sprek nok til å starte disse typer kjemiske endringer. Imidlertid, nonionizing radiation kan indusere dimer dannelse mellom to tilstøtende pyrimidin baser, vanligvis to thymines, innen en nukleotid strand. I løpet av innhold av tymin dimer dannelse, to tilstøtende thymines bli kovalent bundet og, hvis venstre ureparert, både DNA replikasjon og transkripsjon er stoppet opp på dette punktet. DNA-polymerase kan gå videre og gjenskape dimer feil, potensielt fører til frameshift eller mutasjoner.,

Figur 5. (en) Ioniserende stråling kan føre til dannelse av enkelt-strandet og dobbel-strandet pauser i sukker-fosfat ryggraden i DNA, så vel som modifisering av baser (ikke vist). (b) Nonionizing radiation som ultrafiolett lys kan føre til dannelse av innhold av tymin dimers, som kan stall replikasjon og transkripsjon og introdusere frameshift eller mutasjoner.
Tenk på Det
- Hvordan virker en base analog innføre en mutasjon?,
- Hvordan gjør en intercalating agent innføre en mutasjon?
- Hva slags mutagen årsaker innhold av tymin dimers?
DNA-Reparasjon
prosessen av DNA replikering er svært nøyaktig, men feil kan oppstå spontant eller være forårsaket av mutagens. Ukorrigerte feil kan føre til alvorlige konsekvenser for fenotypen. Cellene har utviklet flere reparasjon mekanismer for å redusere antall mutasjoner som vedvarer.,
Korrektur
de Fleste av feilene innført under DNA-replikasjon er raskt korrigert av de fleste DNA polymerases gjennom en funksjon kalt korrektur. I korrekturlesing, DNA polymerase leser nylig lagt til base, og sikre at den er komplementær til den korresponderende base i malen strand før du legger den neste. Hvis en feil base har blitt lagt til, enzym gjør et kutt for å frigjøre feil nukleotid, og en ny base er lagt til.,
Mismatch Repair
Noen feil introdusert i løpet replikering er korrigert kort tid etter replikering maskiner har flyttet på seg. Denne mekanismen kalles mismatch repair. Enzymer involvert i denne mekanismen gjenkjenne feilaktig lagt nukleotid, særavgifter det, og erstatte den med den riktige base. Et eksempel er methyl-anvist mismatch repair i E. coli. DNA er hemimethylated. Dette betyr at foreldrenes strand er denaturert mens den nylig syntetisert datter strand er det ikke. Det tar flere minutter før den nye strand er denaturert., Proteiner MutS, MutL, og MutH binder seg til hemimethylated stedet hvor feil nukleotid er funnet. MutH kutter nonmethylated strand (den nye strand). En exonuclease fjerner en del av strand (inkludert feil nukleotid). Gapet dannet er så fylt opp av DNA pol III og ligase.
Reparasjon av innhold av tymin Dimers
Fordi produksjonen av innhold av tymin dimers er vanlig (mange organismer ikke kan unngå ultrafiolett lys), mekanismer har utviklet seg til å reparere disse lesjonene., I nukleotid eksisjon reparasjon (også kalt mørk repair), enzymer fjerne pyrimidin dimer og erstatte den med den riktige nukleotider (Figur 6). I E. coli, DNA er skannet ved hjelp av et enzym komplekse. Hvis en forvrengning i dobbel helix er funnet som ble introdusert av pyrimidin dimer, den enzym komplekse kutt sukker-fosfat ryggraden flere baser oppstrøms og nedstrøms av dimer, og den delen av DNA mellom disse to kutt er så enzymatically fjernet. DNA pol jeg erstatter den manglende nukleotider med riktig kjære og DNA ligase sel gapet i sukker-fosfat ryggraden.,
Den direkte reparasjon (også kalt lys reparasjon) av innhold av tymin dimers oppstår gjennom prosessen med photoreactivation i nærvær av synlig lys. Et enzym kalt photolyase gjenkjenner forvrengning i DNA-spiral som skyldes innhold av tymin dimer og binder seg til dimer. Deretter, i nærvær av synlig lys, photolyase enzym endringer konformasjon og pauser fra hverandre innhold av tymin dimer, slik at den thymines til igjen på korrekt måte base par med adenines på komplementære strand., Photoreactivation ser ut til å være til stede i alle organismer, med unntak av placental pattedyr, inkludert mennesker. Photoreactivation er spesielt viktig for organismer kronisk utsettes for ultrafiolett stråling, som planter, fotosyntetiske bakterier, alger og koraller, for å hindre akkumulering av mutasjoner forårsaket av innhold av tymin dimer dannelse.

Figur 6. Klikk for større bilde. Bakterier har to mekanismer for reparasjon av innhold av tymin dimers., (en) I nukleotid eksisjon reparasjon, et enzym komplekse gjenkjenner forvrengning i DNA komplekse rundt innhold av tymin dimer og kutter og fjerner skadet DNA-strand. Riktig nukleotider er erstattet av DNA pol jeg og nukleotid strand er forseglet av DNA-ligase. (b) I photoreactivation, enzymet photolyase binder seg til innhold av tymin dimer, og i nærvær av synlig lys, pauser fra hverandre dimer, gjenopprette base sammenkobling av thymines med utfyllende adenines på motsatt DNA-strand.,
Tenk på Det
- Under mismatch repair, hvordan enzymet gjenkjenne som er nye og som er den gamle strand?
- Hvordan gjør en intercalating agent innføre en mutasjon?
- Hva slags mutasjon gjør photolyase reparasjon?
Identifisere Bakteriell Mutanter
En vanlig teknikk som brukes til å identifisere bakteriell mutanter er kalt replika plating., Denne teknikken er brukt til å oppdage ernæringsmessige mutanter, kalt auxotrophs, som har en mutasjon i et gen koding av et enzym i biosyntese veien til et bestemt næringsstoff, slik som en aminosyre. Som et resultat, mens wild-type celler beholde evnen til å vokse normalt på et medium som mangler spesifikke næringsstoffer, auxotrophs er ute av stand til å vokse på et slikt medium. Under replika plating (Figur 7), og en bestand av bakterielle celler er mutagenized og deretter belagt som individuelle celler på en kompleks ernæringsmessig komplett plate, og fikk lov til å vokse inn i koloniene., Celler fra disse koloniene er fjernet fra denne master-plate, ofte ved bruk av sterile fløyel. Dette fløyel, som inneholder celler, er så inne i den samme retningen på plater av ulike medier. Minst en plate bør også være ernæringsmessig komplett for å sikre at cellene blir riktig overført mellom platene. De andre platene mangel spesifikke næringsstoffer, slik at forskeren til å oppdage ulike auxotrophic mutanter i stand til å produsere spesifikke næringsstoffer. Celler fra samme koloni på den ernæringsmessig komplett plate kan brukes til å gjenopprette mutant for videre studier.,

Figur 7. Identifisering av auxotrophic mutanter, som histidin auxotrophs, er gjort ved hjelp av replika plating. Etter mutagenesis, kolonier som vokser på ernæringsmessig komplett medium, men ikke på middels mangler histidin er identifisert som histidin auxotrophs.
Tenk på Det
- Hvorfor er celler belagt på et ernæringsmessig komplett plate i tillegg til nærings-defekte plater når du leter etter en mutant?,
Ames-Test
Ames test, som er utviklet av Bruce Ames (1928–) på 1970-tallet, er en metode som bruker bakterier for rask, billig screening av kreftfremkallende potensial av nye kjemiske forbindelser. Testen måler mutasjon pris forbundet med eksponering til det sammensatte, som, hvis forhøyet, kan tyde på at eksponering for denne forbindelsen er forbundet med større risiko for lungekreft., Ames test bruker som test organismen en stamme av Salmonella typhimurium, som er en histidin auxotroph, ute av stand til å syntetisere sine egne histidin på grunn av en mutasjon i et viktig gen som er nødvendig for syntese. Etter eksponering for en potensiell mutagen, disse bakteriene er belagt på en middels mangler histidin, og antall mutanter å gjenvinne evnen til å syntetisere histidin er registrert og sammenlignet med antallet av slike mutanter som oppstår i fravær av potensielle mutagen (Figur 8)., Kjemikalier som er mer mutagene vil få flere mutanter med restaurert histidin syntese i Ames-test. Fordi mange kjemikalier er ikke direkte mutagene men metaboliseres til mutagene former av leverenzymer, rotte leveren ekstrakt er vanligvis inkludert i starten av dette eksperimentet for å etterligne levermetabolisme. Etter Ames-test er gjennomført, stoffer som er identifisert som mutagene er videre testet for deres potensielle kreftfremkallende egenskaper ved hjelp av andre modeller, inkludert dyr modeller som mus og rotter.
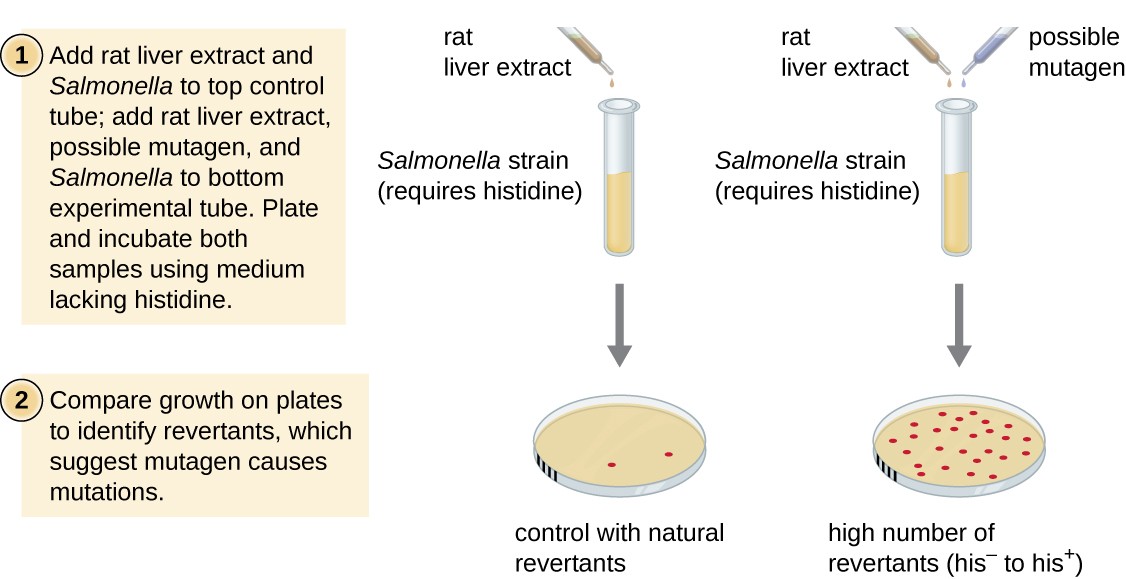
Figur 8., Ames test er brukt for å identifisere mutagene, potensielt kreftfremkallende kjemikalier. En Salmonella histidin auxotroph brukes som test belastning, utsatt for en potensiell mutagen/kreftfremkallende. Antall hjemfall mutanter i stand til å vokse i fravær av medfølgende histidin telles og sammenlignes med antall naturlige hjemfall mutanter som oppstår i fravær av potensielle mutagen.
Tenk på Det
- Hva mutasjon er brukt som en indikator på mutasjon pris i Ames-test?
- Hvorfor kan Ames test fungere som en test for kreftfremkallende?,
sentrale Begreper og Oppsummering
- En mutasjon er en heritable endring i DNA. En mutasjon kan føre til en endring i amino-syre sekvens av et protein, muligens påvirker dens funksjon.
- Et punkt mutasjonen påvirker en enkelt base-par. Et punkt mutasjon kan føre til en stille mutasjon hvis mRNA codon koder for samme aminosyre, en missense mutasjon hvis mRNA codon koder for en annen aminosyre, eller en nonsense mutasjon hvis mRNA codon blir en stopp codon.,
- Missense mutasjoner kan beholde funksjon, avhengig av kjemi ny aminosyre og dens beliggenhet i protein. Tull mutasjoner produsere avkortet og ofte ikke-proteiner.
- En frameshift mutasjon resultater fra en innsetting eller sletting av en rekke nukleotider som ikke er et multiplum av tre. Endringen i lesing ramme endrer hver aminosyre etter punktet av mutasjon og resulterer i en ikke-protein.
- Spontane mutasjoner oppstår gjennom DNA-replikasjon feil, mens induserte mutasjoner oppstår gjennom eksponering til en mutagen.,
- Mutagene stoffer er ofte kreftfremkallende, men ikke alltid. Men nesten alle kreftfremkallende stoffer er mutagene.
- Kjemisk mutagens inkluderer blant annet base analogs og kjemikalier som kan modifisere eksisterende baser. I begge tilfeller, mutasjoner er innført etter flere runder av DNA replikering.
- Ioniserende stråling, som for eksempel røntgen og γ-stråler, fører til brudd på phosphodiester ryggraden i DNA, og kan også kjemisk endre baser for å endre deres base-sammenkobling regler.,
- Nonionizing radiation som ultrafiolett lys kan introdusere pyrimidin (innhold av tymin) dimers, som under DNA replikasjon og transkripsjon, kan introdusere frameshift eller mutasjoner.
- Celler har mekanismer for å reparere naturlig forekommende mutasjoner. DNA-polymerase har korrekturlesing aktivitet. Mismatch repair er en prosess for å reparere feil innlemmet baser etter DNA-replikasjon har blitt fullført.
- Pyrimidin dimers kan også repareres., I nukleotid eksisjon reparasjon (mørk repair), enzymer som gjenkjenner forvrengning introdusert av pyrimidin dimer og erstatte den skadede strand med riktig baser, ved hjelp av uskadet DNA-tråden som en mal. Bakterier og andre organismer kan også bruke direkte reparasjon, hvor photolyase enzym, i nærvær av synlig lys, pauser fra hverandre pyrimidines.
- Gjennom en sammenligning av vekst på hele platen og mangel på vekst på media som mangler spesifikke næringsstoffer, bestemte tap-av-funksjon mutanter kalt auxotrophs kan identifiseres.,
- Ames test er en billig metode som bruker auxotrophic bakterier for å måle mutasjonsfremmende karakter av en kjemisk sammensetning. Mutasjonsfremmende karakter konklusjon / oppsummering er en indikator for kreftfremkallende potensial.
Flere Valg
Hvilken av de følgende er en endring i den rekkefølge som fører til dannelsen av en stopp codon?
- missense mutasjon
- nonsense mutasjon
- stille mutasjon
- sletting mutasjon
dannelsen av pyrimidin dimers resultater fra hvilken av de følgende?
- spontan feil ved DNA-polymerase
- eksponering for gamma stråling
- eksponering for ultrafiolett stråling
- eksponering for intercalating agenter
Hvilken av de følgende er et eksempel på en frameshift mutasjon?
- sletting av et codon
- missense mutasjon
- stille mutasjon
- sletting av en nukleotid
Hvilken av følgende er den type DNA-reparasjon, noe som innhold av tymin dimers er direkte brutt ned av enzymet photolyase?,
- direkte reparasjon
- nukleotid eksisjon reparasjon
- mismatch repair
- korrektur
Hvilke av følgende om Ames-test er sann?
- Det er brukt til å identifisere nyopprettede auxotrophic mutanter.
- Det er brukt til å identifisere mutanter med restaurert biosynthetic aktivitet.
- Det er brukt til å identifisere spontan mutanter.,
- Det er brukt til å identifisere mutanter mangler photoreactivation aktivitet.
Fyll ut Blank
En kjemisk mutagen som er strukturelt lik en nukleotid, men har forskjellige base-sammenkobling regler kalles en ________.,
enzymet brukes i lys reparasjon for å dele innhold av tymin dimers kalles ________.
phenotype av en organisme som er oftest observert i naturen kalles ________.,
True/False
Kreftfremkallende stoffer er vanligvis mutagene.
Tenk på Det
Hvorfor er det mer sannsynlig at innsetting eller sletting vil være mer skadelig for en celle enn punkt mutasjoner?,
Hvorfor tror du Ames-test er å foretrekke til bruk av dyremodeller til skjermen kjemiske forbindelser for kreftfremkallende egenskap?
Kritisk Tenkning
her er flere DNA-sekvenser som er mutert sammenlignet med vill-type rekkefølge: 3′-T A C T G A C T G A C G A T C-5′. Ser at de er en del av et DNA-molekyl som har adskilt i forberedelse for transkripsjon, slik at du bare ser den malen strand., Bygge komplementære DNA-sekvenser (som angir 5′ og 3′ endene) for hver muterte DNA-sekvens, så transkribere (som angir 5′ og 3′ endene) malen tråder, og oversette mRNA-molekyler ved hjelp av den genetiske koden, tar opp den resulterende aminosyre-sekvensen (som viser N-og C termini). Hva slags mutasjon er hver?,>
Komplementære DNA-sekvens:
mRNA-sekvens transkribert fra mal:
aminosyresekvens av peptid:
Type mutasjon:
Komplementære DNA-sekvens:
mRNA-sekvens transkribert fra mal:
aminosyresekvens av peptid:
Type mutasjon: