Hvordan elementer kan samhandle med hverandre, avhenger av hvordan deres elektroner er organisert og hvor mange åpninger for elektroner finnes på ytterste regionen der elektroner er til stede i et atom. Elektroner finnes på energi nivåer som danner skall rundt kjernen. Nærmeste shell kan holde opp til to elektroner. Nærmeste shell til kjernen er alltid fylt først, før noen andre shell kan være fylt. Hydrogen har ett elektron, og derfor, det har bare ett sted okkupert innen de laveste shell., Helium har to elektroner; derfor, det kan helt fylle den laveste shell med sine to elektroner. Hvis du ser på den periodiske tabellen, vil du se at hydrogen og helium er det bare to elementer i den første raden. Dette er fordi de bare har elektroner i sitt første shell. Hydrogen og helium er det bare to elementer som har lavest shell og ingen andre skjell.
Den andre og tredje energi nivåer kan holde opp til åtte elektroner. De åtte elektroner er ordnet i fire par og en posisjon i hvert par er fylt med et elektron før noen par er fullført.,
Se på den periodiske tabellen igjen (Figur 1), vil du legge merke til at det er sju rader. Disse radene tilsvarer antall skjell som elementene i raden har. Elementene i en bestemt rad har et økende antall elektroner som kolonner gå fra venstre til høyre. Selv om hvert element har samme antall skjell, ikke alle skjellene er helt fylt med elektroner. Hvis du ser på den andre raden i den periodiske tabell, vil du finne litium (Li), beryllium (Be), boron (B), karbon (C), nitrogen (N), oksygen (O), fluor (F), og neon (Ne)., Alle disse har elektroner som tar bare første og andre skjell. Litium har bare ett elektron i sitt ytterste skall, beryllium har to elektroner, boron har tre, og så videre, til hele skallet er fylt med åtte elektroner, som er tilfellet med neon.
Ikke alle elementer har nok elektroner til å fylle sitt ytterste skall, men et atom er på sitt mest stabile når alle electron posisjoner i det ytterste skallet er fylt., På grunn av disse ledige stillinger i ytterste skall, kan vi se dannelsen av kjemiske forbindelser, eller interaksjon mellom to eller flere av samme eller forskjellige elementer som resulterer i dannelsen av molekyler. For å oppnå større stabilitet, atomer vil tendere til helt å fylle sine ytre skall og vil sammen med andre elementer for å oppnå dette målet ved å dele elektroner, ta imot elektroner fra et annet atom, eller donerer elektroner til et annet atom., Fordi den ytterste skall av elementer med lave atomic tall (opp til kalsium, med atomnummer 20) kan ha åtte elektroner, dette er referert til som octet-regelen. Et element kan donere, godta, eller dele elektroner med andre elementer for å fylle sin ytre skall og tilfredsstille octet-regelen.
Når et atom ikke inneholder like mange protoner og elektroner, kalles det et ion. Fordi antall elektroner ikke er lik antall protoner, hvert ion har en netto kostnad. Positive ioner er dannet ved å miste elektroner og kalles kationer., Negative ioner er dannet ved å få elektroner og kalles anioner.
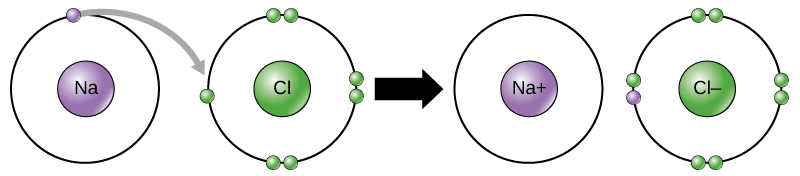
For eksempel, sodium bare har ett elektron i sitt ytterste skall. Det tar mindre energi for natrium å donere at ett elektron enn det gjør å godta syv flere elektroner til å fylle det ytre skallet. Hvis sodium mister et elektron, det har nå 11 protoner og bare 10 elektroner, og etterlater den med en samlet kostnad på +1. Det er nå kalt natrium ion.
klor-atomet har sju elektroner i sitt ytterste skall. Igjen, det er mer energi-effektive for klor for å få ett elektron enn å tape syv., Derfor, det har en tendens til å få et elektron til å opprette et ion med 17 protoner og 18 elektroner, noe som gir det en netto negativ (-1) kostnad. Det er nå kalt klorid ion. Denne bevegelsen av elektroner fra ett element til et annet er referert til som electron overføring. Som Figur 1 viser, en sodium atom (Na) har bare ett elektron i sitt ytterste skall, mens en klor-atomet (Cl) har sju elektroner i sitt ytterste skall. En sodium atom vil donere sin ett elektron til tomme skallet sitt, og en klor-atomet vil akseptere at electron å fylle skallet sitt, bli klorid., Begge ioner nå tilfredsstille octet-regel og har full ytterste skall. Fordi antall elektroner er ikke lenger likt antall protoner, som hver er nå en ion og har en +1 (natrium) eller -1 (klorid) kostnad.

Ioniske Bindinger
Det finnes fire typer av obligasjoner eller interaksjoner: ionisk, covalent, hydrogen obligasjoner, og van der Waals interaksjoner. Ioniske og covalent obligasjoner er sterke interaksjoner som krever en større energi-inngang for å bryte fra hverandre. Når et element donerer et elektron fra dens ytre skall, som i natrium atom eksemplet ovenfor, et positivt ion er dannet (Figur 2). Elementet aksepterer elektronet er nå negativt ladet., Fordi positive og negative ladninger tiltrekker, disse ionene bo sammen og danne en ionisk bond, eller et bånd mellom ioner. Elementene bånd sammen med elektronet fra ett element du bor hovedsakelig med andre element. Når Na+ og Cl– ioner kombineres for å produsere NaCl, et elektron fra et sodium atom opphold med de andre syv fra klor-atomet, og natrium og klorid ioner tiltrekker hverandre i et gitter av ioner med en netto null kostnad.,
Covalent Obligasjoner
en Annen type sterk kjemisk binding mellom to eller flere atomer er en covalent bond. Disse obligasjonene form når et elektron er delt mellom to elementer, og er den sterkeste og mest vanlige form av kjemisk binding i levende organismer. Covalent obligasjoner form mellom elementene som utgjør den biologiske molekyler i cellene våre., I motsetning til ioniske bindinger, covalent obligasjoner ikke distansere i vann.
det er Interessant, kjemikere og biologer måle bond styrke på forskjellige måter. Kjemikere måle det absolutte styrke av en bond (den teoretiske styrke), mens biologer er mer interessert i hvordan bond oppfører seg i et biologisk system, som er vanligvis vandig (vannbasert). I vann, ioniske bindinger kommer fra hverandre mye lettere enn covalent obligasjoner, så biologer vil si at de er svakere enn covalent obligasjoner. Hvis du ser i en kjemi lærebok, vil du se noe annerledes., Dette er et flott eksempel på hvordan den samme informasjonen kan føre til ulike svar avhengig av hvilket perspektiv du ser på det fra.
hydrogen og oksygen atomer som kombineres for å danne vann molekyler som er bundet sammen av covalent obligasjoner. Elektronet fra hydrogen atom deler sin tid mellom det ytre skallet av hydrogen atom og ufullstendig ytre skall av oksygen atom. Til helt å fylle det ytre skallet av et oksygen atom, to elektroner fra to hydrogen atomer er nødvendig, derav senket skrift «2» i H2O., Elektroner er delt mellom atomer som deler sin tid mellom dem til å «fylle» det ytre skallet av hver. Denne delingen er et lavere energi-stat for alle atomene involvert enn hvis de eksisterte uten deres ytre skall fylt.
Det er to typer covalent obligasjoner: polare og upolare. Upolare covalent obligasjoner form mellom to atomer av samme grunnstoff eller mellom ulike elementer som deler elektroner like. For eksempel, et oksygen atom kan obligasjon med en annen oksygen atom til å fylle sine ytre skall., Denne foreningen er upolare fordi elektronene vil bli fordelt likt mellom hver oksygen atom. To covalent obligasjoner form mellom de to oksygen atomer fordi oksygen krever to delte elektronene til å fylle sin ytterste skall. Nitrogen atomer vil danne tre covalent obligasjoner (også kalt trippel covalent) mellom to atomer av nitrogen fordi hver nitrogen atom trenger tre elektroner til å fylle sin ytterste skall. Et annet eksempel på en upolar covalent bond er funnet i metan (CH4) molekyl. Karbon atom har fire elektroner i sitt ytterste skall, og må fire mer å fylle det., Det blir disse fire fra fire hydrogenatomer, hvert atom gir ett. Disse elementene er en del av elektroner like, å opprette fire upolare covalent obligasjoner (Figur 3).
I en polar covalent bond, elektroner som deles av atomer bruke mer tid på nærmere én kjerne enn til den andre kjernen. På grunn av den skjeve fordelingen av elektroner mellom de forskjellige kjerner, en litt positiv (δ+) eller litt negativ (δ–) kostnad utvikler seg. Den covalent båndene mellom hydrogen og oksygen atomer i vann er polar covalent obligasjoner., De delte elektronene tilbringe mer tid i nærheten av oksygen kjernen, noe som gir det en liten negativ ladning, enn de tilbringer i nærheten av hydrogen kjerner, noe som gir disse molekylene i en liten positiv ladning.

Hydrogen Obligasjoner
Ioniske og covalent obligasjoner er sterke bånd som krever betydelig energi for å bryte. Imidlertid, ikke alle båndene mellom elementene er ionisk eller covalent obligasjoner. Svakere bindinger kan også form. Dette er attraksjoner som oppstår mellom positive og negative ladninger som ikke krever mye energi for å bryte. To svake bindinger som oppstår ofte er hydrogen obligasjoner og van der Waals interaksjoner. Disse obligasjonene gir opphav til de unike egenskapene til vann, og den unike strukturen av DNA og proteiner.,
Når polar covalent obligasjoner inneholder et hydrogenatom form, hydrogenatom i at bond har en litt positiv ladning. Dette er fordi felles electron er trukket sterkere mot det andre elementet og bort fra hydrogen i kjernen. Fordi hydrogen atom er litt positiv (δ+), vil det være tiltrukket til nærliggende negative delvis kostnader (δ–). Når dette skjer, en svak interaksjon oppstår mellom δ+ kostnad av hydrogen atom av ett molekyl og δ– kostnad av andre molekyl. Dette samspillet kalles en hydrogen bond., Denne type bond er vanlig, for eksempel flytende arten av vann er forårsaket av hydrogen bindingene mellom vannmolekylene (Figur 4). Hydrogen obligasjoner gi vann unike egenskaper som å opprettholde livet. Hvis det ikke var for hydrogen binding, vann ville være en gass snarere enn en flytende ved romtemperatur.

Hydrogen båndene som kan oppstå mellom ulike molekyler, og de trenger ikke alltid å inkludere et molekyl vann. Hydrogen atomer i polare bindinger i noen molekyl kan danne bindinger med andre tilstøtende molekyler. For eksempel, hydrogen obligasjoner hold sammen to lange tråder av DNA for å gi DNA-molekylet sin karakteristiske dobbel-strandet struktur. Hydrogen bindinger er også ansvarlig for noen av de tre-dimensjonale strukturen av proteiner.,
van der Waals Interaksjoner
Som hydrogen obligasjoner, van der Waals interaksjoner er svak attraksjoner eller interaksjoner mellom molekyler. De oppstår mellom polar, covalently bundet, atomer i forskjellige molekyler. Noen av disse svake attraksjoner er forårsaket av midlertidige delvis avgifter dannet når elektronene beveger seg rundt en kjerne. Disse svake interaksjoner mellom molekyler som er viktig i biologiske systemer.