eerst moet u het aantal valentie-elektronen weten. U kunt dit doen door (1) de elektronenconfiguratie per element te tekenen of (2) uw periodiek systeem te raadplegen.,
Als u ervoor kiest om de elektronenconfiguratie per element te tekenen, krijgt u ongeveer het volgende:
#N# (atoomnummer = 7) : #1s^2# #color (red) (2s^2)# #color (red) (2p^3)# (5 buitenste elektronen)
#o# (atoomnummer = 8) : #1s^2# #color (red) (2s^2)# #color (red) (2p^4)# (6 buitenste elektronen)
als u ervoor kiest om uw periodiek systeem te raadplegen, merk dan op dat #n# tot groep 5A behoort, terwijl #O# tot groep 6a behoort. het groepsnummer geeft het aantal buitenste elektronen aan.,
nu u het aantal valentie-elektronen per element Weet, moet u de totale valentie-elektronen berekenen voor het #NO_3^” -1 ” # ion.
5 + (3 x 6) = 23 elektronen
maar omdat het hele molecuul een -1 lading heeft, moet je dit ook toevoegen. Dus het totale aantal valentie-elektronen is 24.
het volgende wat je moet doen is tekenen. Normaal gesproken is het eerste element in de chemische formule het centrale atoom. In dit geval wordt het #N# atoom omgeven door drie #O# atomen.,
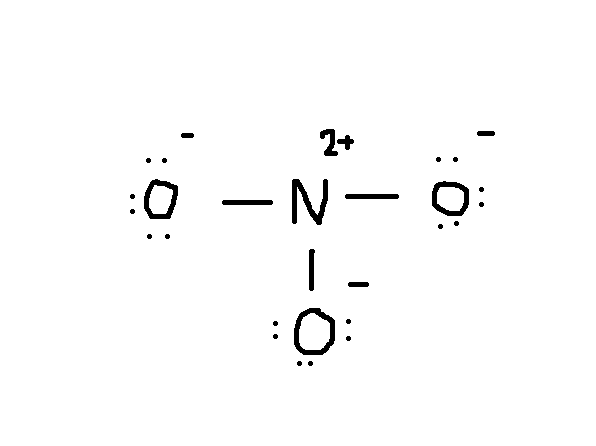
merk op dat het eenzame paar elektronen van #O# ook in het diagram zijn opgenomen. Als je het totale aantal elektronen op de bovenstaande tekening meetelt, zijn het al 24 elektronen (één lijn telt als 2 elektronen). Maar deze tekening heeft de octetregel overtreden omdat het centrale atoom slechts 6 elektronen heeft in plaats van het juiste getal 8. Dus wat te doen?
voeg een andere binding toe, maar waar?,
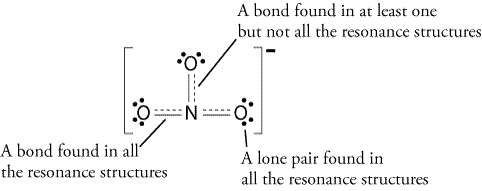
daarom zou de resonantiestructuur er zo uitzien: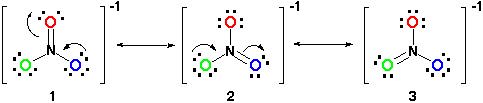
alle resonantiestructuren zijn correct omdat ze allemaal de octetregel volgen en allemaal een totaal aantal van 24 elektronen hebben. Merk op dat de enige binding die beweegt de pi (#pi#) binding is of in lekenterm, de dubbele binding en een van de elektronenparen van het# O # atoom.