leerdoelen
- Vergelijk punt mutaties en frameshift mutaties
- het Beschrijven van de verschillen tussen missense, onzin, en stille mutaties
- het Beschrijven van de verschillen tussen licht en donker reparatie
- Uitleggen hoe de verschillende mutagene act
- Leg uit waarom de Ames-test kan worden gebruikt voor het detecteren van kankerverwekkende stoffen
- het Analyseren van sequenties van DNA en voorbeelden van soorten mutaties
Een mutatie is een erfelijke verandering in de DNA-sequentie van een organisme., Het resulterende organisme, een mutant genoemd, kan een herkenbare verandering in fenotype hebben in vergelijking met het wilde type, dat het fenotype is dat het vaakst in de natuur wordt waargenomen. Een verandering in de opeenvolging van DNA wordt verleend aan mRNA door transcriptie, en kan tot een veranderde aminozuuropeenvolging in een proteã ne Op vertaling leiden. Omdat de proteã nen de overgrote meerderheid van cellulaire functies uitvoeren, kan een verandering in aminozuuropeenvolging in een proteã ne tot een veranderd fenotype voor de cel en het organisme leiden.,
effecten van mutaties op de DNA-sequentie
Er zijn verschillende typen mutaties die worden geclassificeerd volgens de manier waarop het DNA-molecuul wordt gewijzigd. Eén type, een puntmutatie genoemd, beà nvloedt één enkele basis en treedt het vaakst op wanneer één basis door een andere wordt vervangen of vervangen. Mutaties zijn ook het gevolg van de toevoeging van een of meer basen, bekend als een insertie, of de verwijdering van een of meer basen, bekend als een deletie.
denk er eens over na
- welk type mutatie treedt op wanneer een gen twee nucleotiden minder in zijn sequentie heeft?,
effecten van mutaties op de eiwitstructuur en-functie
puntmutaties kunnen een breed scala aan effecten op de eiwitfunctie hebben (figuur 1). Als gevolg van de degeneratie van de genetische code, zal een puntmutatie gewoonlijk resulteren in hetzelfde aminozuur dat in het resulterende polypeptide ondanks de opeenvolgingsverandering wordt opgenomen. Deze verandering zou geen effect op de structuur van de proteã ne hebben, en wordt zo genoemd een stille verandering. Een missense mutatie resulteert in een ander aminozuur dat wordt opgenomen in het resulterende polypeptide., Het effect van een missense mutatie hangt af van hoe chemisch het nieuwe aminozuur verschilt van het wild-type aminozuur. De plaats van het veranderde aminozuur binnen de proteã ne is ook belangrijk. Bijvoorbeeld, als het veranderde aminozuur deel uitmaakt van de actieve plaats van het enzym, dan kan het effect van de missense-mutatie significant zijn. Veel missense mutaties resulteren in eiwitten die nog steeds functioneel zijn, althans tot op zekere hoogte. Soms kunnen de effecten van missense mutaties alleen zichtbaar zijn onder bepaalde omgevingsomstandigheden; dergelijke missense mutaties worden voorwaardelijke mutaties genoemd., In zeldzame gevallen kan een missense mutatie gunstig zijn. Onder de juiste omgevingsomstandigheden kan dit type mutatie het organisme dat het herbergt een selectief voordeel geven. Nog een ander type puntmutatie, een nonsensmutatie genoemd, zet een codon dat een aminozuur codeert (een zintuigcodon) om in een stopcodon (een nonsenscodon). Nonsensmutaties resulteren in de synthese van eiwitten die korter zijn dan het wilde type en meestal niet functioneel zijn.
verwijderingen en inserties veroorzaken ook verschillende effecten., Omdat codons een drieling van nucleotiden zijn, kunnen inserties of deleties in groepen van drie nucleotiden leiden tot het inbrengen of verwijderen van een of meer aminozuren en kunnen geen significante effecten op de functionaliteit van de resulterende proteã ne veroorzaken. Echter, frameshift mutaties, veroorzaakt door inserties of deleties van een aantal nucleotiden die niet een veelvoud van drie zijn, zijn uiterst problematisch omdat een verschuiving in het leesframe resultaten (figuur 1). Omdat de ribosomen mRNA in triplet codons lezen, kunnen de veranderingen van de frameshift elk aminozuur na het punt van de verandering veranderen., Het nieuwe lezingskader kan ook een eindecodon vóór het eind van de codeeropeenvolging omvatten. Bijgevolg zijn eiwitten gemaakt van genen die frameshiftmutaties bevatten bijna altijd niet functioneel.
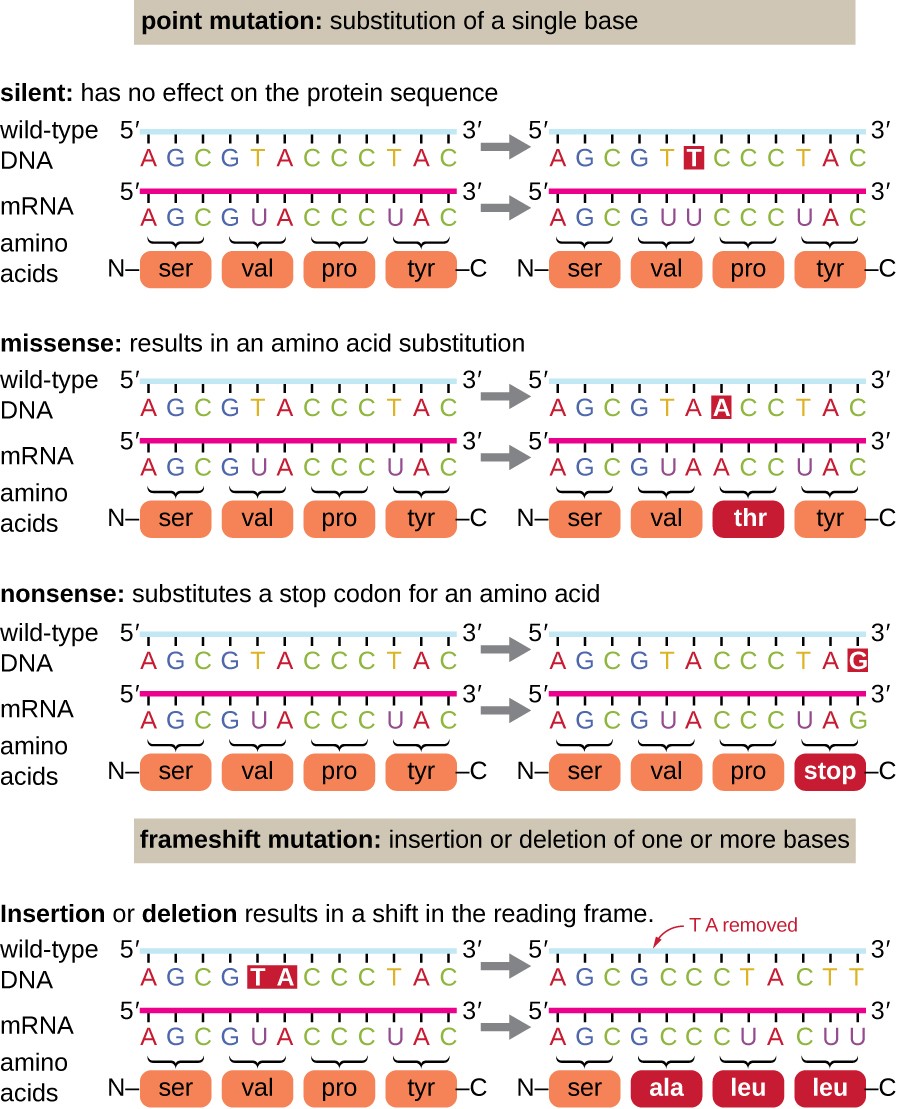
figuur 1. Klik voor een grotere afbeelding. De veranderingen kunnen tot veranderingen in de eiwitopeenvolging leiden die door DNA wordt gecodeerd.
denk er eens over na
- Wat zijn de redenen waarom een verandering van een nucleotide in een gen voor een eiwit geen effect zou kunnen hebben op het fenotype van dat gen?,
- is het mogelijk dat drie nucleotiden na het vijfde nucleotide in een eiwitcodeergen samen een eiwit produceren dat korter is dan normaal? Hoe of hoe niet?
een gunstige mutatie
sinds het eerste geval van infectie met het humaan immunodeficiëntievirus (HIV) werd gemeld in 1981, zijn bijna 40 miljoen mensen overleden aan HIV-infectie, het virus dat het verworven immunodeficiëntiesyndroom (AIDS) veroorzaakt., Het virus richt hulp T cellen die een belangrijke rol spelen bij het overbruggen van de aangeboren en adaptieve immuunrespons, infecteren en doden van cellen die normaal betrokken zijn bij de reactie van het lichaam op infectie. Er is geen genezing voor HIV-infectie, maar veel geneesmiddelen zijn ontwikkeld om de progressie van het virus te vertragen of te blokkeren. Hoewel individuen over de hele wereld kunnen worden besmet, de hoogste prevalentie onder mensen 15-49 jaar oud is in sub-Sahara Afrika, waar bijna een persoon op 20 is besmet, goed voor meer dan 70% van de infecties wereldwijd (Figuur 2)., Helaas is dit ook een deel van de wereld waar preventiestrategieën en medicijnen om de infectie te behandelen het meest ontbreken.

Figuur 2. HIV komt veel voor in Afrika bezuiden de Sahara, maar in andere delen van de wereld is de prevalentie vrij laag.
in de afgelopen jaren is wetenschappelijke interesse gewekt door de ontdekking van enkele individuen uit Noord-Europa die resistent zijn tegen HIV-infectie. In 1998 werd de Amerikaanse geneticus Stephen J., O ‘Brien van de National Institutes of Health (NIH) en collega’ s publiceerden de resultaten van hun genetische analyse van meer dan 4.000 individuen. Deze gaven aan dat veel individuen van Euraziatische afkomst (tot 14% in sommige etnische groepen) een deletiemutatie hebben, genoemd CCR5-delta 32, in het gen dat CCR5 codeert. CCR5 is een coreceptor die op de oppervlakte van T-cellen wordt gevonden die voor vele spanningen van het virus noodzakelijk is om de gastheercel in te gaan. De verandering leidt tot de productie van een receptor waaraan HIV niet effectief kan binden en blokkeert zo virale ingang., Mensen homozygote voor deze mutatie hebben sterk verminderde gevoeligheid voor HIV-infectie, en degenen die heterozygote hebben enige bescherming tegen infectie ook.
Het is niet duidelijk waarom mensen van Noord-Europese afkomst deze mutatie dragen, maar de prevalentie lijkt het hoogst te zijn in Noord-Europa en neemt gestaag af in populaties naarmate men naar het zuiden verhuist. Uit onderzoek blijkt dat de mutatie al aanwezig was voordat HIV verscheen en dat deze mutatie in Europese populaties kan zijn geselecteerd als gevolg van blootstelling aan de pest of de pokken., Deze mutatie kan individuen beschermen tegen pest (veroorzaakt door de bacterie Yersinia pestis) en pokken (veroorzaakt door het variola virus) omdat deze receptor ook betrokken kan zijn bij deze ziekten. De leeftijd van deze mutatie is een kwestie van discussie, maar schattingen suggereren dat het verscheen tussen 1875 jaar tot 225 jaar geleden, en kan zijn verspreid vanuit Noord-Europa door Viking invasies.
deze opwindende bevinding heeft geleid tot nieuwe wegen in HIV-onderzoek, waaronder het zoeken naar geneesmiddelen om de CCR5-binding aan HIV te blokkeren bij personen die de mutatie niet hebben., Hoewel DNA-testen om te bepalen welke individuen drager zijn van de CCR5-delta 32 mutatie mogelijk is, zijn er gedocumenteerde gevallen van individuen homozygoot voor de mutatie die HIV oplopen. Om deze reden, wordt het testen van DNA voor de verandering niet wijd door volksgezondheidsambtenaren geadviseerd om riskant gedrag in degenen die de verandering dragen niet aan te moedigen. Niettemin blijft het remmen van de binding van HIV aan CCR5 een geldige strategie voor de ontwikkeling van medicamenteuze therapieën voor HIV-geïnfecteerden.,
oorzaken van mutaties
fouten in het proces van DNA-replicatie kunnen spontane mutaties veroorzaken. Het foutenpercentage van de polymerase van DNA is één onjuiste base per miljard gerepliceerde basisparen. Blootstelling aan mutagenen kan geïnduceerde mutaties veroorzaken, die verschillende soorten chemische agentia of straling zijn (Tabel 1). Blootstelling aan een mutageen kan de mutatiesnelheid meer dan 1000 keer verhogen. Mutagenen zijn vaak ook kankerverwekkende stoffen, stoffen die kanker veroorzaken. Terwijl echter bijna alle carcinogene agentia mutageen zijn, zijn niet alle mutagenen noodzakelijkerwijs carcinogene agentia.,
| Tabel 1., to AT base pair | Point | |||
|---|---|---|---|---|
| Intercalating agents | ||||
| Acridine orange, ethidium bromide, polycyclic aromatic hydrocarbons | Distorts double helix, creates unusual spacing between nucleotides | Introduces small deletions and insertions | Frameshift | |
| Ionizing radiation | ||||
| X-rays, γ-rays | Forms hydroxyl radicals | Causes single- and double-strand DNA breaks | Repair mechanisms may introduce mutations | |
| X-rays, γ-rays | Modifies bases (e.,g., deaminating C U) | Zet GC OP basis pair | Punt | |
| niet ioniserende straling | ||||
| Ultraviolet | Formulieren pyrimidine (meestal thymine) dimeren | Oorzaken van DNA-fouten | Frameshift of punt | |
Chemische Mutagenen
Verschillende soorten chemische mutagenen rechtstreeks communiceren met de DNA-hetzij door de rol van nucleoside-analogen of door het aanpassen van de nucleotide basen., De chemische producten genoemd nucleosideanalogen zijn structureel gelijkaardig aan normale nucleotidebasen en kunnen in DNA tijdens replicatie worden opgenomen (Figuur 3). Deze basisanalogen induceren mutaties omdat ze vaak andere basispaarregels hebben dan de basen die ze vervangen. Andere chemische mutagenen kunnen normale DNA-basissen wijzigen, resulterend in verschillende base-pairing regels. Bijvoorbeeld, deamineert het salpeterzuur cytosine, die het in uracil omzetten. Uracil paren dan met adenine in een volgende ronde van replicatie, resulterend in de omzetting van een basenpaar GC in een basenpaar bij., Het salpeterzuur deamineert ook adenine aan hypoxanthine, die basenparen met cytosine in plaats van thymine, resulterend in de omzetting van een TA-basenpaar in een CG-basenpaar.
Figuur 3. Klik voor een grotere afbeelding. (a) 2-aminopurinenucleoside (2AP) is structureel een nucleoside analoog aan adeninenucleoside, terwijl 5-bromouracil (5BU) een nucleoside analoog aan thyminenucleoside is. 2AP basenparen met C, het omzetten van een AT basenpaar naar een GC basenpaar na verschillende replicatierondes., 5BU paren met G, het omzetten van een bij basenpaar naar een GC basenpaar na verschillende replicatierondes. (B) salpeterzuur is een ander type chemisch mutageen dat reeds bestaande nucleosidebasen zoals C wijzigt om U te produceren, die basenparen met A. Deze chemische modificatie, zoals hier getoond, resulteert in het omzetten van een CG-basenpaar in een TA-basenpaar.
chemische mutagenen bekend als intercalatiemiddelen werken anders., Deze molecules glijden tussen de gestapelde stikstofhoudende basen van de dubbele helix van DNA, het molecuul vervormen en atypische uit elkaar plaatsen tussen nucleotidebasenparen creëren (Figuur 4). Dientengevolge, tijdens de replicatie van DNA, kan de polymerase van DNA of het herhalen van verscheidene nucleotiden overslaan (die tot een schrapping leiden) of extra nucleotiden invoegen (die tot een toevoeging leiden). Beide resultaten kunnen leiden tot een frameshift mutatie. Verbrandingsproducten zoals polycyclische aromatische koolwaterstoffen zijn bijzonder gevaarlijke intercalatiemiddelen die kunnen leiden tot door mutatie veroorzaakte kankers., De intercalatiemiddelen ethidiumbromide en acridine oranje worden vaak gebruikt in het laboratorium om DNA te bevlekken voor visualisatie en zijn potentiële mutagenen.

Figuur 4. Intercalating agents, zoals acridine, introduceren atypische tussenruimte tussen basenparen, resulterend in de polymerase van DNA die of een schrapping of een invoeging introduceren, die tot een potentiële frameshiftverandering leiden.
straling
blootstelling aan ioniserende of niet-ioniserende straling kan elk mutaties in DNA induceren, zij het via verschillende mechanismen., Sterke ioniserende straling zoals röntgenstralen en gammastralen kunnen enkele – en dubbelstrengs breuken in de DNA-ruggengraat veroorzaken door de vorming van hydroxylradicalen bij blootstelling aan straling (Figuur 5). Ioniserende straling kan ook basen wijzigen; bijvoorbeeld, de deaminatie van cytosine aan uracil, analoog aan de werking van salpeterzuur. Ioniserende straling blootstelling wordt gebruikt om microben te doden om medische apparaten en voedsel te steriliseren, vanwege zijn dramatische niet-specifieke effect in het beschadigen van DNA, eiwitten, en andere cellulaire componenten (zie het gebruik van fysieke methoden om micro-organismen te controleren).,
niet-ioniserende straling is, net als ultraviolet licht, niet energiek genoeg om dit soort chemische veranderingen in gang te zetten. Nochtans, kan de nietioniserende straling dimeervorming tussen twee aangrenzende pyrimidinebasissen, gewoonlijk twee thymines, binnen een nucleotidebundel veroorzaken. Tijdens de vorming van het thyminedimer, worden de twee aangrenzende thymines covalent verbonden en, indien verlaten unrepaired, worden zowel de replicatie als de transcriptie van DNA op dit punt vastgezet. De polymerase van DNA kan doorgaan en het dimeer verkeerd herhalen, potentieel leidend tot frameshift of puntveranderingen.,

Figuur 5. (a) ioniserende straling kan leiden tot de vorming van single-stranded en double-stranded breuken in de suiker-fosfaat backbone van DNA, evenals tot de wijziging van basen (niet weergegeven). (b) Nonionizing straling zoals ultraviolet licht kan leiden tot de vorming van thymine dimeren, die replicatie en transcriptie kan vertragen en frameshift of puntmutaties introduceren.
denk er eens over na
- Hoe introduceert een base-analoog een mutatie?,
- Hoe introduceert een intercalator een mutatie?
- welk type mutageen veroorzaakt thymine dimeren?
DNA-herstel
het proces van DNA-replicatie is zeer nauwkeurig, maar fouten kunnen spontaan optreden of worden veroorzaakt door mutagenen. Ongecorrigeerde fouten kunnen ernstige gevolgen hebben voor het fenotype. De cellen hebben verscheidene reparatiemechanismen ontwikkeld om het aantal veranderingen te minimaliseren die aanhouden.,
proeflezen
De meeste fouten die tijdens de DNA-replicatie worden gemaakt, worden onmiddellijk gecorrigeerd door de meeste DNA-polymerasen via een functie die proeflezen wordt genoemd. In het proeflezen, leest de polymerase van DNA de nieuw toegevoegde basis, die ervoor zorgt dat het aan de overeenkomstige basis in de malplaatjebundel complementair is alvorens volgende toe te voegen. Als een onjuiste base is toegevoegd, maakt het enzym een snede om het verkeerde nucleotide vrij te geven en een nieuwe base wordt toegevoegd.,
Mismatch reparatie
sommige fouten tijdens replicatie worden gecorrigeerd kort nadat de replicatiemachine is verplaatst. Dit mechanisme heet mismatch reparatie. De enzymen die betrokken zijn bij dit mechanisme herkennen het onjuist toegevoegde nucleotide, snijden het uit en vervangen het door de juiste base. Een voorbeeld is de methyl-gerichte mismatch reparatie in E. coli. Het DNA is hemimethyleerd. Dit betekent dat de ouderstreng geméthyleerd is terwijl de nieuw samengestelde dochterstreng dat niet is. Het duurt enkele minuten voordat de nieuwe streng geméthyleerd is., De Proteã NEN MutS, MutL, en MutH binden aan de hemimethyleerde plaats waar het onjuiste nucleotide wordt gevonden. MutH snijdt de niet-gemethyleerde streng (de nieuwe streng). Een exonuclease verwijdert een deel van de bundel (met inbegrip van het onjuiste nucleotide). Het gevormde gat wordt dan ingevuld door DNA pol III en ligase.
reparatie van Thymine dimeren
omdat de productie van thymine dimeren vaak voorkomt (veel organismen kunnen ultraviolet licht niet vermijden), zijn mechanismen geëvolueerd om deze laesies te herstellen., Bij nucleotide excision repair (ook wel dark repair genoemd) verwijderen enzymen het pyrimidine dimeer en vervangen het door de juiste nucleotiden (Figuur 6). In E. coli wordt het DNA gescand door een enzymcomplex. Als een vervorming in de dubbele helix wordt gevonden die door het pyrimidine dimeer werd geïntroduceerd, snijdt het enzymcomplex de suiker-fosfaat backbone verscheidene basen stroomopwaarts en stroomafwaarts van het dimeer, en het segment van DNA tussen deze twee bezuinigingen wordt dan enzymatisch verwijderd. DNA pol I vervangt de ontbrekende nucleotiden door de juiste en DNA ligase verzegelt het gat in de suiker-fosfaat backbone.,
de directe reparatie (ook lichtreparatie genoemd) van thymine-dimeren vindt plaats door het proces van fotoreactivatie in aanwezigheid van zichtbaar licht. Een enzym genaamd fotolyase herkent de vervorming in de DNA-helix veroorzaakt door de thymine dimeer en bindt aan de dimeer. Dan, in aanwezigheid van zichtbaar licht, verandert het fotolyase-enzym bouw en breekt het thymine-dimeer uit elkaar, waardoor de thymines weer correct paar met de adenines op de complementaire bundel kunnen baseren., Fotoreactivatie lijkt aanwezig te zijn in alle organismen, met uitzondering van placentale zoogdieren, inclusief mensen. Fotoreactivatie is vooral belangrijk voor organismen chronisch blootgesteld aan ultraviolette straling, zoals planten, fotosynthetische bacteriën, algen, en koralen, om de accumulatie van mutaties veroorzaakt door thymine dimeer vorming te voorkomen.

Figuur 6. Klik voor een grotere afbeelding. Bacteriën hebben twee mechanismen voor het herstellen van thymine dimeren., (A) in de reparatie van de nucleotideuitsnijding, herkent een enzymcomplex de vervorming in het DNA-complex rond het thymine-dimeer en snijdt en verwijdert de beschadigde bundel van DNA. De correcte nucleotiden worden vervangen door DNA pol I en de nucleotide bundel wordt verzegeld door DNA ligase. b) bij fotoreactivatie bindt het enzymfotolyase aan het thymine-dimeer en breekt, in aanwezigheid van zichtbaar licht, het dimeer uiteen, waardoor de basisparen van de thymines met complementaire adenines op de tegenoverliggende DNA-streng worden hersteld.,
denk er eens over na
- Tijdens mismatchreparatie, hoe herkent het enzym de nieuwe en de oude streng?
- Hoe introduceert een intercalator een mutatie?
- welk type mutatie herstelt fotolyase?
Identificatie van bacteriële mutanten
een veel gebruikte techniek om bacteriële mutanten te identificeren wordt replica plating genoemd., Deze techniek wordt gebruikt om nutritionele mutanten te ontdekken, genoemd auxotrophs, die een mutatie in een gen hebben dat een enzym codeert in de biosyntheseweg van een specifieke voedingsstof, zoals een aminozuur. Als gevolg hiervan, terwijl wild-type cellen het vermogen behouden om normaal te groeien op een medium zonder de specifieke voedingsstof, auxotrophs zijn niet in staat om te groeien op een dergelijk medium. Tijdens replica plating (Figuur 7), een populatie van bacteriële cellen wordt mutagenized en vervolgens geplateerd als individuele cellen op een complexe voedingswaarde volledige plaat en toegestaan om te groeien tot kolonies., Cellen uit deze kolonies worden van deze Hoofdplaat verwijderd, vaak met steriel fluweel. Dit fluweel, dat cellen bevat, wordt vervolgens in dezelfde richting op platen van verschillende media gedrukt. Ten minste één plaat moet ook uit voedingsoogpunt volledig zijn om ervoor te zorgen dat de cellen goed tussen de platen worden overgebracht. De andere platen missen specifieke voedingsstoffen, waardoor de onderzoeker verschillende auxotrofe mutanten kan ontdekken die geen specifieke voedingsstoffen kunnen produceren. Cellen van de corresponderende kolonie op de voedingswaarde volledige plaat kunnen worden gebruikt om de mutant te herstellen voor verder onderzoek.,

Figuur 7. De identificatie van auxotrofe mutanten, zoals histidine auxotrofen, gebeurt met replica-plating. Na mutagenese worden kolonies die groeien op een volledig voedingsmedium maar niet op een medium zonder histidine geïdentificeerd als histidine auxotrofen.
denk er eens over na
- Waarom worden cellen op een uit voedingsoogpunt complete plaat naast een uit voedingsoogpunt deficiënte plaat geplaatst bij het zoeken naar een mutant?,
de Ames-Test
de Ames-test, ontwikkeld door Bruce Ames (1928–) in de jaren zeventig, is een methode die bacteriën gebruikt voor een snelle en goedkope screening van het carcinogene potentieel van nieuwe chemische verbindingen. De test meet de mutatiesnelheid die gepaard gaat met blootstelling aan de verbinding, wat, indien verhoogd, erop kan wijzen dat blootstelling aan deze verbinding gepaard gaat met een groter risico op kanker., De Ames-test gebruikt als testorganisme een stam van Salmonella typhimurium die een histidine auxotroph is, die niet in staat is zijn eigen histidine te synthetiseren vanwege een mutatie in een essentieel gen dat nodig is voor zijn synthese. Na blootstelling aan een potentieel mutageen, worden deze bacteriën geplateerd op een medium ontbreekt histidine, en het aantal mutanten herwinnen de capaciteit om histidine te synthetiseren wordt geregistreerd en vergeleken met het aantal dergelijke mutanten die zich voordoen in de afwezigheid van het potentiële mutageen (Figuur 8)., De chemische producten die mutageen zijn zullen meer mutanten met herstelde histidinesynthese in de Ames-test teweegbrengen. Omdat veel chemische stoffen niet direct mutageen zijn, maar door leverenzymen worden gemetaboliseerd tot mutagene vormen, wordt het leverextract van ratten vaak opgenomen aan het begin van dit experiment om levermetabolisme na te bootsen. Nadat de AMES-test is uitgevoerd, worden verbindingen die als mutageen zijn geïdentificeerd verder getest op hun potentiële carcinogene eigenschappen door andere modellen te gebruiken, met inbegrip van diermodellen zoals muizen en ratten.
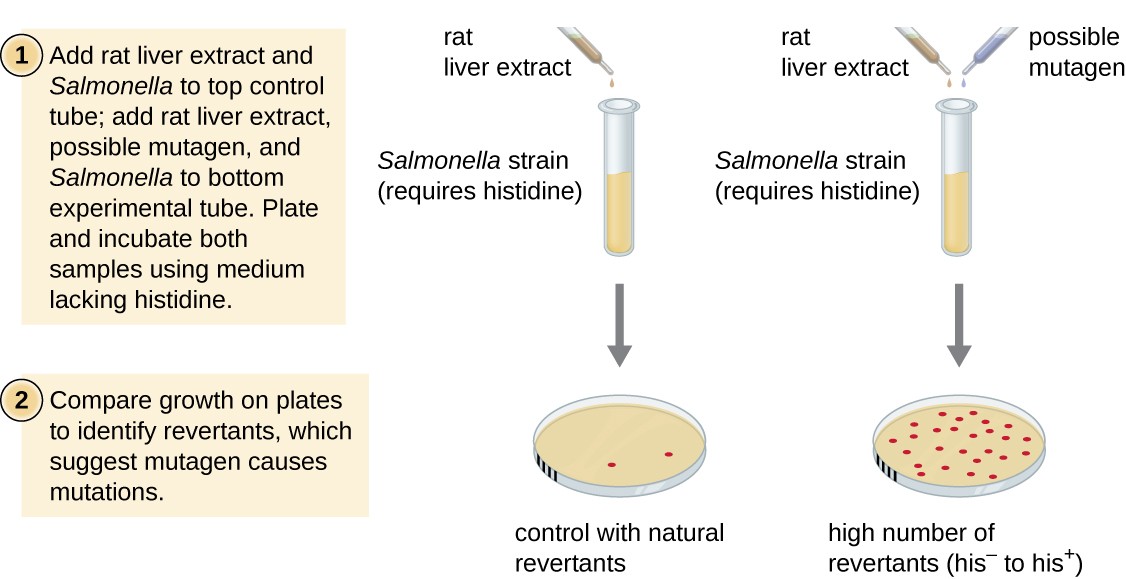
Figuur 8., De Ames-test wordt gebruikt om mutagene, potentieel kankerverwekkende chemische stoffen te identificeren. Als teststam wordt een Salmonella histidine auxotroph gebruikt, die wordt blootgesteld aan een potentieel mutageen/carcinogeen agens. Het aantal reversiemutanten dat kan groeien in afwezigheid van het geleverde histidine wordt geteld en vergeleken met het aantal natuurlijke reversiemutanten dat optreedt in afwezigheid van het potentiële mutageen.
denk er eens over na
- welke mutatie wordt gebruikt als indicator voor het mutatiepercentage in de Ames-test?
- Waarom kan de Ames-test werken als een test voor carcinogeniteit?,
sleutelbegrippen en samenvatting
- een mutatie is een erfelijke verandering in DNA. Een mutatie kan tot een verandering in de aminozuurvolgorde van een eiwit leiden, die mogelijk zijn functie beà nvloedt.
- een puntmutatie beïnvloedt een enkel basispaar. Een puntmutatie kan een stille mutatie veroorzaken als het mRNA-codon voor hetzelfde aminozuur codeert, een missense-mutatie als het mRNA-codon voor een ander aminozuur codeert, of een nonsense-mutatie als het mRNA-codon een stopcodon wordt.,
- Missense mutaties kunnen hun functie behouden, afhankelijk van de chemie van het nieuwe aminozuur en de locatie ervan in het eiwit. Nonsensmutaties produceren afgeknotte en vaak niet-functionele eiwitten.
- een frameshift-mutatie is het resultaat van een insertie of deletie van een aantal nucleotiden dat geen veelvoud van drie is. De verandering in leesframe verandert elk aminozuur na het punt van de verandering en resulteert in een niet-functionele proteã ne.
- spontane mutaties treden op door DNA-replicatiefouten, terwijl geïnduceerde mutaties optreden door blootstelling aan een mutageen.,
- mutagene agentia zijn vaak carcinogeen, maar niet altijd. Bijna alle kankerverwekkende stoffen zijn echter mutageen.
- chemische mutagenen omvatten basisanalogen en chemische stoffen die bestaande basen wijzigen. In beide gevallen, worden de veranderingen geà ntroduceerd na verscheidene rondes van de replicatie van DNA.
- ioniserende straling, zoals röntgenstralen en γ-stralen, leidt tot breuk van de fosfodiëster-ruggengraat van DNA en kan ook chemisch basen wijzigen om hun basispaarregels te wijzigen.,
- niet-ioniserende straling zoals ultraviolet licht kan pyrimidine (thymine) dimeren introduceren, die tijdens DNA-replicatie en-transcriptie frameshift-of puntmutaties kunnen veroorzaken.
- cellen hebben mechanismen om van nature voorkomende mutaties te herstellen. De polymerase van DNA heeft het proeflezen activiteit. De mismatchreparatie is een proces om verkeerd opgenomen basissen te herstellen nadat de replicatie van DNA is voltooid.
- Pyrimidine dimeren kunnen ook worden gerepareerd., In de reparatie van de nucleotideuitsnijding (donkere reparatie), erkennen de enzymen de vervorming die door het pyrimidine dimeer wordt geà ntroduceerd en vervangen de beschadigde bundel met de correcte basissen, gebruikend de onbeschadigde bundel van DNA als malplaatje. Bacteriën en andere organismen kunnen ook gebruik maken van directe reparatie, waarbij het fotolyase enzym, in aanwezigheid van zichtbaar licht, breekt de pyrimidines.
- door vergelijking van groei op de volledige plaat en gebrek aan groei op media zonder specifieke nutriënten, kunnen specifieke functieverliesmutanten, auxotrofen genaamd, worden geïdentificeerd.,
- de Ames-test is een goedkope methode waarbij auxotrofe bacteriën worden gebruikt om de Mutageniteit van een chemische verbinding te meten. Mutageniteit is een indicator van carcinogeen potentieel.
Multiple Choice
welke van de volgende is een verandering in de reeks die leidt tot de vorming van een stopcodon?
- missense mutatie
- nonsense mutatie
- stille mutatie
- deletie mutatie
de vorming van pyrimidine dimeren is het gevolg van welke van de volgende?
- spontane fouten door DNA-polymerase
- blootstelling aan gammastraling
- blootstelling aan ultraviolette straling
- blootstelling aan intercalatiemiddelen
welke van de volgende is een voorbeeld van een frameshift mutatie?
- a deletie van een codon
- missense mutatie
- stille mutatie
- deletie van één nucleotide
welke van de volgende soorten is het type DNA-herstel waarbij thymine-dimeren direct worden afgebroken door het enzymfotolyase?,
- direct repair
- nucleotide excision repair
- mismatch repair
- proeflezen
welke van de volgende waarden voor de Ames-test is waar?
- het wordt gebruikt om nieuw gevormde auxotrofe mutanten te identificeren.
- het wordt gebruikt om mutanten met herstelde biosynthetische activiteit te identificeren.
- het wordt gebruikt om spontane mutanten te identificeren.,
- het wordt gebruikt om mutanten te identificeren die geen fotoreactivatieactiviteit hebben.
vul de blanco in
een chemisch mutageen dat qua structuur lijkt op een nucleotide maar andere basispaarregels heeft, wordt ________ _ genoemd.,
het enzym dat wordt gebruikt bij lichtreparatie om thymine-dimeren te splitsen wordt ________genoemd.
het fenotype van een organisme dat het vaakst in de natuur wordt waargenomen, wordt het ________ _ genoemd.,
True / False
carcinogene agentia zijn doorgaans mutageen.
denk erover na
Waarom is het waarschijnlijker dat inserties of deleties schadelijker zijn voor een cel dan puntmutaties?,
waarom denkt u dat de Ames-test de voorkeur verdient boven het gebruik van diermodellen om chemische verbindingen op Mutageniteit te screenen?
kritisch denken
hieronder zijn verschillende DNA-sequenties die zijn gemuteerd in vergelijking met de wild-type sequentie: 3′-T A C T G A C T G A C G A T C-5′. Stel je voor dat elk een deel van een DNA-molecuul is dat is gescheiden ter voorbereiding op transcriptie, dus je ziet alleen de template streng., Construeer de complementaire DNA-sequenties (met aanduiding van 5′ en 3 ‘uiteinden) voor elke gemuteerde DNA-sequentie, schrijf dan (met vermelding van 5′ en 3’ uiteinden) de template strengen, en vertaal de mRNA-moleculen met behulp van de genetische code, waarbij de resulterende aminozuursequentie wordt geregistreerd (met vermelding van de N en C termini). Wat voor soort mutatie is elk?,>
Complementaire DNA-volgorde:
mRNA-sequentie transcriptie van sjabloon:
Aminozuur sequentie van peptide:
het Type van mutatie:
Complementaire DNA-volgorde:
mRNA-sequentie transcriptie van sjabloon:
Aminozuur sequentie van peptide:
het Type van mutatie: