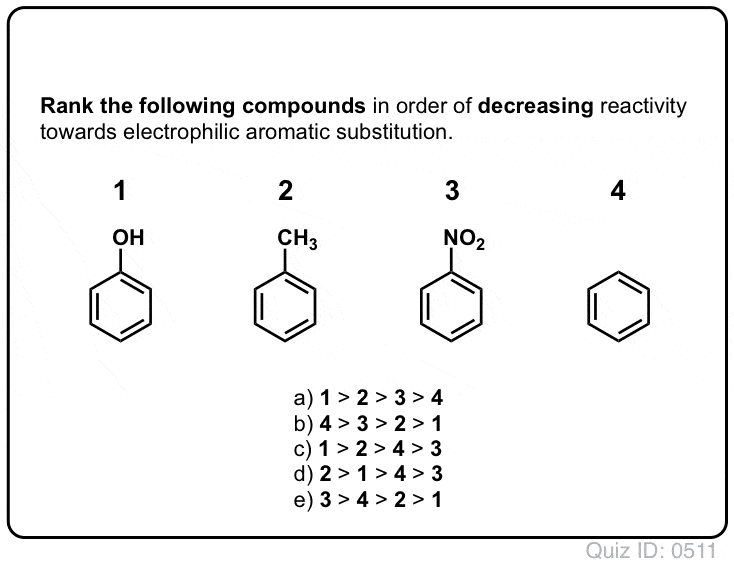
in de vorige post introduceerden we ortho -, para-en meta-directors in elektrofiele aromatische substitutie. Daarvoor bestudeerden we het mechanisme van elektrofiele aromatische substitutie, en toonden we aan dat het mechanisme verloopt via een carbocatie tussenproduct.,
vandaag gaan we deze twee concepten aan elkaar koppelen en proberen aan te tonen dat of een substituent een ortho -, para – of meta – director is, afhangt van hoe de substituent de stabiliteit van de carbocatie-intermediair beïnvloedt.
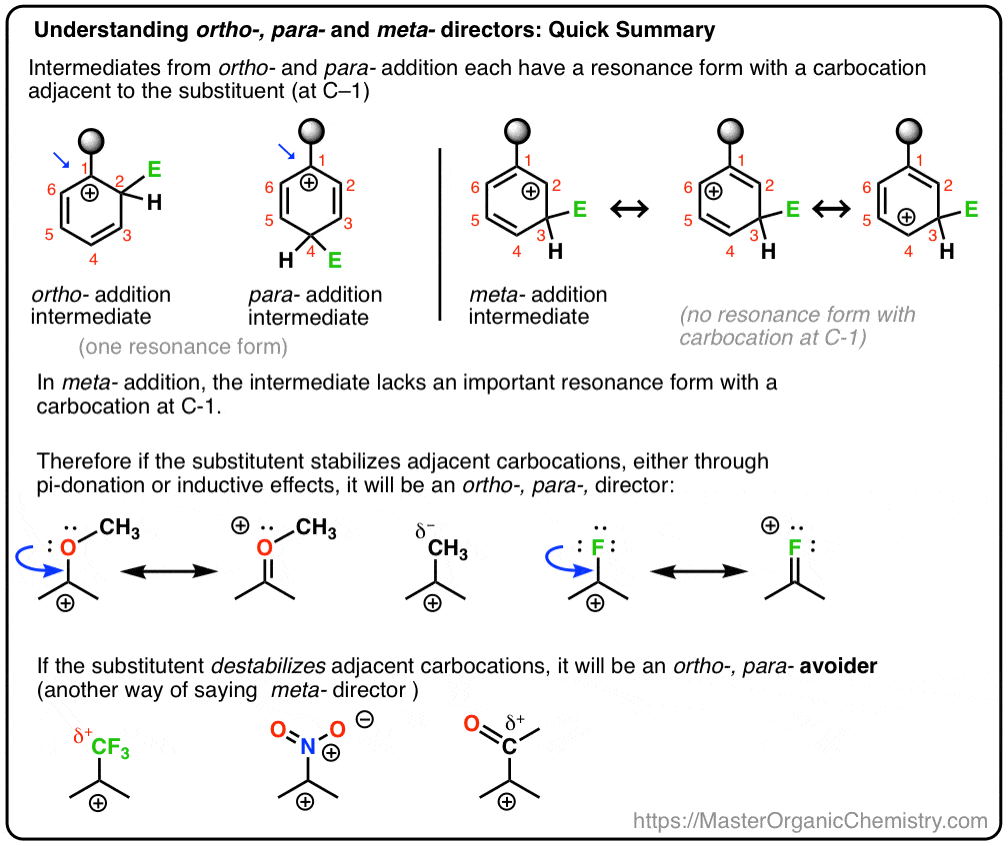
en we zullen ook zien waarom een alternatieve naam voor meta – director zou kunnen zijn, “ortho-, para – avoider”. :- )
inhoudsopgave
- carbonaten worden gestabiliseerd door aangrenzende atomen met eenzame paren
- Case Study # 1: een ortho-,para – Director (OCH3)
- ja, zuurstof is elektronegatief., Maar De Donatie Van Het Eenzame Paar Maakt Het Meer Dan Goed!
- Het reactie-Energiediagram voor een Ortho Para Director
- Case Study # 2: een meta-director (CF3).
- wat we “meta– Directors” noemen lijken meer op “ortho-, para– Avoiders”
- Het reactie – Energiediagram voor een meta-Director
- dus waarom zijn halogenen Ortho -, Para-Directors?
- Notes
- Quiz zelf!,
- (Advanced) References and Further Reading
carbonaten worden gestabiliseerd door aangrenzende atomen met eenzame paren
laten we eens terugdenken aan welke factoren de stabiliteit van carbonaten verhogen.
Carbokaties zijn elektron-arme soorten met zes elektronen in hun valentieschil. Dus, elke substituent die elektronendichtheid kan doneren naar de carbocatie zal stabiliseren. Dit omvat:
- elektron-releasing substituenten die kunnen fungeren als “sigma-donors” (bijv., vele alkylgroepen, die elektronendichtheid afstaan door inductieve effecten)
- aangrenzende atomen met eenzame paren die als “pi–donors” kunnen fungeren voor de carbocatie
- aangrenzende C-C pi-bindingen die de carbocatie kunnen stabiliseren door ladingdelokalisatie (“resonantiestabilisatie”, met andere woorden).
en factoren die carbocaties destabiliseren?
- elke substituent die elektronendichtheid uit een carbocatie verwijdert, zoals sterke elektronentrekkende groepen.
dus hier is een snelle quiz., Gezien alles wat hierboven is geschreven, welke van de twee carbocaties hieronder zal stabieler zijn?
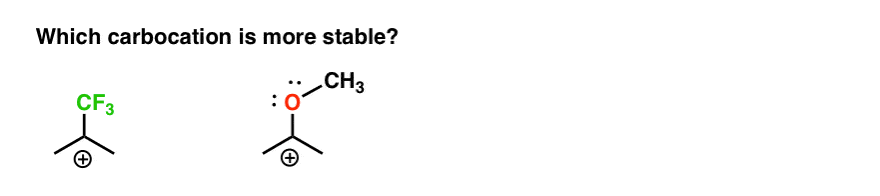
Als u deze vraag goed kunt beantwoorden, bent u het grootste deel van de manier om het verschil tussen ortho-, para – en meta – directors te begrijpen.
laten we twee casestudy ‘ s bekijken. We zullen kijken naar een generieke elektrofiele aromatische substitutiereactie van benzeen met een ortho-, para – director (methoxybenzeen) en de tussenproducten onderzoeken die worden verkregen door aanval op de ortho -, meta-en para-posities., Dan doen we dezelfde oefening met een meta– director (trifluormethylbenzeen).
In het proces hopen we te begrijpen waarom methoxybenzeen ortho – en para– producten bevoordeelt, terwijl trifluormethylbenzeen het metaproduct bevoordeelt.
Case Study # 1: een ortho-,para – Director (OCH3)
elektrofiele aromatische substitutie van methoxybenzeen heeft de neiging om ortho – en para – producten met zeer weinig meta – te produceren ., Hier is wat er gebeurt in nitratie, bijvoorbeeld:
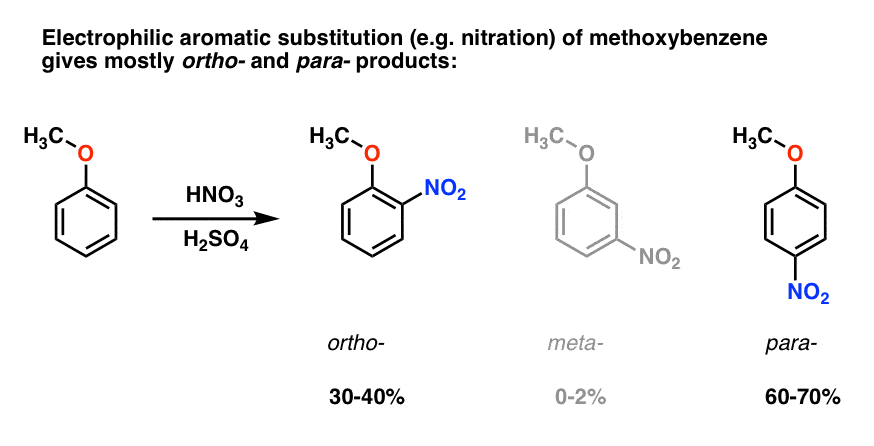
Het para – product domineert (60-70%), met ortho – dichtbij (30-40%) en slechts een spoor van de meta– .
waarom?
3. Ja, Zuurstof Is Elektronegatief. Maar De Donatie Van Het Eenzame Paar Maakt Het Meer Dan Goed!
Hier is de route die leidt naar het ortho – product., We breken een C–C pi binding en vormen een nieuwe C-E binding (waarbij E bedoeld is om een generische elektrofiel voor te stellen), waardoor een resonantie-gestabiliseerde carbocatie ontstaat:
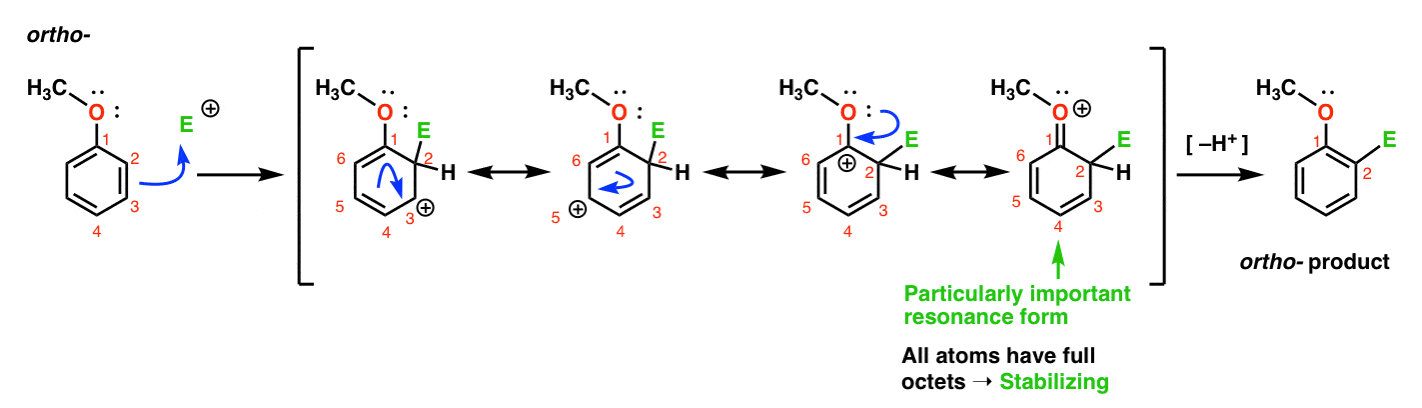
als je goed kijkt, moet je merken dat we vier resonantievormen kunnen vormen . Drie daarvan dragen volledige carbonaties (op C1, C3 en C5), maar het is de vierde – de resonantievorm waar een c=o pi – binding is-die bijzonder belangrijk is. Waarom? In deze resonantievorm hebben alle koolstofatomen een volledig octet elektronen., Dat komt omdat de zuurstof direct gebonden aan de ring een enkel paar kan doneren aan de aangrenzende carbocatie, het vormen van een pi binding. Dit is een voorbeeld van pi donatie.
Hier is de route voor aanval van de elektrofiel op de meta – positie. Let op het verschil!
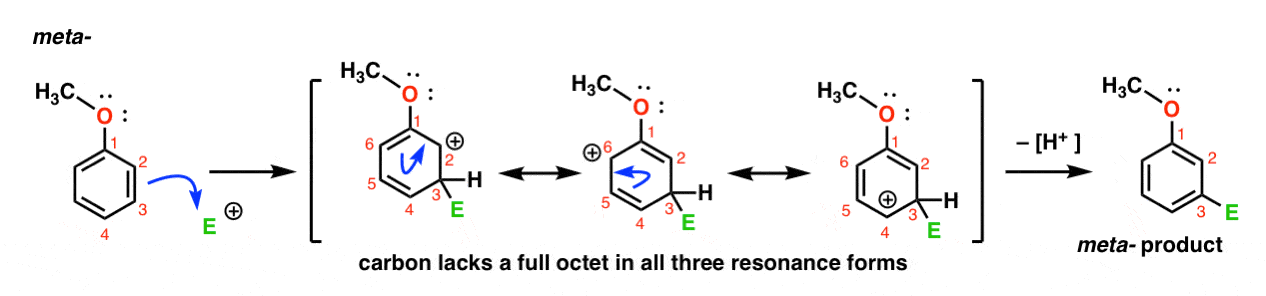
aanval van de elektrofiel op C-3 resulteert in een carbocatie die kan worden gedelokaliseerd via resonantie tot C2, C4 en C6. Er is echter geen manier om de carbocatie naar C1 te” verplaatsen”, wat betekent dat er geen redelijke resonantievorm is waar alle atomen volledige octetten hebben.,
Dit maakt het meta – carbocation-intermediair veel minder stabiel dan het ortho-carbocation-intermediair.
tenslotte is hier de reactie die leidt tot het para-product:
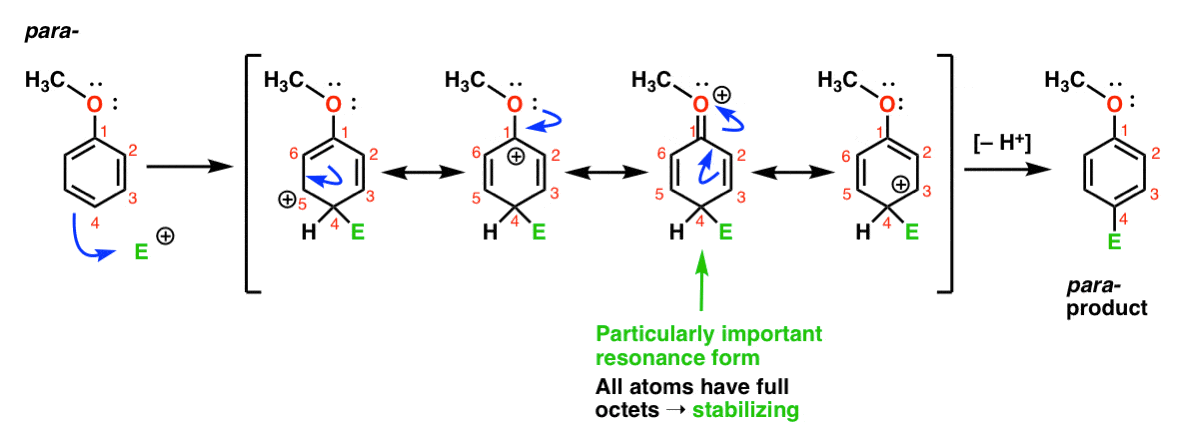
Hier kunnen we weer resonantievormen tekenen met carbocaties op C1, C3 en C5, evenals een vierde resonantievorm waarbij het bijgevoegde zuurstofatoom een elektronenpaar doneert aan de carbocatie op C1, wat resulteert in een volledig octet bij koolstof. Dit is een situatie die in wezen hetzelfde is als de ortho – intermediair.,
dus, door analyse van de resonantievormen (en let op mijn woord, je kan heel goed worden gevraagd om hetzelfde te doen op een test in de nabije toekomst) kunnen we zien dat de intermediaire carbocaties als gevolg van ortho – en para– additie aanzienlijk stabieler zijn dan de intermediaire van meta– additie.
Dit verklaart waarom ortho – en para-producten domineren en het metaproduct klein is.
Het kan nuttig zijn om dit te visualiseren door een reactie-energiediagram te tekenen.
4., Het Reactie-Energiediagram voor een Ortho Para Director
De transitietoestand die leidt tot de ortho – en para – additie producten is veel lager in energie dan de meta– .
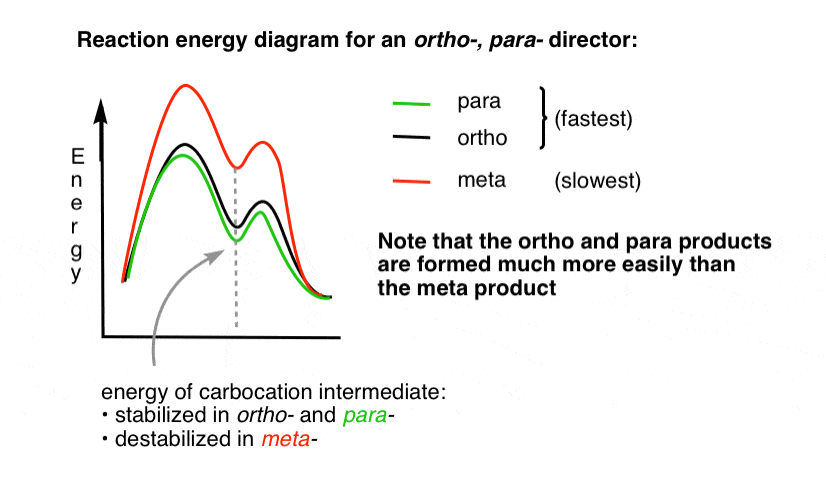
een vraag-waarom denkt u dat para-zou kunnen worden begunstigd (bijvoorbeeld 60% -70% rendement voor het para– product van nitratie, boven, versus 30-40% voor ortho -), ook al zijn er twee ortho – posities en slechts één para- ?
denk daar even over na, en we zullen het hieronder bespreken.
5. Case Study # 2: een meta-director (CF3).
dus hoe zit het met CF3?, Waarom geeft het meta-producten? Laten we hetzelfde soort analyse doen.
Hier is de route die leidt naar het ortho – product. Net als bij het ortho – tussenproduct hierboven, kunnen we drie resonantievormen tekenen die de carbocatie respectievelijk op C1, C3 en C5 plaatsen.
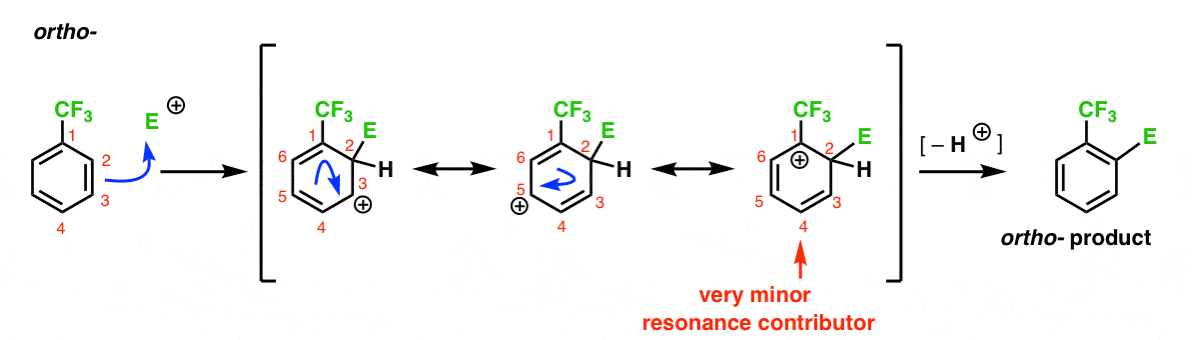
dus wat is er anders in dit geval?
wat anders is, is de aanwezigheid van een sterke elektron trekkende groep (CF3) op C1, en dit verandert het ballgame volledig.
zoals we al zeiden, worden carbokaties gedestabiliseerd door buren die elektron-dichtheid terugtrekken., Daarom zouden we verwachten dat dit een zeer kleine resonantie bijdrager is, met als resultaat dat de positieve lading alleen gedelokaliseerd wordt over C3 en C5.
we hebben opgemerkt dat CF3 een meta-director is. Het is redelijk om te denken dat er iets is met de meta– dat het bijzonder stabiel maakt. Door het analyseren van de tussenliggende voor het meta– product hieronder, kunt u zien waarom?
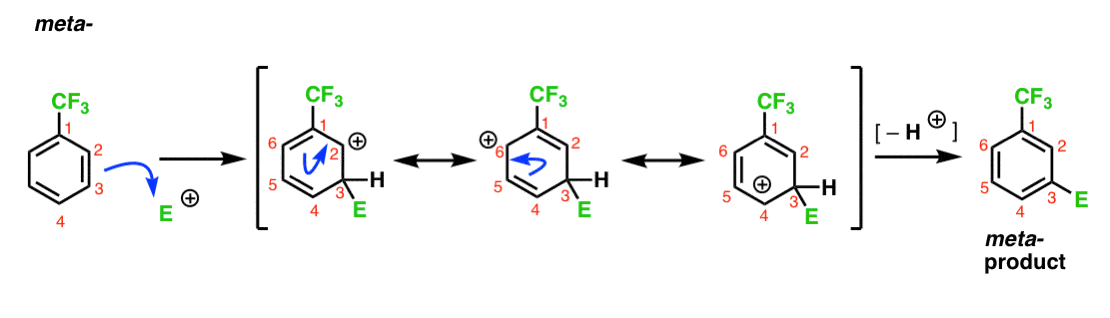
Hmmm. Er is geen tussenproduct waar een koolstof een volledig octet heeft. Er zijn geen bijzonder stabiele resonantievormen.
Het is een beetje “meh”, is het niet?
6., Wat we “meta– Directors” noemen lijken meer op “ortho-, para– Avoiders”
aan de andere kant zijn er ook geen bijzonder onstabiele resonantievormen. Aangezien de positieve lading gelokaliseerd is op C2, C4 en C6, wordt een situatie vermeden waarin de positieve lading direct grenst aan de elektron-terugtrekkende CF3 groep. En de positieve lading wordt dus mooi door de hele ring gedelokaliseerd, in tegenstelling tot in de ortho – situatie hierboven.
dus het is een” minder slechte ” intermediair dan de ortho -.,
ten slotte heeft de para – intermediair hetzelfde probleem als de ortho -; een intermediair met een positieve lading op C1, grenzend aan de CF3.
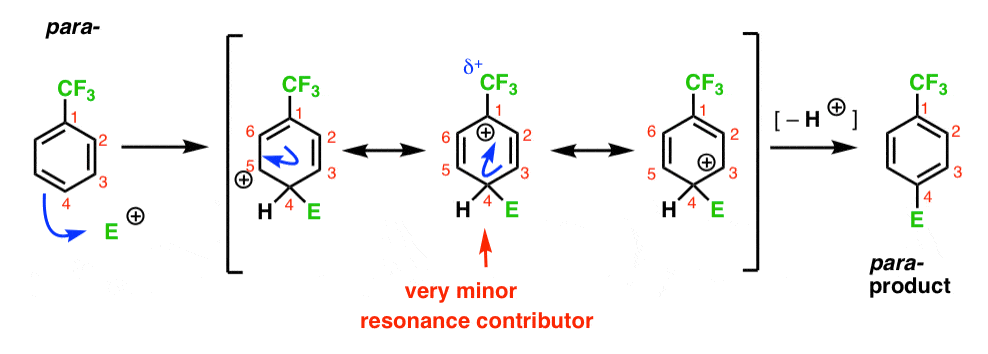
Dit resulteert in slechts twee belangrijke resonantievormen, wat leidt tot een minder gedelokaliseerde (en dus minder stabiele) carbocatie-intermediair.
Bottom line: Het metacarbocatie-tussenproduct is stabieler dan de ortho– of de para – tussenproducten.
maar het is niet omdat de substituent zelf een stabiliserend effect heeft op de meta-intermediair. .,
Ik zou zeggen dat het nuttiger is om de meta – als minder onstabiel te zien dan de ortho – en para– .
op deze manier is het niet zozeer dat CF3 een meta – director is, zozeer dat het een “ortho–, para– avoider is. “
7. Het Reactie-Energiediagram voor een meta-Director
Hier is een schets van het reactie-energiediagram:
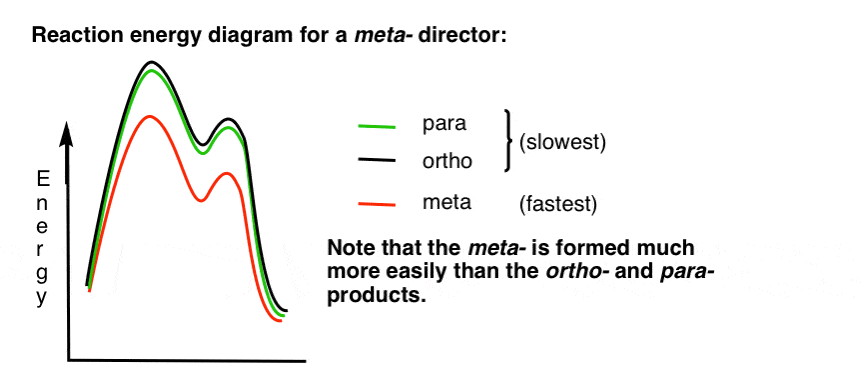
Alright.
terug naar onze oorspronkelijke vraag. Dus welke carbocatie is stabieler?,
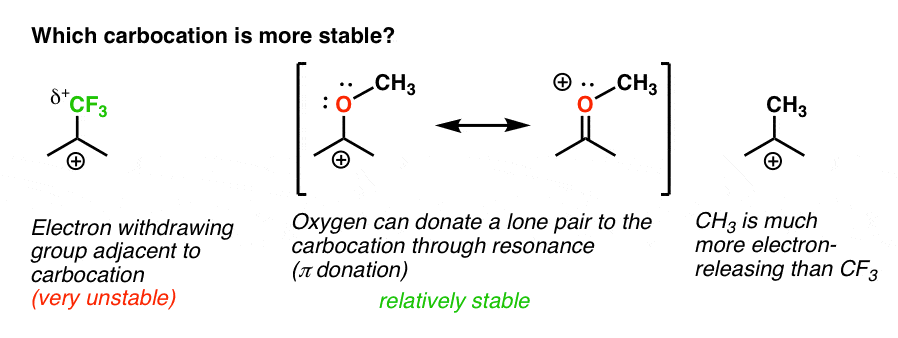
Het is duidelijk dat de carbocatie met een aangrenzend zuurstofpaar met een enkel paar veel stabieler is dan een carbocatie naast een elektron-onttrekkende groep zoals CF3.
en dat omvat het verschil tussen een ortho-, para – director zoals OCH3 en een meta – director zoals CF3.
Het is vermeldenswaard dat de meeste alkylgroepen (zoals CH3 ) geen enkel paar hebben, maar nog steeds ortho-, para – directors zijn., Dit is in overeenstemming met alles wat we eerder hebben geleerd over hoe alkylgroepen over het algemeen stabiliseren voor carbokaties – bedenk dat de carbokatiestabiliteit over het algemeen toeneemt met substitutie
dus over die para– producten…
Waarom worden para – producten geproduceerd met een grotere snelheid dan ortho- ?
het antwoord is sterische hinder.
aanval op de para positie is minder bezwaard door de substituent dan aanval op de ortho – posities zijn.
dus waarom zijn halogenen Ortho -, Para-Directors?
Dit laat ons met het ietwat lastige voorbeeld van halogenen.,
Waarom zijn fluor, chloor, broom en jodium ortho -, para – directors, ook al zijn ze deactiverende groepen?
het antwoord zal niet als een verrassing komen als je mee hebt gevolgd, maar we gaan dit laten tot de volgende post, omdat deze al lang genoeg is.Next post: Waarom zijn halogenen ortho -, para-regisseurs?
noten
Noot 1. Het is correcter om te zeggen dat ortho – en para – producten domineren omdat de transitietoestanden die tot deze producten leiden lager zijn in energie, in plaats van de energieën van de tussenproducten zelf., Het is immers de energie van de transitietoestanden die de activeringsbarrière bepaalt, en dus de reactiesnelheid.
noot 2. Of hyperconjugatie, die de meeste studieboeken (met de opmerkelijke uitzondering van Maitland Jones) over het algemeen vermijden.
Quiz zelf!,/div>
 Klik op Spiegelen
Klik op Spiegelen

 Klik op Spiegelen
Klik op Spiegelen 
 Klik op Spiegelen
Klik op Spiegelen 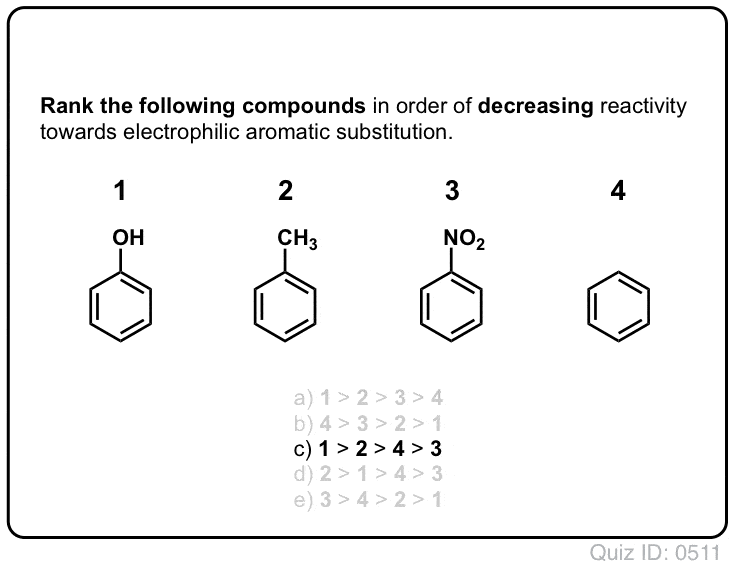
 Klik op Spiegelen
Klik op Spiegelen 
(Geavanceerd) Referenties en Verder Lezen
- A., F. Holleman, Die direkte Einführung von Substituenten in den Benzolkern
Rec. Trav. Chim. Pays-Bas 1910, 12, 455-456 DOI: 10.1002/recl.19100291205
A. F Holleman uit 1910 zei dat ortho-para oriëntatie geassocieerd is met activering en meta oriëntatie met deactivering. - – de aard van het wisselende effect in koolstofketens. Deel XXIII. abnormale oriëntatie door halogenen, en zijn invloed op het probleem van de ortho-para verhouding,in aromatische substitutie Christopher Kelk Ingold en Charles Cyril Norrey Vass J. Chem. Soc. 1928, 417-425 DOI: 10.,1039 / JR9280000417 dit artikel bespreekt de richtingseffecten in 1,2-dihalobenzenen.enkele waarnemingen betreffende sterische hinder en de effecten van substituenten op de ortho: para ratio in aromatische substitutie P. B. D. De la Mare J. Chem. Soc. 1949, 2871-2874
DOI: 10.1039/JR9490002871
In dit artikel bespreekt de la Mare verschillende factoren die een overwicht van para boven ortho selectiviteit kunnen verklaren, na het delen van de opbrengst van ortho product door 2 (aangezien er 2 ortho posities zijn maar slechts 1 para positie in monosubstituted benzenen)., - Volumeeffecten van alkylgroepen in aromatische verbindingen. Deel V. De monosulfonatie van p-cymeen R. J. W. Le Fèvre J. Chem. Soc. 1934, 1501-1502
DOI: 10.1039 / JR9340001501
In p-cymeen is het belangrijkste product verkregen na elektrofiele sulfonering het 2-product (ortho aan de methylgroep), waarschijnlijk te wijten aan sterica. - effecten van alkylgroepen in elektrofiele toevoegingen en substituties
COHN, H., HUGHES, E., JONES, M. and PEELING, M. G.
Nature 1952, 169, 291
DOI: 1038/169291a0
Dit artikel bevat gegevens die de nitratie van t-butylbenzeen en tolueen vergelijken., T-butylbenzeen is veel meer p-gericht dan tolueen (79,5% para voor t-butylbenzeen versus 40% para voor tolueen), wat waarschijnlijk te wijten is aan sterics (ortho benadering wordt geblokkeerd door de grotere t-butylgroep). - verdeling van isomeren in de Mononitratie van Ethyl – en Isopropylbenzeen. Further Evidence for a Steric Effect in Isomer Distribution Herbert C. Brown and W. Hallam Bonner Journal of the American Chemical Society 1954, 76 (2), 605-606 DOI: 10.,1021 / ja01631a084
tabel II in dit document illustreert dat het orthoproduct verkregen door nitratie van monoalkylbenzenen afneemt naarmate de alkylgroep groter wordt (zo levert t-butylbenzeen bij nitratie zeer weinig orthoproduct op vergeleken met tolueen). - – de aard van het wisselende effect in koolstofketens. Part XXII. An attempt further to define the probable mechanism of orientation in aromatic substitution Christopher Kelk Ingold and Florence Ruth Shaw J. Chem. Soc. 1927, 2918-2926 DOI: 10.,1039 / JR9270002918 een vroeg artikel van de invloedrijke Fysisch-organische chemicus, Prof. C. K. Ingold, waarin staat dat halogeenbenzenen inductief elektron-terugtrekkend zijn maar tegelijkertijd resonantiestabiliserend.de abnormale reactiviteit van Fluorbenzeen in elektrofiele aromatische substitutie en aanverwante verschijnselen Joel Rosenthal en David I., Schuster Journal of Chemical Education 2003, 80 (6), 679 DOI: 1021/ed080p679 een zeer interessante paper, geschikt voor nieuwsgierige studenten, en bespreekt iets dat de meeste praktiserende organische chemici empirisch zullen kennen – fluorbenzeen is bijna net zo reactief als benzeen in EAS of Friedel-Crafts reacties, wat contra-intuïtief is wanneer men elektronische effecten beschouwt!
- Organic chemistry
N. Haworth, C. K. Ingold, T. A. Henry
Ann. Rep.Prog. Scheikunde. 1926, 23, 74-185
DOI: 10.1039 / AR9262300074
An early paper discussing directing effects in EAS. Pp., 136 en 137 bevatten figuren die de stroom van elektronen weergeven. Pg. 140 bespreekt meta-richting, die om de ‘tegengestelde’ redenen optreedt als o / p-richting door alkylgroepen.