hoe elementen met elkaar interageren hangt af van hoe hun elektronen zijn gerangschikt en hoeveel openingen voor elektronen er bestaan in het buitenste gebied waar elektronen aanwezig zijn in een atoom. Elektronen bestaan op energieniveaus die schelpen rond de kern vormen. De dichtstbijzijnde schil kan maximaal twee elektronen bevatten. De dichtstbijzijnde schelp bij de kern wordt altijd eerst gevuld, voordat een andere schelp kan worden gevuld. Waterstof heeft één elektron; daarom heeft het slechts één plek bezet binnen de laagste schil., Helium heeft twee elektronen; daarom kan het de onderste schil volledig vullen met zijn twee elektronen. Als je naar het periodiek systeem kijkt, zul je zien dat waterstof en helium de enige twee elementen in de eerste rij zijn. Dit komt omdat ze alleen elektronen in hun eerste schil hebben. Waterstof en helium zijn de enige twee elementen die de laagste schelp hebben en geen andere schelpen.
de tweede en derde energieniveaus kunnen tot acht elektronen bevatten. De acht elektronen zijn gerangschikt in vier paren en één positie in elk paar wordt gevuld met een elektron voordat om het even welke paren worden voltooid.,
als je weer naar het periodiek systeem kijkt (figuur 1), zul je zien dat er zeven rijen zijn. Deze rijen komen overeen met het aantal schelpen dat de elementen binnen die rij hebben. De elementen binnen een bepaalde rij hebben toenemende aantallen elektronen als de kolommen van links naar rechts gaan. Hoewel elk element hetzelfde aantal schelpen heeft, zijn niet alle schelpen volledig gevuld met elektronen. Als je kijkt naar de tweede rij van het periodiek systeem, vind je lithium (Li), beryllium (Be), borium (B), koolstof (C), stikstof (N), zuurstof (O), fluor (F) en neon (Ne)., Deze hebben allemaal elektronen die alleen de eerste en tweede schelpen bezetten. Lithium heeft slechts één elektron in zijn buitenste schil, beryllium heeft twee elektronen, boor heeft drie, enzovoort, totdat de hele schil is gevuld met acht elektronen, zoals het geval is met neon.
niet alle elementen hebben genoeg elektronen om hun buitenste schil te vullen, maar een atoom is het best stabiel wanneer alle elektronposities in de buitenste schil gevuld zijn., Door deze vacatures in de buitenste schillen zien we de vorming van chemische bindingen, of interacties tussen twee of meer van dezelfde of verschillende elementen die resulteren in de vorming van moleculen. Om meer stabiliteit te bereiken, zullen atomen de neiging hebben om hun buitenste schillen volledig te vullen en zullen ze zich binden met andere elementen om dit doel te bereiken door elektronen te delen, elektronen van een ander atoom te accepteren, of elektronen te doneren aan een ander atoom., Omdat de buitenste schillen van de elementen met lage atoomnummers (tot calcium, met atoomnummer 20) acht elektronen kunnen bevatten, wordt dit de octetregel genoemd. Een element kan elektronen doneren, accepteren of delen met andere elementen om zijn buitenste schil te vullen en aan de octetregel te voldoen.
wanneer een atoom geen gelijke aantallen protonen en elektronen bevat, wordt het een ion genoemd. Omdat het aantal elektronen niet gelijk is aan het aantal protonen, heeft elk ion een netto lading. Positieve ionen worden gevormd door het verliezen van elektronen en worden kationen genoemd., Negatieve ionen worden gevormd door het verkrijgen van elektronen en worden anionen genoemd.
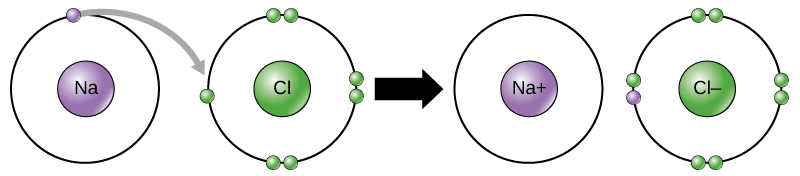
natrium heeft bijvoorbeeld maar één elektron in zijn buitenste schil. Het kost minder energie voor natrium om dat ene elektron te doneren dan het doet om zeven elektronen meer te accepteren om de buitenste schil te vullen. Als natrium een elektron verliest, heeft het nu 11 protonen en slechts 10 elektronen, waardoor het een totale lading van +1 heeft. Het wordt nu een natriumion genoemd.
het chlooratoom heeft zeven elektronen in zijn buitenste schil. Nogmaals, het is energiezuiniger voor chloor om één elektron te winnen dan om zeven te verliezen., Daarom heeft het de neiging om een elektron te krijgen om een ion met 17 protonen en 18 elektronen te creëren, waardoor het een netto negatieve (-1) lading krijgt. Het wordt nu een chloride-ion genoemd. Deze beweging van elektronen van het ene element naar het andere wordt aangeduid als elektronenoverdracht. Zoals figuur 1 illustreert, heeft een natriumatoom (Na) slechts één elektron in zijn buitenste schil, terwijl een chlooratoom (Cl) zeven elektronen in zijn buitenste schil heeft. Een natriumatoom zal zijn ene elektron afstaan om zijn schil te legen, en een chlooratoom zal dat elektron accepteren om zijn schil te vullen, waardoor het chloride wordt., Beide ionen voldoen nu aan de octetregel en hebben volledige buitenste schillen. Omdat het aantal elektronen niet meer gelijk is aan het aantal protonen, is elk nu een ion en heeft een +1 (natrium) of -1 (chloride) lading.

ionische bindingen
Er zijn vier soorten bindingen of interacties: Ionische, covalente, waterstofbindingen en van der Waals interacties. Ionische en covalente bindingen zijn sterke interacties die een grotere energie-input vereisen om uit elkaar te breken. Wanneer een element een elektron uit zijn buitenste schil doneert, zoals in het voorbeeld van het natriumatoom hierboven, wordt een positief ion gevormd (Figuur 2). Het element dat het elektron accepteert is nu negatief geladen., Omdat positieve en negatieve ladingen aantrekken, blijven deze ionen bij elkaar en vormen ze een ionbinding, of een binding tussen ionen. De elementen verbinden zich met het elektron van het ene element dat voornamelijk met het andere element blijft. Wanneer Na+ en Cl– ionen samen NaCl produceren, blijft een elektron uit een natriumatoom bij de andere zeven uit het chlooratoom, en trekken de natrium-en chloride-ionen elkaar aan in een rooster van ionen met een netto nullading.,
covalente bindingen
een ander type sterke chemische binding tussen twee of meer atomen is een covalente binding. Deze bindingen vormen wanneer een elektron wordt gedeeld tussen twee elementen en zijn de sterkste en meest voorkomende vorm van chemische binding in levende organismen. Er ontstaan covalente bindingen tussen de elementen waaruit de biologische moleculen in onze cellen bestaan., In tegenstelling tot ionenbindingen scheiden covalente bindingen niet in water.interessant is dat chemici en biologen de bindingssterkte op verschillende manieren meten. Chemici meten de absolute sterkte van een binding (de theoretische sterkte) terwijl biologen meer geïnteresseerd zijn in hoe de binding zich gedraagt in een biologisch systeem, dat meestal waterig is (op basis van water). In water komen ionenbindingen veel sneller uit elkaar dan covalente bindingen, dus biologen zouden zeggen dat ze zwakker zijn dan covalente bindingen. Als je in een scheikundeboek kijkt, zie je iets anders., Dit is een geweldig voorbeeld van hoe dezelfde informatie kan leiden tot verschillende antwoorden, afhankelijk van het perspectief dat u het bekijkt vanuit.
de waterstof-en zuurstofatomen die samen watermoleculen vormen, worden met elkaar verbonden door covalente bindingen. Het elektron van het waterstofatoom verdeelt zijn tijd tussen de buitenste schil van het waterstofatoom en de onvolledige buitenste schil van het zuurstofatoom. Om de buitenste schil van een zuurstofatoom volledig te vullen, zijn twee elektronen van twee waterstofatomen nodig, vandaar het subscript ” 2 ” in H2O., De elektronen worden gedeeld tussen de atomen, het verdelen van hun tijd tussen hen te “vullen” de buitenste schil van elk. Dit delen is een lagere energietoestand voor alle betrokken atomen dan als ze bestonden zonder hun buitenste schillen gevuld.
Er zijn twee soorten covalente bindingen: polair en niet-polair. Niet-polaire covalente bindingen vormen zich tussen twee atomen van hetzelfde element of tussen verschillende elementen die de elektronen gelijkelijk delen. Bijvoorbeeld, een zuurstofatoom kan zich binden met een ander zuurstofatoom om hun buitenste schillen te vullen., Deze associatie is niet-polair omdat de elektronen gelijk verdeeld worden over elk zuurstofatoom. Twee covalente bindingen vormen zich tussen de twee zuurstofatomen omdat zuurstof twee gedeelde elektronen nodig heeft om zijn buitenste schil te vullen. Stikstofatomen vormen drie covalente bindingen (ook wel triple covalent genoemd) tussen twee stikstofatomen omdat elk stikstofatoom drie elektronen nodig heeft om zijn buitenste schil te vullen. Een ander voorbeeld van een niet-polaire covalente binding wordt gevonden in het methaanmolecuul (CH4). Het koolstofatoom heeft vier elektronen in zijn buitenste schil en heeft er nog vier nodig om het te vullen., Het krijgt deze vier van vier waterstofatomen, elk atoom levert er één. Deze elementen delen alle de elektronen gelijkelijk, waardoor Vier niet-polaire covalente bindingen ontstaan (Figuur 3).
in een polaire covalente binding brengen de elektronen die door de atomen worden gedeeld, meer tijd dichter bij de ene kern dan bij de andere kern door. Door de ongelijke verdeling van elektronen tussen de verschillende kernen ontstaat een licht positieve (δ+) of licht negatieve (δ–) lading. De covalente bindingen tussen waterstof-en zuurstofatomen in water zijn polaire covalente bindingen., De gedeelde elektronen besteden meer tijd in de buurt van de zuurstofkern, waardoor het een kleine negatieve lading, dan ze besteden in de buurt van de waterstofkernen, waardoor deze moleculen een kleine positieve lading.

waterstofbindingen
Ionische en covalente bindingen zijn sterke bindingen die aanzienlijke energie nodig hebben om te breken. Echter, niet alle bindingen tussen elementen zijn ionische of covalente bindingen. Zwakkere bindingen kunnen zich ook vormen. Dit zijn attracties die zich voordoen tussen positieve en negatieve ladingen die niet veel energie nodig hebben om te breken. Twee zwakke bindingen die vaak voorkomen zijn waterstofbindingen en van der Waals interacties. Deze bindingen geven aanleiding tot de unieke eigenschappen van water en de unieke structuren van DNA en eiwitten.,
wanneer polaire covalente bindingen een waterstofatoomvorm bevatten, heeft het waterstofatoom in die bindingen een licht positieve lading. Dit komt omdat het gedeelde elektron sterker naar het andere element wordt getrokken en weg van de waterstofkern. Omdat het waterstofatoom licht positief is (δ+), wordt het aangetrokken door aangrenzende negatieve deelladingen (δ–). Wanneer dit gebeurt, treedt een zwakke interactie op tussen de δ+ lading van het waterstofatoom van één molecuul en de δ– lading van de andere molecule. Deze interactie wordt een waterstofbinding genoemd., Dit type binding is gebruikelijk; bijvoorbeeld, de vloeibare aard van water wordt veroorzaakt door de waterstofbindingen tussen watermoleculen (Figuur 4). Waterstofbruggen geven water de unieke eigenschappen die leven in stand houden. Zonder waterstofbinding zou water eerder een gas dan een vloeistof zijn bij kamertemperatuur.

waterstofbindingen kunnen ontstaan tussen verschillende moleculen en ze hoeven niet altijd een watermolecuul te bevatten. Waterstofatomen in polaire bindingen binnen een molecuul kunnen bindingen vormen met andere aangrenzende moleculen. Bijvoorbeeld, houden de waterstofbanden twee lange bundels van DNA samen om de molecuul van DNA zijn kenmerkende double-stranded structuur te geven. De waterstofbanden zijn ook verantwoordelijk voor sommige van de driedimensionale structuur van proteã nen.,
van der Waals interacties
net als waterstofbindingen zijn van der Waals interacties zwakke aantrekkingen of interacties tussen moleculen. Ze komen voor tussen polaire, covalent gebonden atomen in verschillende moleculen. Sommige van deze zwakke aantrekkingen worden veroorzaakt door tijdelijke gedeeltelijke ladingen gevormd wanneer elektronen bewegen rond een kern. Deze zwakke interacties tussen moleculen zijn belangrijk in biologische systemen.