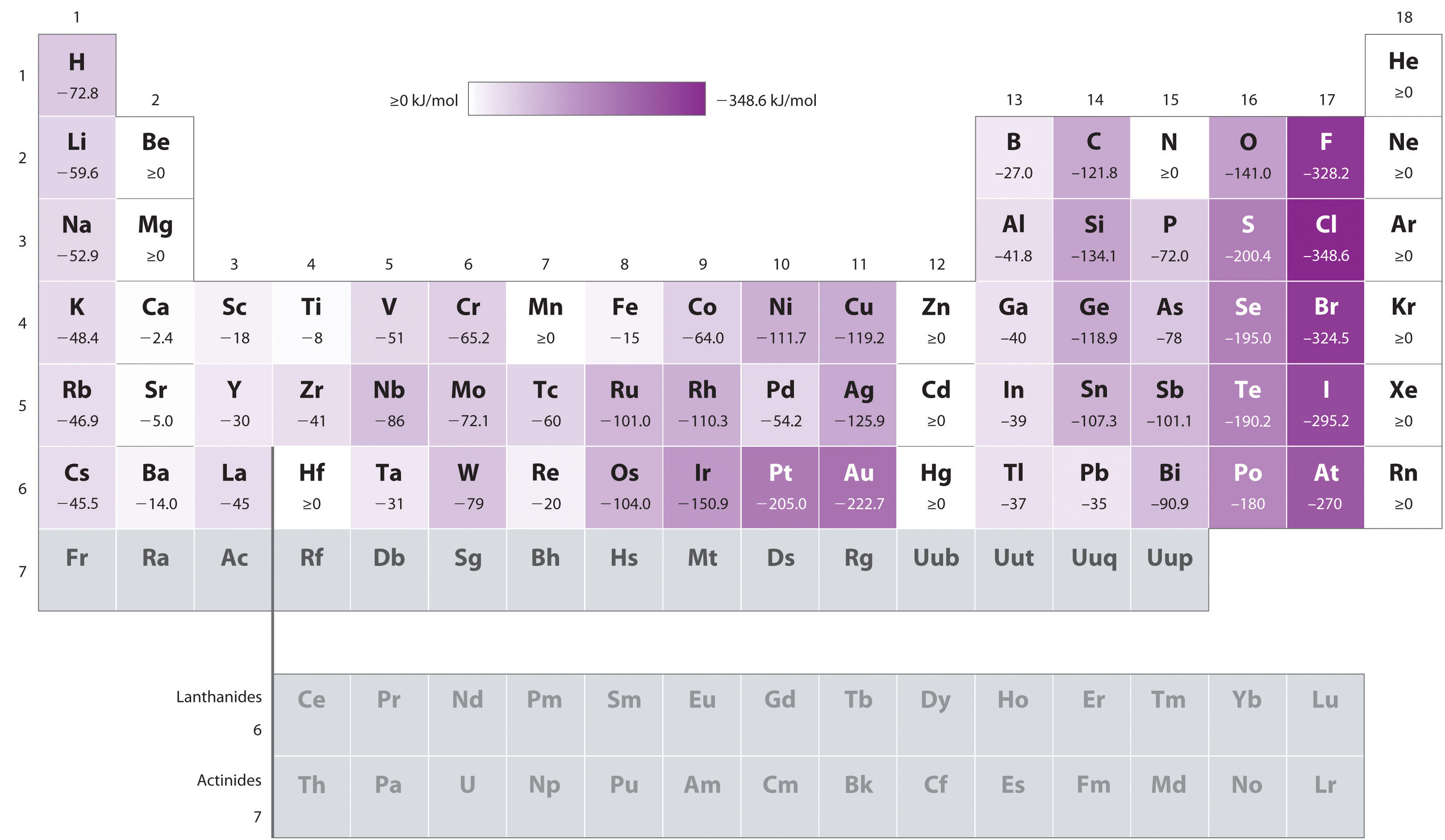
os Átomos com maiores raios, que têm as mais baixas energias de ionização (afinidade para os seus próprios elétrons de valência), também temos a menor afinidade de um elétron. Existem, no entanto, duas grandes exceções a esta tendência:
- as afinidades elétricas dos elementos B A F na segunda linha da tabela periódica são menos negativas do que as dos elementos imediatamente abaixo deles na terceira linha., Aparentemente, o aumento das repulsões elétron–elétrons experimentadas por elétrons confinados aos orbitais 2p relativamente pequenos superam a maior atração do núcleo elétron a curtas distâncias nucleares. O flúor, portanto, tem uma menor afinidade para um elétron adicionado do que o cloro. Consequentemente, os elementos da terceira linha (n = 3) têm as afinidades elétricas mais negativas. Mais abaixo em uma coluna, a atração por um elétron adicionado diminui porque o elétron está entrando em uma órbita mais distante do núcleo., As repulsões elétrons-elétrons também diminuem porque os elétrons de Valência ocupam um maior volume de espaço. Estes efeitos tendem a cancelar um ao outro, de modo que as mudanças na afinidade eletrônica dentro de uma família são muito menores do que as mudanças na energia de ionização.as afinidades elétricas dos metais alcalinos da terra tornam-se mais negativas de Be a Ba. A separação de energia entre o NS2 preenchido e as sub-células NP vazias diminui com o aumento n, de modo que a formação de um ânion a partir dos elementos mais pesados se torna energeticamente mais favorável.,
As equações para o segundo e maior de elétrons afinidades são análogas àquelas para o segundo e maiores energias de ionização:
\
\
Como vimos, a primeira afinidade eletrônica pode ser maior do que ou igual a zero ou negativo, dependendo da configuração eletrônica do átomo. Em contraste, a segunda afinidade eletrônica é sempre positiva porque o aumento das repulsões elétron–elétrons em um dianion são muito maiores do que a atração do núcleo para os elétrons extras., Por exemplo, a primeira afinidade eletrônica do oxigênio é -141 kJ/mol, mas a segunda afinidade eletrônica é +744 kJ/mol:
\
\
Assim, a formação de um gasosa de óxido (\(S^{2−}\)) íon é energeticamente muito desfavorável (estimado pela adição de ambas as etapas):
\
Enquanto o primeiro elétron de afinidades pode ser negativo, positivo ou zero, segundo elétron afinidades são sempre positivos.,
Se a energia é necessária para formar tanto positivamente carregada catiões e monoatômicos poliânions, por que os compostos iónicos como \(MgO\), \(Na_2S\) e \(Na_3P\) formulário em tudo? O fator chave na formação de compostos iônicos estáveis é as interações eletrostáticas favoráveis entre os catiões e os aniões no sal cristalino.
exemplo \(\PageIndex{1}\): contrastando Afinidades elétricas de Sb, Se, e Te
com base nas suas posições na tabela periódica, qual de Sb, Se, ou Te você prevê ter a afinidade eletrônica mais negativa?,
Dado: três elementos
Perguntado: elemento com mais afinidade eletrônica negativa
a Estratégia:
- Localizar os elementos na tabela periódica. Use as tendências em afinidades elétricas descendo uma coluna para elementos do mesmo grupo. Da mesma forma, use as tendências de Afinidades elétricas da esquerda para a direita para elementos na mesma linha.
- coloque os elementos em ordem, listando primeiro o elemento com afinidade eletrônica mais negativa.,
Solução:
Nós sabemos que o elétron afinidades tornam-se menos negativa em uma coluna (exceto para o anomalously de elétrons de baixa afinidade dos elementos da segunda linha), então podemos prever que a afinidade eletrônica do Sudeste é mais negativo do que o de Te. Também sabemos que as afinidades elétricas se tornam mais negativas da esquerda para a direita ao longo de uma linha, e que os elementos do grupo 15 tendem a ter valores menos negativos do que o esperado., Como Sb está localizado à esquerda de Te e pertence ao grupo 15, prevemos que a afinidade eletrônica de Te é mais negativa do que a de Sb. The overall order is Se < Te< Sb, so Se has the most negative electron affinity among the three elements.