primeiro é que você precisa saber o número de elétrons de Valência. Você pode fazer isso (1) desenhando a configuração eletrônica por elemento ou (2) consultando sua tabela periódica.,
Se você escolheu para desenhar a configuração eletrônica por elemento, você vai ter algo parecido com isto:
#N# (número atômico = 7) : #1s^2# #cor (vermelha) (2^2)# #cor (vermelho) (2p^3)# (5 ultraperiféricas elétrons)
#S# (número atômico = 8) : #1s^2# #cor (vermelha) (2^2)# #cor (vermelho) (2p^4)# (6 ultraperiféricas elétrons)
Se você escolheu para consultar a sua tabela periódica, apenas observe que #N# pertencem ao Grupo 5A enquanto #S# pertence ao Grupo 6A. O grupo número indica o número de ultraperiféricas elétrons.,
Agora que você sabe o número de elétrons de valência por elemento, você precisa calcular o total de elétrons de valência para a #NO_3^”-1″# ion.
5 + (3 x 6) = 23 electrões
mas uma vez que a molécula inteira tem uma carga-1, é necessário adicionar esta também. Então o número total de elétrons de Valência é de 24.
a próxima coisa a fazer é desenhar. Normalmente, o primeiro elemento da fórmula química é o átomo central. Neste caso, o átomo #N# está sendo cercado por três #o# átomos.,
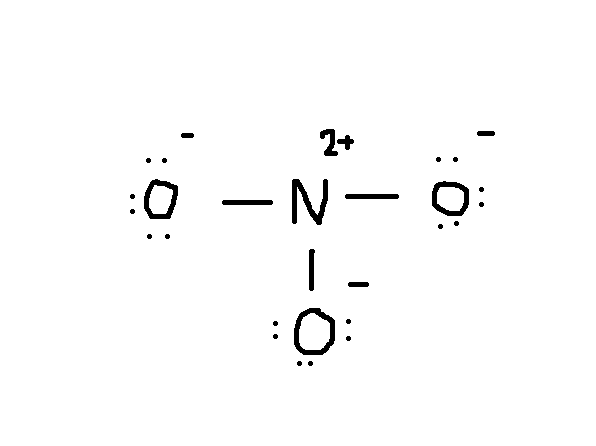
Notice that the lone pair of electrons from #O# are also included in the diagram. Se você contar o número total de elétrons no desenho acima, já são 24 elétrons (uma única linha conta como 2 elétrons). Mas este desenho violou a regra dos octetos, uma vez que o átomo central só tem 6 electrões em vez do número correcto 8. Então o que fazer?adiciona outra ligação, mas onde?,
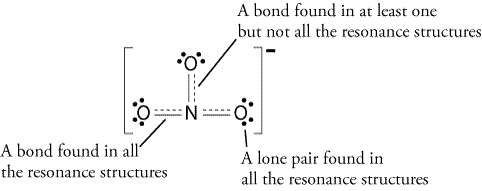
Portanto, a ressonância, a estrutura ficaria assim: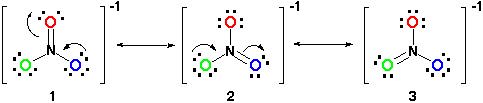
Todas as estruturas de ressonância são corretas, pois todos segue a regra do octeto e todos têm um número total de 24 elétrons. Note que a única ligação em movimento é a ligação pi (#pi#) ou em termos leigos, a ligação dupla e um dos pares de elétrons do átomo #o#.