como os elementos interagem entre si depende de como os seus electrões são dispostos e de quantas aberturas de electrões existem na região mais externa onde os electrões estão presentes num átomo. Os elétrons existem em níveis de energia que formam conchas ao redor do núcleo. A concha mais próxima pode aguentar até dois electrões. A concha mais próxima do núcleo é sempre preenchida primeiro, antes que qualquer outra concha possa ser preenchida. O hidrogênio tem um elétron; portanto, tem apenas um ponto ocupado dentro da camada mais baixa., O hélio tem dois elétrons; portanto, ele pode preencher completamente a camada mais baixa com seus dois elétrons. Se você olhar para a tabela periódica, você verá que hidrogênio e hélio são os únicos dois elementos na primeira linha. Isso é porque eles só têm elétrons em sua primeira concha. Hidrogênio e hélio são os únicos dois elementos que têm a camada mais baixa e nenhuma outra camada.
O segundo e terceiro níveis de energia podem aguentar até oito elétrons. Os oito elétrons são dispostos em quatro pares e uma posição em cada par é preenchida com um elétron antes de quaisquer pares serem completados.,
olhando para a tabela periódica novamente (Figura 1), você vai notar que existem sete linhas. Estas linhas correspondem ao número de conchas que os elementos dentro dessa linha têm. Os elementos dentro de uma linha particular têm um número crescente de elétrons à medida que as colunas vão da esquerda para a direita. Embora cada elemento tenha o mesmo número de conchas, nem todas as conchas estão completamente cheias de elétrons. Se você olhar para a segunda linha da tabela periódica, você vai encontrar de lítio (Li), berílio (be), boro (B), carbono (C), nitrogênio (N), oxigênio (O), flúor (F), e néon (Ne)., Todos eles têm elétrons que ocupam apenas a primeira e segunda conchas. O lítio tem apenas um elétron em sua concha externa, berílio tem dois elétrons, boro tem três, e assim por diante, até que toda a concha esteja cheia de oito elétrons, como é o caso do néon.
nem todos os elementos têm elétrons suficientes para preencher suas conchas mais externas, mas um átomo está no seu mais estável quando todas as posições elétricas na concha mais externa são preenchidas., Por causa destas vagas nas conchas exteriores, vemos a formação de ligações químicas, ou interações entre dois ou mais dos mesmos ou diferentes elementos que resultam na formação de moléculas. Para alcançar maior estabilidade, os átomos tenderão a preencher completamente suas conchas externas e se ligarão com outros elementos para alcançar esse objetivo compartilhando elétrons, aceitando elétrons de outro átomo, ou doando elétrons para outro átomo., Como as camadas mais exteriores dos elementos com números atômicos baixos (até cálcio, com número atômico 20) podem conter oito elétrons, isso é referido como a Regra do octeto. Um elemento pode doar, aceitar ou compartilhar elétrons com outros elementos para preencher sua concha exterior e satisfazer a Regra do octeto.
Quando um átomo não contém números iguais de prótons e elétrons, é chamado de íon. Como o número de elétrons não é igual ao número de prótons, cada íon tem uma carga líquida. Íons positivos são formados pela perda de elétrons e são chamados catiões., Íons negativos são formados pela obtenção de elétrons e são chamados aniões.
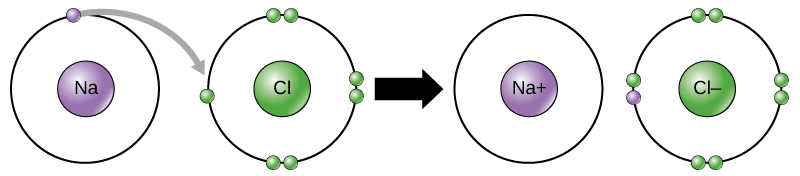
por exemplo, o sódio tem apenas um electrão na sua concha mais externa. É preciso menos energia para o sódio doar um electrão do que para aceitar mais sete electrões para preencher a concha exterior. Se o sódio perde um elétron, ele agora tem 11 prótons e apenas 10 elétrons, deixando – o com uma carga global de +1. É agora chamado de íon de sódio.
O átomo de cloro tem sete electrões na sua camada exterior. Mais uma vez, é mais energeticamente eficiente para o cloro ganhar um elétron do que perder sete., Portanto, tende a ganhar um elétron para criar um íon com 17 prótons e 18 elétrons, dando-lhe uma carga negativa líquida (-1). É agora chamado de íon cloreto. Este movimento de elétrons de um elemento para outro é referido como transferência de elétrons. Como a Figura 1 ilustra, um átomo de sódio (Na) tem apenas um elétron em sua concha mais externa, enquanto um átomo de cloro (Cl) tem sete elétrons em sua concha mais externa. Um átomo de sódio doará o seu um electrão para esvaziar a sua concha, e um átomo de cloro aceitará esse electrão para encher a sua concha, tornando-se cloreto., Ambos os íons agora satisfazem a Regra do octeto e têm conchas exteriores completas. Porque o número de elétrons não é mais igual ao número de prótons, cada um é agora um íon e tem uma carga +1 (sódio) ou -1 (cloreto).

Iônica Obrigações
Existem quatro tipos de vínculos ou medicamentosas: iônica, covalente, pontes de hidrogênio e interações de van der Waals. Ligações iônicas e covalentes são fortes interações que requerem uma maior entrada de energia para se separar. Quando um elemento doa um elétron de sua concha exterior, como no exemplo do átomo de sódio acima, um íon positivo é formado (Figura 2). O elemento que aceita o elétron está agora carregado negativamente., Porque as cargas positivas e negativas atraem, estes iões mantêm-se juntos e formam uma ligação iónica, ou uma ligação entre iões. Os elementos se ligam com o elétron de um elemento permanecendo predominantemente com o outro elemento. Quando Na+ e Cl– ions se combinam para produzir NaCl, um elétron de um átomo de sódio permanece com os outros sete do átomo de cloro, e os íons de sódio e cloreto atraem-se uns aos outros em uma rede de íons com uma carga zero líquida.,
ligações covalentes
outro tipo de ligação química forte entre dois ou mais átomos é uma ligação covalente. Estas ligações formam-se quando um elétron é compartilhado entre dois elementos e são a forma mais forte e mais comum de ligação química em organismos vivos. As ligações covalentes formam-se entre os elementos que compõem as moléculas biológicas das nossas células., Ao contrário das ligações iónicas, as ligações covalentes não se dissociam na água.curiosamente, químicos e biólogos medem a força de ligação de diferentes formas. Os químicos medem a força absoluta de uma ligação (a força teórica) enquanto os biólogos estão mais interessados em como a ligação se comporta em um sistema biológico, que é geralmente aquoso (à base de água). Na água, as ligações iônicas se separam muito mais facilmente do que as ligações covalentes, então os biólogos diriam que elas são mais fracas do que as ligações covalentes. Se olhares para um livro de química, verás algo diferente., Este é um grande exemplo de como a mesma informação pode levar a respostas diferentes, dependendo da perspectiva que você está vendo.os átomos de hidrogénio e oxigénio que se combinam para formar moléculas de água estão ligados por ligações covalentes. O elétron do átomo de hidrogênio divide seu tempo entre a concha externa do átomo de hidrogênio e a concha externa incompleta do átomo de oxigênio. Para preencher completamente a camada exterior de um átomo de oxigênio, dois elétrons de dois átomos de hidrogênio são necessários, daí o subscrito “2” em H2O., Os elétrons são compartilhados entre os átomos, dividindo seu tempo entre eles para “preencher” a concha exterior de cada um. Esta partilha é um estado de energia mais baixo para todos os átomos envolvidos do que se existissem sem as suas conchas exteriores preenchidas.
Existem dois tipos de ligações covalentes: polares e não-polares. Ligações covalentes não-polares formam-se entre dois átomos do mesmo elemento ou entre diferentes elementos que partilham os elétrons igualmente. Por exemplo, um átomo de oxigênio pode se ligar com outro átomo de oxigênio para encher suas conchas externas., Esta associação é não-polar porque os elétrons serão igualmente distribuídos entre cada átomo de oxigênio. Duas ligações covalentes formam-se entre os dois átomos de oxigénio porque o oxigénio requer dois electrões partilhados para preencher a sua concha mais externa. Os átomos de nitrogênio formam três ligações covalentes (também chamadas de covalente Triplo) entre dois átomos de nitrogênio porque cada átomo de nitrogênio precisa de três elétrons para preencher sua concha mais externa. Outro exemplo de uma ligação covalente não-polar é encontrado na molécula de metano (CH4). O átomo de carbono tem quatro elétrons em sua concha externa e precisa de mais quatro para preenchê-lo., Obtém estes quatro de quatro átomos de hidrogénio, cada um fornecendo um. Estes elementos compartilham os elétrons igualmente, criando quatro ligações covalentes não-polares (Figura 3).numa ligação covalente polar, os electrões partilhados pelos átomos passam mais tempo perto de um núcleo do que do outro. Devido à distribuição desigual de elétrons entre os diferentes núcleos, uma carga ligeiramente positiva (δ+) ou ligeiramente negativa (δ–) desenvolve-se. As ligações covalentes entre átomos de hidrogênio e oxigênio na água são ligações covalentes polares., Os elétrons compartilhados passam mais tempo perto do núcleo de oxigênio, dando-lhe uma pequena carga negativa, do que eles gastam perto do núcleo de hidrogênio, dando a essas moléculas uma pequena carga positiva.

ligações de hidrogénio
ligações iónicas e covalentes são ligações fortes que requerem uma energia considerável para quebrar. No entanto, nem todas as ligações entre elementos são ligações iônicas ou covalentes. Ligações mais fracas também podem se formar. Estas são atrações que ocorrem entre cargas positivas e negativas que não requerem muita energia para quebrar. Duas ligações fracas que ocorrem frequentemente são ligações de hidrogênio e interações de van der Waals. Estas ligações dão origem às propriedades únicas da água e às estruturas únicas do ADN e das proteínas.,quando ligações covalentes polares contendo uma forma de átomo de hidrogénio, o átomo de hidrogénio nessa ligação tem uma carga ligeiramente positiva. Isto é porque o elétron compartilhado é puxado mais fortemente para o outro elemento e para longe do núcleo de hidrogênio. Como o átomo de hidrogênio é ligeiramente positivo (δ+), ele será atraído por cargas parciais negativas vizinhas (δ–). Quando isso acontece, uma interação fraca ocorre entre a carga δ+ do átomo de hidrogênio de uma molécula e a carga δ da outra molécula. Esta interação é chamada de ligação de hidrogênio., Este tipo de ligação é comum; por exemplo, a natureza líquida da água é causada pelas ligações de hidrogênio entre moléculas de água (Figura 4). As ligações de hidrogénio dão à água as propriedades únicas que sustentam a vida. Se não fosse por ligação de hidrogênio, a água seria um gás ao invés de um líquido à temperatura ambiente.

pontes de Hidrogênio pode formar-se entre moléculas diferentes e nem sempre é necessário incluir uma molécula de água. Átomos de hidrogênio em ligações polares dentro de qualquer molécula podem formar ligações com outras moléculas adjacentes. Por exemplo, as ligações de hidrogénio mantêm juntas duas cadeias longas de ADN para dar à molécula de ADN a sua estrutura característica de dupla cadeia. Ligações de hidrogênio também são responsáveis por algumas das estruturas tridimensionais das proteínas.,como ligações de hidrogênio, as interações de van der Waals são atrações fracas ou interações entre moléculas. Elas ocorrem entre átomos polares, ligados covalentemente, em diferentes moléculas. Algumas destas atrações fracas são causadas por cargas parciais temporárias formadas quando os elétrons se movem em torno de um núcleo. Estas interações fracas entre moléculas são importantes em sistemas biológicos.