În primul rând este trebuie să știți numărul de electroni de valență. Puteți face acest lucru prin (1) desenarea configurației electronului pe element sau (2) consultarea tabelului periodic.,
Dacă ai ales să desenați configurația electronică per element, veți avea ceva de genul asta:
#N# (număr atomic = 7) : #1s^2# #de culoare (roșu) (2^2)# #de culoare (roșu) (2p^3)# (5 ultraperiferice electroni)
#O# (număr atomic = 8) : #1s^2# #de culoare (roșu) (2^2)# #de culoare (roșu) (2p^4)# (6 ultraperiferice electroni)
Dacă ai ales să consultați tabelul periodic, doar observați că #N# aparțin Grupului 5A în timp ce #O# aparține Grupului 6A. Grupul număr reprezintă numărul de ultraperiferice electroni.,
Acum, că știți numărul de electroni de valență pe element, aveți nevoie pentru a calcula totalul electroni de valență pentru #NO_3^”-1″# ion.
5 + (3 x 6) = 23 electroni
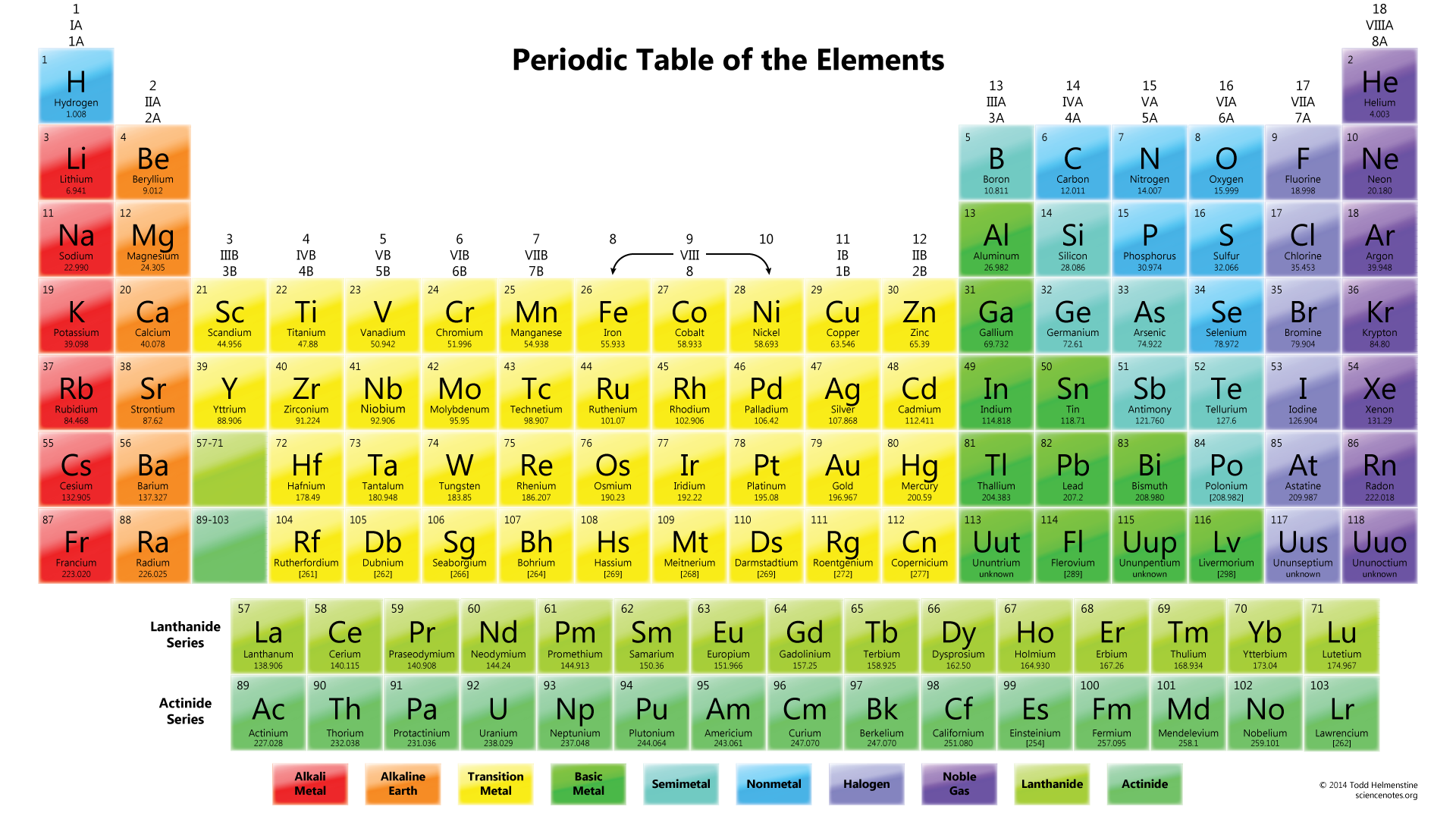
dar, deoarece întreaga moleculă are o încărcare -1, trebuie să adăugați și acest lucru. Deci numărul total de electroni de valență este de 24.următorul lucru de făcut este să desenați. În mod normal, primul element din formula chimică este atomul central. În acest caz, atomul # N # este înconjurat de trei atomi #o#.,
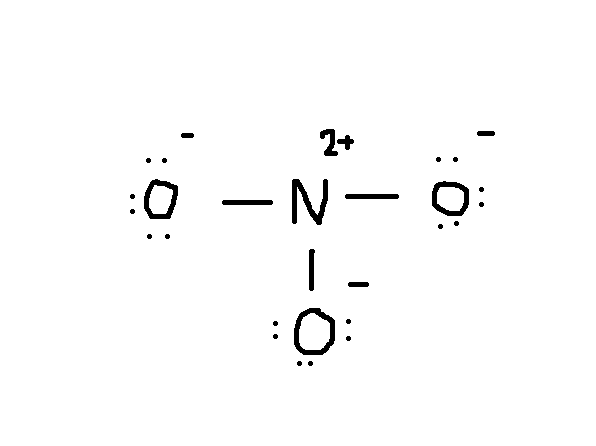
Observați că lone pereche de electroni de la #O# sunt de asemenea incluse în diagramă. Dacă numărați numărul total de electroni pe desenul de mai sus, este deja 24 de electroni (o singură linie contează ca 2 electroni). Dar acest desen a încălcat regula octetului, deoarece atomul central are doar 6 electroni în loc de numărul corect 8. Deci, ce să fac?
adăugați o altă legătură, dar unde?, prin urmare, structura de rezonanță ar arăta astfel: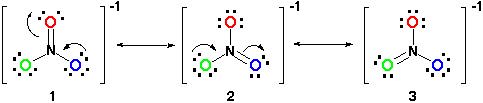
toate structurile de rezonanță sunt corecte, deoarece toate respectă regula octetului și toate au un număr total de 24 de electroni. Trebuie doar să rețineți că singura legătură în mișcare este legătura pi (#pi#) sau în termenul laic, legătura dublă și una dintre perechile de electroni din #o# atom.