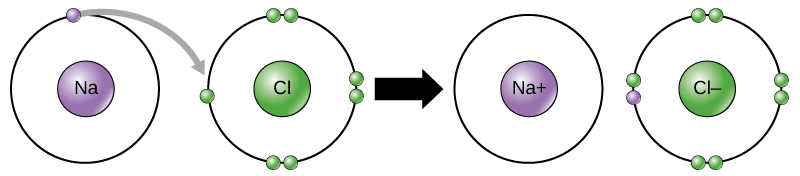
modul în care elementele interacționează între ele depinde de modul în care sunt aranjați electronii lor și de câte deschideri pentru electroni există în regiunea ultraperiferică unde electronii sunt prezenți într-un atom. Electronii există la niveluri de energie care formează cochilii în jurul nucleului. Cea mai apropiată cochilie poate conține până la doi electroni. Cea mai apropiată cochilie de nucleu este întotdeauna umplută mai întâi, înainte ca orice altă cochilie să poată fi umplută. Hidrogenul are un singur electron; prin urmare, are un singur loc ocupat în interiorul cochiliei inferioare., Heliul are doi electroni; prin urmare, poate umple complet carcasa cea mai joasă cu cei doi electroni ai săi. Dacă vă uitați la tabelul periodic, veți vedea că hidrogenul și heliul sunt singurele două elemente din primul rând. Acest lucru se datorează faptului că au doar electroni în prima coajă. Hidrogenul și heliul sunt singurele două elemente care au cea mai mică cochilie și nici alte cochilii.al doilea și al treilea nivel de energie pot conține până la opt electroni. Cei opt electroni sunt aranjați în patru perechi și o poziție în fiecare pereche este umplută cu un electron înainte ca orice pereche să fie finalizată.,privind din nou tabelul periodic (Figura 1), veți observa că există șapte rânduri. Aceste rânduri corespund numărului de cochilii pe care le au elementele din acel rând. Elementele dintr-un anumit rând au un număr tot mai mare de electroni pe măsură ce coloanele se deplasează de la stânga la dreapta. Deși fiecare element are același număr de cochilii, nu toate cochiliile sunt complet umplute cu electroni. Dacă vă uitați la al doilea rând al tabelului periodic, veți găsi litiu (Li), beriliu (Be), bor (B), carbon (C), azot (N), oxigen (O), fluor (F) și neon (Ne)., Toți aceștia au electroni care ocupă doar prima și a doua cochilie. Litiul are un singur electron în cochilia sa exterioară, beriliul are doi electroni, borul are trei și așa mai departe, până când întreaga cochilie este umplută cu opt electroni, ca în cazul neonului.nu toate elementele au suficienți electroni pentru a-și umple învelișurile exterioare, dar un atom este cel mai stabil atunci când toate pozițiile electronilor din învelișul exterior sunt umplute., Din cauza acestor posturi vacante în cochilii ultraperiferice, vedem formarea de legături chimice sau interacțiuni între două sau mai multe elemente identice sau diferite care au ca rezultat formarea de molecule. Pentru a obține o stabilitate mai mare, atomii vor tinde să-și umple complet învelișurile exterioare și se vor lega cu alte elemente pentru a atinge acest obiectiv prin împărtășirea electronilor, acceptarea electronilor de la un alt atom sau donarea electronilor către un alt atom., Deoarece învelișurile exterioare ale elementelor cu numere atomice scăzute (până la calciu, cu numărul atomic 20) pot conține opt electroni, aceasta este denumită regula octetului. Un element poate dona, accepta sau partaja electroni cu alte elemente pentru a-și umple cochilia exterioară și a satisface regula octetului.când un atom nu conține un număr egal de protoni și electroni, se numește ion. Deoarece numărul de electroni nu este egal cu numărul de protoni, fiecare ion are o sarcină netă. Ionii pozitivi se formează prin pierderea electronilor și se numesc cationi., Ionii negativi se formează prin câștigarea electronilor și se numesc anioni.de exemplu, sodiul are doar un singur electron în cochilia sa exterioară. Este nevoie de mai puțină energie pentru sodiu pentru a dona acel electron decât pentru a accepta încă șapte electroni pentru a umple învelișul exterior. Dacă sodiul pierde un electron, acum are 11 protoni și doar 10 electroni, lăsându-l cu o încărcătură totală de +1. Acum se numește ion de sodiu.atomul de clor are șapte electroni în carcasa sa exterioară. Din nou, este mai eficient din punct de vedere energetic pentru clor să câștige un electron decât să piardă șapte., Prin urmare, tinde să câștige un electron pentru a crea un ion cu 17 protoni și 18 electroni, dându-i o sarcină netă negativă (-1). Acum se numește ion de clorură. Această mișcare de electroni de la un element la altul este denumită transfer de electroni. Figura 1 ilustrează, un atom de sodiu (Na) are doar un singur electron în ultraperiferice coajă, întrucât un atom de clor (Cl) are șapte electroni în ultraperiferice shell. Un atom de sodiu își va dona un electron pentru a-și goli cochilia, iar un atom de clor va accepta acel electron pentru a-și umple cochilia, devenind clorură., Ambii ioni satisfac acum regula octetului și au cochilii exterioare complete. Deoarece numărul de electroni nu mai este egal cu numărul de protoni, fiecare este acum un ion și are o sarcină +1 (sodiu) sau -1 (clorură).

legături Ionice
Există patru tipuri de obligațiuni sau interacțiuni: ionice, covalente, legături de hidrogen și van der Waals interacțiuni. Legăturile ionice și covalente sunt interacțiuni puternice care necesită o cantitate mai mare de energie pentru a se rupe. Când un element donează un electron din carcasa sa exterioară, ca în exemplul atomului de sodiu de mai sus, se formează un ion pozitiv (figura 2). Elementul care acceptă electronul este acum încărcat negativ., Deoarece sarcinile pozitive și negative atrag, acești ioni rămân împreună și formează o legătură ionică sau o legătură între ioni. Elementele se leagă împreună cu electronul dintr-un element rămânând predominant cu celălalt element. Când Na + și Cl– ionii se combină pentru a produce NaCl, un electron dintr-un atom de sodiu rămâne cu ceilalți șapte din atomul de clor, iar ionii de sodiu și clorură se atrag reciproc într-o rețea de ioni cu o sarcină netă zero.,
legături Covalente
un Alt tip de puternică legătură chimică între două sau mai multe atomi este o legătură covalentă. Aceste legături se formează atunci când un electron este împărțit între două elemente și sunt cea mai puternică și cea mai comună formă de legătură chimică în organismele vii. Legăturile covalente se formează între elementele care alcătuiesc moleculele biologice din celulele noastre., Spre deosebire de legăturile ionice, legăturile covalente nu se disociază în apă.interesant este că chimiștii și biologii măsoară puterea legăturii în moduri diferite. Chimiștii măsoară puterea absolută a unei legături (puterea teoretică), în timp ce biologii sunt mai interesați de modul în care legătura se comportă într-un sistem biologic, care este de obicei apos (pe bază de apă). În apă, legăturile ionice se desprind mult mai ușor decât legăturile covalente, așa că biologii ar spune că sunt mai slabe decât legăturile covalente. Dacă te uiți într-un manual de chimie, vei vedea ceva diferit., Acesta este un exemplu excelent al modului în care aceleași informații pot duce la răspunsuri diferite, în funcție de perspectiva din care o vizualizați.atomii de hidrogen și oxigen care se combină pentru a forma molecule de apă sunt legați împreună prin legături covalente. Electronul din atomul de hidrogen își împarte timpul între carcasa exterioară a atomului de hidrogen și carcasa exterioară incompletă a atomului de oxigen. Pentru a umple complet carcasa exterioară a unui atom de oxigen, sunt necesari doi electroni de la doi atomi de hidrogen, de unde și indicele „2” în H2O., Electronii sunt împărțiți între atomi, împărțind timpul între ei pentru a” umple ” cochilia exterioară a fiecăruia. Această împărțire este o stare de energie mai mică pentru toți atomii implicați decât dacă ar exista fără cochilii lor exteriori umpluți.există două tipuri de legături covalente: polare și nepolare. Legăturile covalente nepolare se formează între doi atomi ai aceluiași element sau între elemente diferite care împărtășesc electronii în mod egal. De exemplu, un atom de oxigen se poate lega cu un alt atom de oxigen pentru a-și umple cochiliile exterioare., Această asociere este nepolară, deoarece electronii vor fi distribuiți în mod egal între fiecare atom de oxigen. Două legături covalente se formează între cei doi atomi de oxigen, deoarece oxigenul necesită doi electroni împărțiți pentru a-și umple cochilia exterioară. Atomii de azot vor forma trei legături covalente (numite și triple covalente) între doi atomi de azot, deoarece fiecare atom de azot are nevoie de trei electroni pentru a-și umple cochilia exterioară. Un alt exemplu de legătură covalentă nepolară se găsește în molecula de metan (CH4). Atomul de carbon are patru electroni în cochilia sa exterioară și are nevoie de încă patru pentru a-l umple., Obține acești patru din patru atomi de hidrogen, fiecare atom furnizând unul. Toate aceste elemente împart electronii în mod egal, creând patru legături covalente nepolare (Figura 3).într-o legătură covalentă polară, electronii împărțiți de atomi petrec mai mult timp mai aproape de un nucleu decât de celălalt nucleu. Datorită distribuției inegale a electronilor între diferitele nuclee, se dezvoltă o sarcină ușor pozitivă (δ+) sau ușor negativă (δ–). Legăturile covalente dintre atomii de hidrogen și oxigen din apă sunt legături covalente polare., Electronii împărțiți petrec mai mult timp în apropierea nucleului de oxigen, dându-i o sarcină negativă mică, decât petrec în apropierea nucleelor de hidrogen, dând acestor molecule o sarcină pozitivă mică.

legături de Hidrogen
Ionice și legături covalente sunt legături puternice care necesită multă energie pentru a rupe. Cu toate acestea, nu toate legăturile dintre elemente sunt legături ionice sau covalente. Se pot forma și legături mai slabe. Acestea sunt atracții care apar între sarcini pozitive și negative care nu necesită multă energie pentru a se rupe. Două legături slabe care apar frecvent sunt legăturile de hidrogen și interacțiunile van der Waals. Aceste legături dau naștere proprietăților unice ale apei și structurilor unice ale ADN-ului și proteinelor.,când se formează legături covalente polare care conțin un atom de hidrogen, atomul de hidrogen din acea legătură are o sarcină ușor pozitivă. Acest lucru se datorează faptului că electronul comun este tras mai puternic spre celălalt element și departe de nucleul de hidrogen. Deoarece atomul de hidrogen este ușor pozitiv (δ+), acesta va fi atras de încărcările parțiale negative vecine (δ–). Când se întâmplă acest lucru, apare o interacțiune slabă între sarcina δ+ a atomului de hidrogen al unei molecule și sarcina δ a celeilalte molecule. Această interacțiune se numește o legătură de hidrogen., Acest tip de legătură este comun; de exemplu, natura lichidă a apei este cauzată de legăturile de hidrogen dintre moleculele de apă (Figura 4). Legăturile de hidrogen dau apei proprietățile unice care susțin viața. Dacă nu ar fi fost pentru lipirea hidrogenului, apa ar fi mai degrabă un gaz decât un lichid la temperatura camerei.

legăturile de Hidrogen se poate forma între molecule diferite și nu au întotdeauna să includă o moleculă de apă. Atomii de hidrogen din legăturile polare din orice moleculă pot forma legături cu alte molecule adiacente. De exemplu, legăturile de hidrogen dețin împreună două fire lungi de ADN pentru a da moleculei ADN structura sa dublă catenară caracteristică. Legăturile de hidrogen sunt, de asemenea, responsabile pentru o parte din structura tridimensională a proteinelor.,la fel ca legăturile de hidrogen, interacțiunile van der Waals sunt atracții slabe sau interacțiuni între molecule. Ele apar între atomi polari, legați covalent, în diferite molecule. Unele dintre aceste atracții slabe sunt cauzate de încărcări parțiale temporare formate atunci când electronii se mișcă în jurul unui nucleu. Aceste interacțiuni slabe între molecule sunt importante în sistemele biologice.