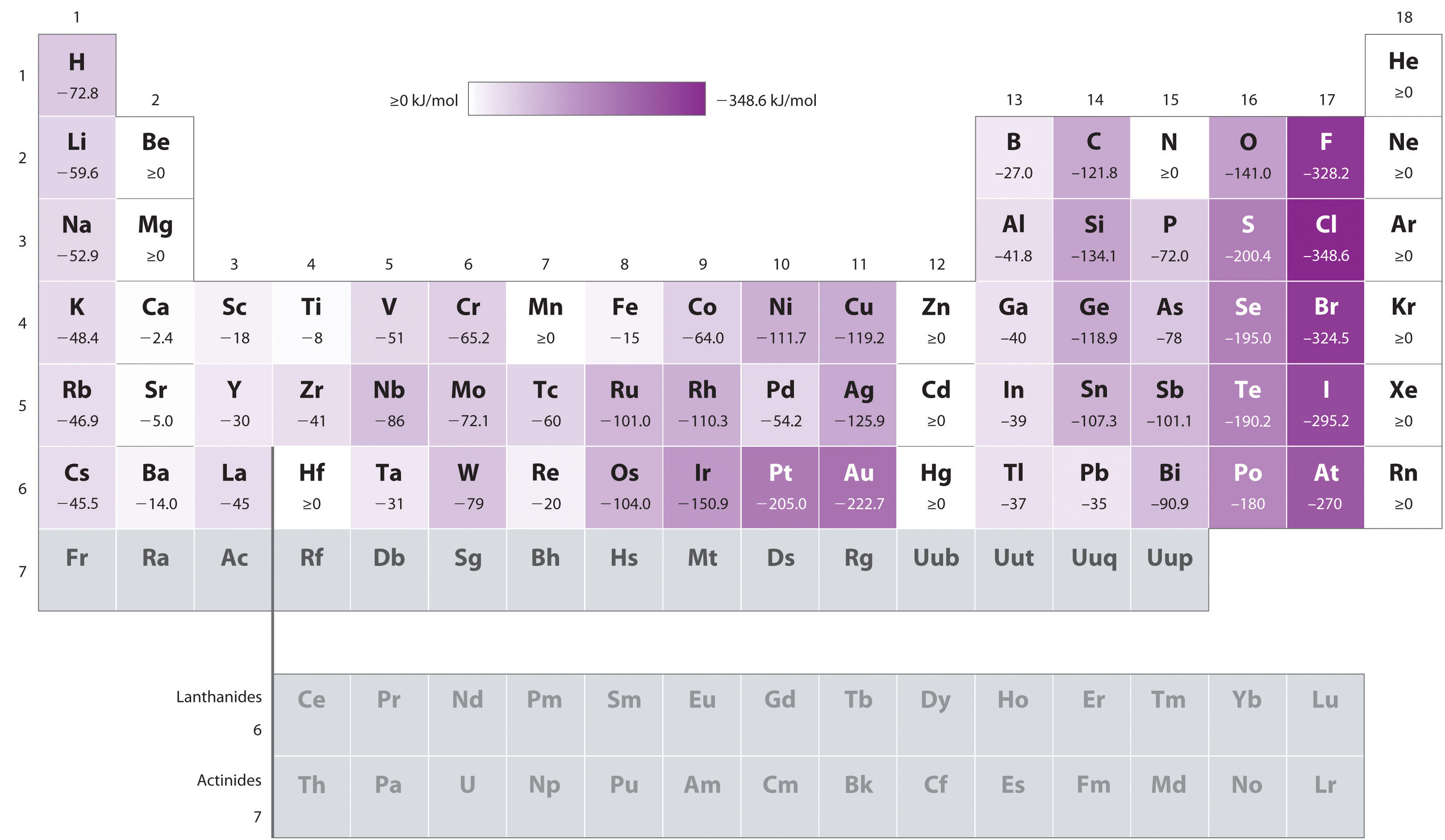
atomer med de största radierna, som har de lägsta joniseringsenergierna (affinitet för sina egna valenselektroner), har också den lägsta affiniteten för en tillsatt elektron. Det finns dock två stora undantag från denna trend:
- elektronaffiniteterna för element B till F i den andra raden i periodiska tabellen är mindre negativa än de av elementen omedelbart under dem i tredje raden., Tydligen övervinner de ökade elektronelektronrepulsionerna som upplevs av elektroner begränsade till de relativt små 2P–orbitalerna den ökade elektronkärnans attraktion vid korta nukleära avstånd. Fluor har därför en lägre affinitet för en tillsatt elektron än klor. Följaktligen har elementen i den tredje raden (n = 3) de mest negativa elektron affiniteterna. Längre ner i en kolumn minskar attraktionen för en extra elektron eftersom elektronen går in i en orbital som är mer avlägsen från kärnan., Elektronelektronrepulsioner minskar också eftersom valenselektronerna upptar en större volym utrymme. Dessa effekter tenderar att avbryta varandra, så förändringarna i elektronaffinitet inom en familj är mycket mindre än förändringarna i joniseringsenergi.
- elektronaffiniteterna hos alkaliska jordartsmetaller blir mer negativa från Be till Ba. Energiseparationen mellan de fyllda ns2 och de tomma NP-underskalorna minskar med ökande n, så att bildandet av en anjon från de tyngre elementen blir energiskt mer gynnsamt.,
ekvationerna för andra och högre elektronaffiniteter är analoga med dem för andra och högre joniseringsenergier:
\
\
som vi har sett kan den första elektronaffiniteten vara större än eller lika med noll eller negativ, beroende på atomens elektronkonfiguration. Däremot är den andra elektronaffiniteten alltid positiv eftersom de ökade elektronelektronrepulsionerna i en dianion är mycket större än kärnans attraktion för de extra elektronerna., Till exempel är den första elektronaffiniteten av syre -141 kJ/mol, men den andra elektronaffiniteten är +744 kJ/mol:
\
\
sålunda är bildandet av en gasformig oxid (\(o^{2−}\)) jon energiskt ganska ogynnsam (uppskattad genom att lägga till båda stegen):
\
medan första elektronaffiniteter kan vara negativa, positiva eller noll, är andra elektronaffiniteter alltid positiva.,
om energi krävs för att bilda både positivt laddade katjoner och monatomiska polyanioner, varför bildar joniska föreningar som \(mgo\), \(Na_2S\) och \(Na_3P\) alls? Nyckelfaktorn vid bildandet av stabila joniska föreningar är de gynnsamma elektrostatiska interaktionerna mellan katjonerna och anjonerna i det kristallina saltet.
exempel \(\Pageindex{1}\): kontrasterande Elektronaffiniteter hos Sb, Se och Te
baserat på deras positioner i det periodiska tabellen, vilken av Sb, Se eller Te skulle du förutsäga att ha den mest negativa elektronaffiniteten?,
Given: tre element
bad om: element med mest negativ elektronaffinitet
strategi:
- leta upp elementen i det periodiska systemet. Använd trenderna i elektronaffiniteter som går ner i en kolumn för element i samma grupp. På samma sätt, använd trenderna i elektronaffiniteter från vänster till höger för element i samma rad.
- placera elementen i ordning, lista elementet med den mest negativa elektronaffiniteten först.,
lösning:
a vi vet att elektronaffiniteter blir mindre negativa att gå ner i en kolumn (förutom de anomalt låga elektronaffiniteterna hos elementen i den andra raden), så vi kan förutsäga att elektronaffiniteten hos Se är mer negativ än Te. Vi vet också att elektronaffiniteter blir mer negativa från vänster till höger över en rad och att Grupp 15-elementen tenderar att ha värden som är mindre negativa än förväntat., Eftersom Sb Ligger till vänster om Te och tillhör grupp 15 förutspår vi att elektronaffiniteten hos Te är mer negativ än Sb. Den totala ordningen är se < Te < Sb, så Se har den mest negativa elektronaffiniteten bland de tre elementen.