först måste du veta antalet valenselektroner. Du kan göra detta genom att (1) rita elektronkonfigurationen per element eller (2) konsultera ditt periodiska bord.,
om du väljer att rita elektronkonfigurationen per element kommer du att ha något så här:
#n# (atomnummer = 7) : #1s^2# #färg (röd) (2s^2)# #färg (röd) (2P^3)# (5 yttersta elektroner)
#o# (atomnummer = 8) : #1s^2# #färg (röd) (2s^2)# #färg (röd) (2P^4)# (6 yttersta elektroner)
om du väljer att konsultera ditt periodiska bord, märker du bara att #n# tillhör grupp 5A medan #o# tillhör grupp 6a. gruppnumret anger antalet yttersta elektroner.,
nu när du vet antalet valenselektroner per element måste du beräkna de totala valenselektronerna för #NO_3^”-1″# ion.
5 + (3 x 6) = 23 elektroner
men eftersom hela molekylen har en -1 laddning måste du också lägga till detta. Så det totala antalet valenselektroner är 24.
nästa sak att göra är att rita. Normalt är det första elementet i den kemiska formeln den centrala atomen. I det här fallet är #N# atom omgiven av tre #o# atomer.,
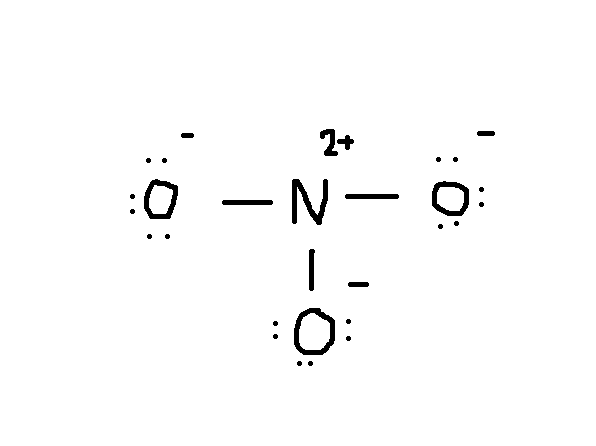
Observera att det ensamma paret elektroner från #o# också ingår i diagrammet. Om du räknar det totala antalet elektroner på ovanstående ritning är det redan 24 elektroner (enstaka linjer räknas som 2 elektroner). Men denna ritning har brutit mot oktettregeln eftersom den centrala atomen bara har 6 elektroner istället för rätt nummer 8. Så vad göra?
Lägg till en annan obligation, men var?,
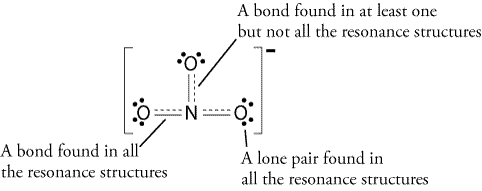
därför skulle resonansstrukturen se ut så här: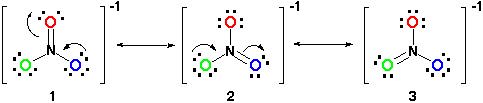
alla resonansstrukturer är korrekta eftersom allt följer oktettregeln och alla har ett totalt antal 24 elektroner. Bara notera att den enda bond flytta är pi (#pi#) bond eller i lekman sikt, dubbelbindning och en av elektronpar från #O# atom.