inlärningsmål
- jämför punktmutationer och frameshiftmutationer
- beskriv skillnaderna mellan missense, nonsens och tysta mutationer
- beskriv skillnaderna mellan ljus och mörk reparation
- förklara hur olika mutagens act
- förklara varför Ames-testet kan användas för att detektera cancerframkallande ämnen
- analysera sekvenser av mutationer och DNA och identifiera exempel på typer av mutationer
en mutation är en ärftlig förändring i DNA-sekvensen av en organism., Den resulterande organismen, som kallas en mutant, kan ha en igenkännlig förändring i fenotyp jämfört med den vilda typen, som är den fenotyp som oftast observeras i naturen. En förändring i DNA-sekvensen ges till mRNA genom transkription, och kan leda till en förändrad aminosyrasekvens i ett protein vid översättning. Eftersom proteiner utför de allra flesta cellulära funktioner kan en förändring i aminosyrasekvensen i ett protein leda till en förändrad fenotyp för cellen och organismen.,
effekter av mutationer på DNA-sekvensen
det finns flera typer av mutationer som klassificeras enligt hur DNA-molekylen förändras. En typ, kallad en punktmutation, påverkar en enda bas och uppträder oftast när en bas ersätts eller ersätts av en annan. Mutationer är också resultatet av tillägg av en eller flera baser, känd som en insättning, eller avlägsnande av en eller flera baser, känd som en radering.
Tänk på det
- vilken typ av mutation uppstår när en gen har två färre nukleotider i sin sekvens?,
effekter av mutationer på proteinstruktur och funktion
punktmutationer kan ha ett brett spektrum av effekter på proteinfunktionen (Figur 1). Som en följd av den genetiska kodens degenerering kommer en punktmutation vanligen att resultera i att samma aminosyra införlivas i den resulterande polypeptiden trots sekvensändringen. Denna förändring skulle inte ha någon effekt på proteinets struktur, och kallas således en tyst mutation. En missense-mutation resulterar i att en annan aminosyra införlivas i den resulterande polypeptiden., Effekten av en missense-mutation beror på hur kemiskt annorlunda den nya aminosyran är från den vilda aminosyran. Placeringen av den förändrade aminosyran inom proteinet är också viktig. Till exempel, om den förändrade aminosyran är en del av enzymets aktiva plats, kan effekten av missense-mutationen vara signifikant. Många missense mutationer resulterar i proteiner som fortfarande är funktionella, åtminstone till viss del. Ibland effekterna av missense mutationer kan vara skenbara under vissa miljöförhållanden. sådana missense mutationer kallas villkorlig mutationer., Sällan kan en missense-mutation vara till nytta. Under de rätta miljöförhållandena kan denna typ av mutation ge den organism som hyser den en selektiv fördel. Men en annan typ av punktmutation, kallad en nonsensmutation, omvandlar en kodon som kodar för en aminosyra (en sense codon) till en stoppkodon (en nonsens codon). Nonsens mutationer resulterar i syntesen av proteiner som är kortare än den vilda typen och vanligtvis inte funktionell.
deletioner och Infogningar orsakar också olika effekter., Eftersom kodon är tripletter av nukleotider, kan Infogningar eller deletioner i grupper om tre nukleotider leda till införande eller radering av en eller flera aminosyror och kan inte orsaka signifikanta effekter på det resulterande proteinets funktionalitet. Frameshiftmutationer, orsakade av Infogningar eller raderingar av ett antal nukleotider som inte är en multipel av tre, är emellertid extremt problematiska eftersom en förskjutning i läsramens resultat (Figur 1). Eftersom ribosomer läser mRNA i triplettkodon kan frameshiftmutationer ändra varje aminosyra efter mutationspunkten., Den nya läsramen kan också innehålla en stoppkodon före slutet av kodningssekvensen. Följaktligen är proteiner gjorda av gener som innehåller frameshiftmutationer nästan alltid icke-funktionella.
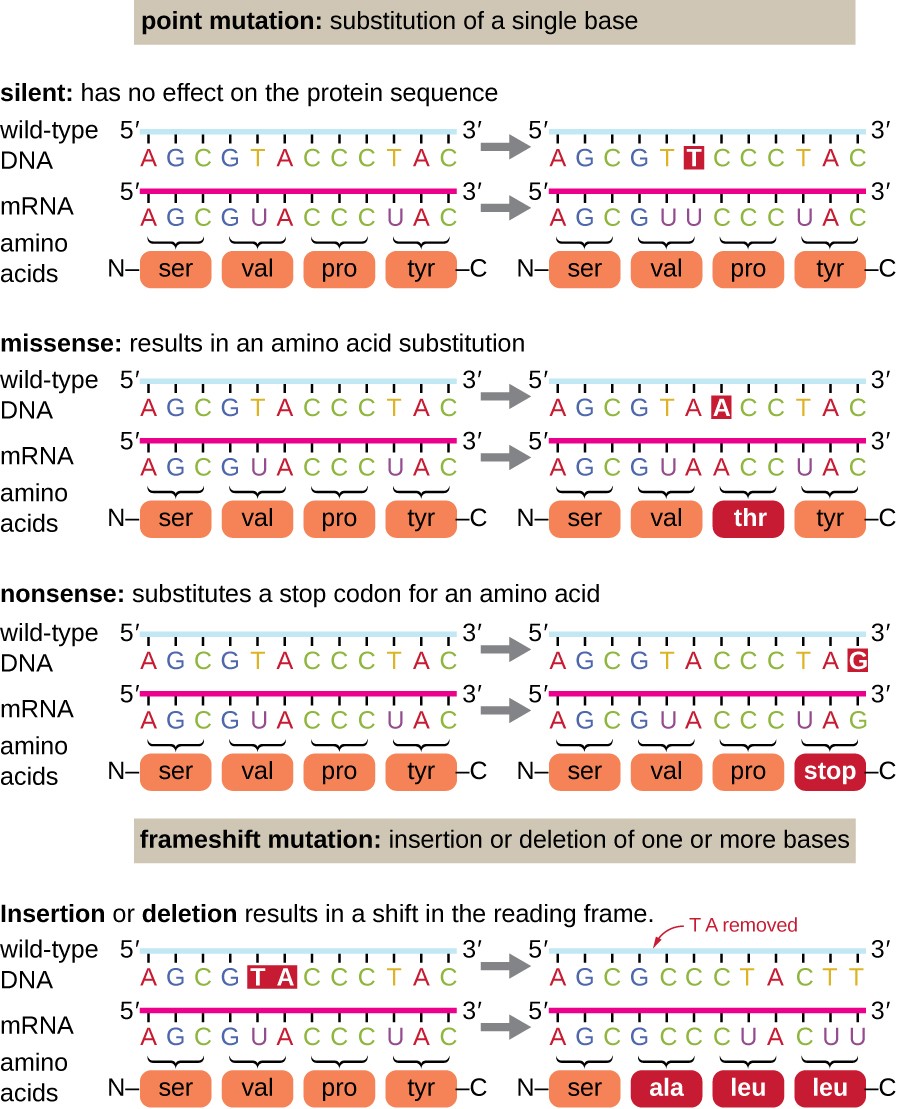
Figur 1. Klicka för en större bild. Mutationer kan leda till förändringar i proteinsekvensen kodad av DNA.
Tänk på det
- vilka är orsakerna till att en nukleotidförändring i en gen för ett protein kanske inte har någon effekt på fenotypen av den genen?,
- är det möjligt att införa tre nukleotider tillsammans efter den femte nukleotiden i en proteinkodande gen för att producera ett protein som är kortare än normalt? Hur eller hur?
en fördelaktig Mutation
sedan det första fallet av infektion med humant immunbristvirus (HIV) rapporterades 1981, har nästan 40 miljoner människor dött av HIV-infektion, det virus som orsakar förvärvat immunbristsyndrom (AIDS)., Viruset riktar helper T-celler som spelar en nyckelroll för att överbrygga det medfödda och adaptiva immunsvaret, infektera och döda celler som normalt är involverade i kroppens svar på infektion. Det finns inget botemedel mot HIV-infektion, men många droger har utvecklats för att sakta eller blockera virusets progression. Även om individer runt om i världen kan vara smittade, är den högsta prevalensen bland människor 15-49 år gammal i Afrika söder om Sahara, där nästan en person i 20 är smittad och står för mer än 70% av infektionerna över hela världen (Figur 2)., Tyvärr är detta också en del av världen där förebyggande strategier och läkemedel för att behandla infektionen är mest saknas.

Figur 2. HIV är mycket vanligt i Afrika söder om Sahara, men dess prevalens är ganska låg i vissa andra delar av världen.
under de senaste åren har vetenskapligt intresse blivit piqued av upptäckten av några individer från norra Europa som är resistenta mot HIV-infektion. 1998, amerikansk genetiker Stephen J., O ’ Brien vid National Institutes of Health (NIH) och kollegor publicerade resultaten av deras genetiska analys av mer än 4000 individer. Dessa indikerade att många individer av eurasisk härkomst (upp till 14% i vissa etniska grupper) har en deletionsmutation, kallad CCR5-delta 32, i genen som kodar för CCR5. CCR5 är en coreceptor som finns på ytan av T-celler som är nödvändig för många stammar av viruset att komma in i värdcellen. Mutationen leder till produktion av en receptor till vilken HIV inte effektivt kan binda och därmed blockerar viral inträde., Människor homozygot för denna mutation har kraftigt minskad känslighet för HIV-infektion, och de som är heterozygot har också ett visst skydd mot infektion.
det är inte klart varför människor med nordeuropeisk härkomst, specifikt, bär denna mutation, men dess prevalens verkar vara högst i norra Europa och minskar stadigt i populationer när man rör sig söderut. Forskning tyder på att mutationen har funnits sedan innan HIV dök upp och kan ha valts ut för i europeiska populationer som ett resultat av exponering för pesten eller smittkoppor., Denna mutation kan skydda individer från pest (orsakad av bakterien Yersinia pestis) och smittkoppor (orsakad av variola-viruset) eftersom denna receptor också kan vara involverad i dessa sjukdomar. Denna mutations ålder är en fråga om debatt, men uppskattningar tyder på att den uppträdde mellan 1875 år till 225 år sedan och kan ha spridits från norra Europa genom Vikingainvasioner.
detta spännande fynd har lett till nya vägar inom HIV-forskning, inklusive att leta efter droger för att blockera CCR5-bindning till HIV hos individer som saknar mutationen., Även om DNA-testning för att bestämma vilka individer som bär CCR5-delta 32-mutationen är möjlig, finns det dokumenterade fall av individer homozygot för mutationen som smittar HIV. Av denna anledning rekommenderas DNA-testning för mutationen inte allmänt av folkhälsopersonal för att inte uppmuntra riskabelt beteende hos dem som bär mutationen. Att hämma bindningen av HIV till CCR5 fortsätter dock att vara en giltig strategi för utveckling av läkemedelsbehandlingar för HIV-infekterade.,
orsaker till mutationer
misstag i processen för DNA-replikering kan orsaka spontana mutationer att inträffa. Felfrekvensen för DNA-polymeras är en felaktig bas per miljard baspar replikeras. Exponering för mutagener kan orsaka inducerade mutationer, vilka är olika typer av kemiska medel eller strålning (Tabell 1). Exponering för en mutagen kan öka mutationshastigheten mer än 1000 gånger. Mutagener är ofta också cancerframkallande ämnen, medel som orsakar cancer. Men medan nästan alla cancerframkallande ämnen är Mutagena är inte alla mutagener nödvändigtvis cancerframkallande.,
| Tabell 1., to AT base pair | Point | |||
|---|---|---|---|---|
| Intercalating agents | ||||
| Acridine orange, ethidium bromide, polycyclic aromatic hydrocarbons | Distorts double helix, creates unusual spacing between nucleotides | Introduces small deletions and insertions | Frameshift | |
| Ionizing radiation | ||||
| X-rays, γ-rays | Forms hydroxyl radicals | Causes single- and double-strand DNA breaks | Repair mechanisms may introduce mutations | |
| X-rays, γ-rays | Modifies bases (e.,g., deaminerande C till U) | konverterar GC till vid baspar | punkt | |
| Noniserande strålning | ||||
| ultraviolett | bildar pyrimidin (vanligtvis tymin) dimerer | orsakar DNA-replikationsfel | Frameshift eller punkt | |
kemiska mutagener
olika typer av kemiska mutagener interagerar direkt med DNA antingen genom att fungera som nukleosidanaloger eller genom att ändra nukleotidbaser., Kemikalier som kallas nukleosidanaloger liknar strukturellt normala nukleotidbaser och kan införlivas i DNA under replikation (Figur 3). Dessa basanaloger inducerar mutationer eftersom de ofta har olika basparningsregler än de baser de ersätter. Andra kemiska mutagener kan ändra normala DNA-baser, vilket resulterar i olika basparningsregler. Till exempel deaminerar salpetersyra cytosin, omvandlar den till uracil. Uracil parar sedan med adenin i en efterföljande replikeringsrunda, vilket resulterar i omvandling av ett GC-baspar till ett at-baspar., Salpetersyra deaminerar också adenin till hypoxantin, vilken baspar med cytosin istället för tymin, vilket resulterar i omvandling av ett ta-baspar till ett kg-baspar.

Figur 3. Klicka för en större bild. a) 2-aminopurinnukleosid (2AP) är strukturellt en nukleosidanalog till adeninnukleosid, medan 5-bromouracil (5BU) är en nukleosidanalog till tyminnukleosid. 2AP baspar med C, konvertera en AT baspar till en GC baspar efter flera omgångar av replikering., 5BU par med G, konvertera en AT baspar till en GC baspar efter flera omgångar av replikering. B) salpetersyra är en annan typ av kemisk mutagen som modifierar redan befintliga nukleosidbaser som C för att producera U, vilken baspar med A. Denna kemiska modifiering, som visas här, resulterar i att omvandla ett CG-baspar till ett TA-baspar.
kemiska mutagener som kallas interkalaterande medel fungerar annorlunda., Dessa molekyler glider mellan de staplade kvävebaserna av DNA – dubbelhelixen, förvränger molekylen och skapar atypisk avstånd mellan nukleotidbaspar (Figur 4). Som ett resultat kan DNA-polymeras under DNA-replikering antingen hoppa över replikering av flera nukleotider (skapa en radering) eller infoga extra nukleotider (skapa en insättning). Antingen resultatet kan leda till en frameshift mutation. Förbränningsprodukter som polycykliska aromatiska kolväten är särskilt farliga interkalaterande medel som kan leda till mutation orsakad cancer., De interkalaterande agenterna ethidiumbromid och akridin orange används ofta i laboratoriet för att fläcka DNA för visualisering och är potentiella mutagener.

Figur 4. Interkalaterande medel, såsom akridin, introducerar atypiskt avstånd mellan baspar, vilket resulterar i DNA-polymeras som introducerar antingen en radering eller en insättning, vilket leder till en potentiell frameshiftmutation.
strålning
exponering för antingen joniserande eller noniserande strålning kan var och en inducera mutationer i DNA, även om olika mekanismer., Stark joniserande strålning som röntgenstrålar och gammastrålar kan orsaka enkel – och dubbelsträngade raster i DNA-ryggraden genom bildandet av hydroxylradikaler vid strålningsexponering (Figur 5). Joniserande strålning kan också modifiera baser; till exempel deaminering av cytosin till uracil, analog med verkan av salpetersyra. Joniserande strålningsexponering används för att döda mikrober för att sterilisera medicintekniska produkter och livsmedel, på grund av dess dramatiska icke-specifika effekt vid skada DNA, proteiner och andra cellulära komponenter (Se använda fysiska metoder för att kontrollera mikroorganismer).,
Nonioniserande strålning, som ultraviolett ljus, är inte tillräckligt energisk för att initiera dessa typer av kemiska förändringar. Nonioniserande strålning kan emellertid inducera dimerbildning mellan två intilliggande pyrimidinbaser, vanligen två tyminer, inom en nukleotidsträng. Under tymindimerbildning blir de två intilliggande tyminerna kovalent länkade och om de lämnas oreparerade, stannar både DNA-replikation och transkription vid denna tidpunkt. DNA-polymeras kan fortsätta och replikera dimer felaktigt, vilket potentiellt leder till frameshift eller punktmutationer.,

Figur 5. a) joniserande strålning kan leda till bildning av enkelsträngade och dubbelsträngade raster i DNA: s sockerfosfat-ryggrad samt till modifiering av baser (ej angivna). (B) Nonioniserande strålning som ultraviolett ljus kan leda till bildandet av tymindimerer, som kan stalla replikering och transkription och införa frameshift eller punktmutationer.
Tänk på det
- hur introducerar en base analog en mutation?,
- hur introducerar ett intercalating agent en mutation?
- vilken typ av mutagen orsakar tymindimer?
DNA-reparation
processen för DNA-replikering är mycket noggrann, men misstag kan uppstå spontant eller induceras av mutagener. Okorrigerade misstag kan leda till allvarliga konsekvenser för fenotypen. Celler har utvecklat flera reparationsmekanismer för att minimera antalet mutationer som kvarstår.,
korrekturläsning
de flesta av de misstag som införts under DNA-replikering korrigeras snabbt av de flesta DNA-polymeraser genom en funktion som kallas korrekturläsning. I korrekturläsning läser DNA-polymerasen den nytillkomna basen, vilket säkerställer att den kompletterar motsvarande bas i mallsträngen innan du lägger till nästa. Om en felaktig bas har tillsatts, gör enzymet ett snitt för att frigöra fel nukleotid och en ny bas tillsätts.,
felmatchning reparation
vissa fel som införts under replikering korrigeras strax efter replikering maskiner har flyttat. Denna mekanism kallas mismatch reparation. De enzymer som är involverade i denna mekanism känner igen den felaktigt tillsatta nukleotiden, punktdelar den och ersätter den med rätt bas. Ett exempel är methyl-directed mismatch repair i E. coli. DNA är hemimethylated. Detta innebär att föräldrasträngen är metylerad medan den nyligen syntetiserade dottersträngen inte är. Det tar flera minuter innan den nya strängen är metylerad., Proteiner mutar, MutL och MutH binder till den hemimetylerade platsen där den felaktiga nukleotiden finns. MutH skär den icke-metylerade strängen (den nya strängen). En exonukleas avlägsnar en del av strängen (inklusive den felaktiga nukleotiden). Gapet som bildas fylls sedan in av DNA pol III och ligas.
reparation av Tymindimerer
eftersom produktionen av tymindimerer är vanligt (många organismer kan inte undvika ultraviolett ljus) har mekanismer utvecklats för att reparera dessa skador., I nukleotid excision reparation (även kallad mörk reparation), enzymer avlägsna pyrimidin dimer och ersätta den med rätt nukleotider (Figur 6). I E. coli skannas DNA av ett enzymkomplex. Om en distorsion i dubbelhelixen upptäcks som introducerades av pyrimidindimer, skär enzymkomplexet sockerfosfatbacken flera baser uppströms och nedströms dimer, och segmentet av DNA mellan dessa två skärningar avlägsnas sedan enzymatiskt. DNA pol i ersätter de saknade nukleotiderna med de rätta och DNA-ligas förseglar gapet i sockerfosfatbacken.,
den direkta reparationen (även kallad ljusreparation) av tymindimerer sker genom fotoreaktiveringsprocessen i närvaro av synligt ljus. Ett enzym som kallas fotolyas känner igen förvrängningen i DNA-helixen som orsakas av tymindimeren och binder till dimer. Sedan, i närvaro av synligt ljus, ändrar fotolyasenzymet konformation och bryter ihop tymindimeren, vilket gör att tyminerna återigen kan basera par med adeninerna på den kompletterande strängen., Fotoreaktivering verkar förekomma i alla organismer, med undantag av placenta däggdjur, inklusive människor. Fotoreaktivering är särskilt viktigt för organismer som kroniskt utsätts för ultraviolett strålning, som växter, fotosyntetiska bakterier, alger och koraller, för att förhindra ackumulering av mutationer orsakade av tymindimerbildning.

Figur 6. Klicka för en större bild. Bakterier har två mekanismer för att reparera tymindimerer., (a) i nukleotid excision reparation, en enzymkomplex känner igen distorsion i DNA-komplexet runt tymin dimer och skär och tar bort den skadade DNA-strängen. De korrekta nukleotiderna ersätts av DNA pol i och nukleotidsträngen förseglas med DNA-ligas. b) i fotoreaktivering binder enzymet fotolyas till tymindimeren och, i närvaro av synligt ljus, bryter sönder dimeren och återställer basparningen av tyminerna med kompletterande adeniner på motsatt DNA-sträng.,
Tänk på det
- under mismatch reparation, Hur känner enzymet igen vilket är det nya och vilket är den gamla strängen?
- hur introducerar ett intercalating agent en mutation?
- vilken typ av mutation reparerar photolyase?
identifiera bakteriella mutanter
en vanlig teknik som används för att identifiera bakteriella mutanter kallas replikplätering., Denna teknik används för att detektera näringsmutanter, kallade auxotrofer, som har en mutation i en gen som kodar för ett enzym i biosyntesens väg för ett specifikt näringsämne, såsom en aminosyra. Som ett resultat, medan vilda celler behåller förmågan att växa normalt på ett medium som saknar det specifika näringsämnet, kan auxotrophs inte växa på ett sådant medium. Under replikplätering (Figur 7) mutageniseras en population av bakterieceller och pläteras sedan som enskilda celler på en komplex näringsmässigt komplett platta och får växa till kolonier., Celler från dessa kolonier avlägsnas från denna huvudplatta, ofta med steril sammet. Denna sammet, innehållande celler, pressas sedan i samma orientering på plattor av olika medier. Minst en platta bör också vara näringsmässigt komplett för att säkerställa att cellerna överförs korrekt mellan plattorna. De andra plattorna saknar specifika näringsämnen, så att forskaren kan upptäcka olika auxotrofa mutanter som inte kan producera specifika näringsämnen. Celler från motsvarande koloni på den näringsmässigt kompletta plattan kan användas för att återställa mutanten för vidare studier.,

Figur 7. Identifiering av auxotrofa mutanter, som histidin auxotrophs, görs med replikplätering. Efter mutagenes identifieras kolonier som växer på näringsmässigt komplett medium men inte på medium som saknar histidin som histidin auxotrophs.
Tänk på det
- Varför är celler pläterade på en näringsmässigt komplett platta förutom näringsbrist plattor när man letar efter en mutant?,
Ames– testet
Ames-testet, utvecklat av Bruce Ames (1928 -) på 1970-talet, är en metod som använder bakterier för snabb, billig screening av den cancerframkallande potentialen hos nya kemiska föreningar. Testet mäter mutationshastigheten associerad med exponering för föreningen, som, om den är förhöjd, kan indikera att exponering för denna förening är förknippad med större cancerrisk., Ames-testet använder som testorganismen en stam av Salmonella typhimurium som är en histidin auxotroph, som inte kan syntetisera sin egen histidin på grund av en mutation i en väsentlig gen som krävs för dess syntes. Efter exponering för en potentiell mutagen, dessa bakterier är pläterade på ett medium som saknar histidin, och antalet mutanter återfå förmågan att syntetisera histidin registreras och jämfört med antalet sådana mutanter som uppstår i frånvaro av den potentiella mutagen (figur 8)., Kemikalier som är mer Mutagena kommer att medföra fler mutanter med återställd histidinsyntes i Ames-testet. Eftersom många kemikalier inte är direkt Mutagena men metaboliseras till Mutagena former av leverenzymer, ingår råttleverextrakt vanligen i början av detta experiment för att efterlikna levermetabolism. Efter att Ames-testet utförts testas föreningar som identifierats som Mutagena ytterligare för deras potentiella cancerframkallande egenskaper med hjälp av andra modeller, inklusive djurmodeller som möss och råttor.
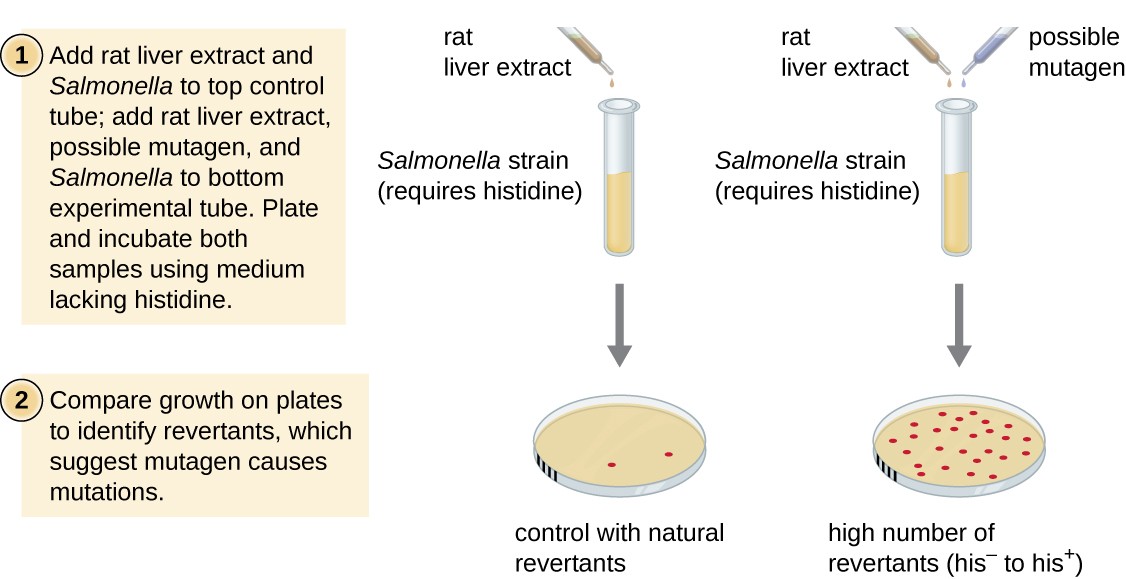
figur 8., Ames-testet används för att identifiera Mutagena, potentiellt cancerframkallande kemikalier. En Salmonella histidin auxotroph används som teststam, utsatt för en potentiell mutagen / carcinogen. Antalet reversion-mutanter som kan växa i frånvaro av levererat histidin räknas och jämförs med antalet naturliga Reversion-mutanter som uppstår i frånvaro av den potentiella mutagen.
Tänk på det
- vilken mutation används som en indikator på mutationshastighet i Ames-testet?
- Varför kan Ames-testet fungera som ett test för karcinogenicitet?,
nyckelbegrepp och sammanfattning
- en mutation är en ärftlig förändring i DNA. En mutation kan leda till en förändring i aminosyrasekvensen hos ett protein, vilket eventuellt påverkar dess funktion.
- en punktmutation påverkar ett enda baspar. En punktmutation kan orsaka en tyst mutation om mRNA codon koder för samma aminosyra, en missense mutation om mRNA codon koder för en annan aminosyra, eller en nonsens mutation om mRNA codon blir ett stopp kodon.,
- Missense-mutationer kan behålla funktionen, beroende på den nya aminosyrans Kemi och dess placering i proteinet. Nonsensmutationer producerar stympade och ofta icke-funktionella proteiner.
- en frameshiftmutation resulterar från en insättning eller radering av ett antal nukleotider som inte är en multipel av tre. Förändringen i läsramen förändrar varje aminosyra efter mutationspunkten och resulterar i ett icke-funktionellt protein.
- spontana mutationer uppstår genom DNA-replikationsfel, medan inducerade mutationer uppstår genom exponering för en mutagen.,
- Mutagena medel är ofta cancerframkallande men inte alltid. Men nästan alla cancerframkallande ämnen är Mutagena.
- kemiska mutagener inkluderar basanaloger och kemikalier som modifierar befintliga baser. I båda fallen introduceras mutationer efter flera omgångar av DNA-replikation.
- joniserande strålning, såsom röntgen och γ-strålar, leder till brott av fosfodiester ryggraden i DNA och kan också kemiskt modifiera baser för att ändra deras basparningsregler.,
- Nonioniserande strålning som ultraviolett ljus kan införa pyrimidin (tymin) dimer, som under DNA-replikation och transkription kan införa frameshift eller punktmutationer.
- celler har mekanismer för att reparera naturligt förekommande mutationer. DNA-polymeras har korrekturläsning aktivitet. Mismatch reparation är en process för att reparera felaktigt införlivade baser efter DNA-replikering har slutförts.
- Pyrimidindimerer kan också repareras., I nukleotid excision reparation (mörk reparation), enzymer känner igen den distorsion som införs av pyrimidin dimer och ersätta den skadade strängen med rätt baser, med hjälp av oskadade DNA-strängen som en mall. Bakterier och andra organismer kan också använda direkt reparation, där fotolyasenzymet, i närvaro av synligt ljus, bryter isär pyrimidinerna.
- genom jämförelse av tillväxt på hela plattan och brist på tillväxt på media som saknar specifika näringsämnen kan specifika förlust av funktionsmutanter som kallas auxotrophs identifieras.,
- Ames-testet är en billig metod som använder auxotrofa bakterier för att mäta mutagenicitet hos en kemisk förening. Mutagenicitet är en indikator på cancerframkallande potential.
flervalsfrågor
vilket av följande är en förändring i sekvensen som leder till bildandet av en stoppkodon?
- missense mutation
- nonsens mutation
- tyst mutation
- deletion mutation
bildandet av pyrimidindimerer är resultatet av vilket av följande?
- spontana fel genom DNA-polymeras
- exponering för gammastrålning
- exponering för ultraviolett strålning
- exponering för interkalerande medel
vilket av följande är ett exempel på en frameshiftmutation?
- en radering av en kodon
- missense mutation
- tyst mutation
- radering av en nukleotid
vilken av följande är den typ av DNA-reparation där tymindimerer bryts ner direkt av enzymet fotolyas?,
- direktreparation
- Nucleotide excision repair
- mismatch repair
- korrekturläsning
vilket av följande gäller Ames-testet är sant?
- Det används för att identifiera nybildade auxotrofa mutanter.
- Det används för att identifiera mutanter med återställd biosyntetisk aktivitet.
- Det används för att identifiera spontana mutanter.,
- Det används för att identifiera mutanter som saknar fotoreaktiveringsaktivitet.
fyll i blanketten
en kemisk mutagen som strukturellt liknar en nukleotid men har olika bas-parningsregler kallas en_______.,
enzymet som används vid ljusreparation för att dela tymindimerer kallas_______.
fenotypen av en organism som oftast observeras i naturen kallas_______.,
sant/falskt
cancerframkallande ämnen är vanligtvis Mutagena.
Tänk på det
Varför är det mer troligt att Infogningar eller raderingar kommer att vara mer skadliga för en cell än punktmutationer?,
Varför tror du att Ames-testet är att föredra framför användning av djurmodeller för att avskärma kemiska föreningar för mutagenicitet?
kritiskt tänkande
nedan finns flera DNA-sekvenser som muteras jämfört med vildtypssekvensen: 3′-T A C T G A C T G A C G A C G A T C-5′. Föreställa sig att var och en är en del av en DNA-molekyl som har separerat som förberedelse för transkription, så du ser bara mallsträngen., Konstruera de kompletterande DNA-sekvenserna (indikerar 5′ och 3 ’ändar) för varje muterad DNA-sekvens, transkribera sedan (indikerar 5′ och 3’ ändar) mallsträngarna och översätt mRNA-molekylerna med hjälp av den genetiska koden och registrera den resulterande aminosyrasekvensen (indikerar n och C termini). Vilken typ av mutation är varje?,>
komplementär DNA-sekvens:
mRNA-sekvens transkriberad från Mall:
aminosyrasekvens av peptid:
typ av peptid:
utation:
komplementär DNA-sekvens:
mRNA-sekvens transkriberad från Mall:
aminosyrasekvens av peptid:
typ av mutation: