hur element interagerar med varandra beror på hur deras elektroner är ordnade och hur många öppningar för elektroner finns i det yttersta området där elektroner finns i en atom. Elektroner finns på energinivåer som bildar skal runt kärnan. Det närmaste skalet kan hålla upp till två elektroner. Det närmaste skalet till kärnan fylls alltid först, innan något annat skal kan fyllas. Väte har en elektron; därför har den bara en plats ockuperad inom det lägsta skalet., Helium har två elektroner; därför kan det helt fylla det lägsta skalet med sina två elektroner. Om du tittar på det periodiska bordet ser du att väte och helium är de enda två elementen i första raden. Detta beror på att de bara har elektroner i sitt första skal. Väte och helium är de enda två elementen som har det lägsta skalet och inga andra skal.
den andra och tredje energinivån kan hålla upp till åtta elektroner. De åtta elektronerna är ordnade i fyra par och en position i varje par är fylld med en elektron innan några par är färdiga.,
Om du tittar på det periodiska bordet igen (Figur 1) kommer du att märka att det finns sju rader. Dessa rader motsvarar antalet skal som elementen inom den raden har. Elementen inom en viss rad har ökande antal elektroner som kolumnerna går från vänster till höger. Även om varje element har samma antal skal, är inte alla skalen helt fyllda med elektroner. Om du tittar på den andra raden i det periodiska bordet hittar du litium (Li), beryllium (Be), bor (B), kol (C), kväve (N), syre (O), fluor (F) och neon (Ne)., Dessa har alla elektroner som upptar endast de första och andra skalen. Litium har bara en elektron i sitt yttersta skal, beryllium har två elektroner, bor har tre, och så vidare tills hela skalet är fyllt med åtta elektroner, som är fallet med neon.
inte alla element har tillräckligt med elektroner för att fylla sina yttersta skal, men en atom är mest stabil när alla elektronpositioner i det yttersta skalet fylls., På grund av dessa lediga platser i de yttersta skalen ser vi bildandet av kemiska bindningar, eller interaktioner mellan två eller flera av samma eller olika element som resulterar i bildandet av molekyler. För att uppnå större stabilitet tenderar atomer att helt fylla sina yttre skal och kommer att binda med andra element för att uppnå detta mål genom att dela elektroner, Acceptera elektroner från en annan atom eller donera elektroner till en annan atom., Eftersom de yttersta skalen av elementen med låga atomnummer (upp till kalcium, med atomnummer 20) kan hålla åtta elektroner, kallas detta oktettregeln. Ett element kan donera, acceptera eller dela elektroner med andra element för att fylla sitt yttre skal och uppfylla oktettregeln.
När en atom inte innehåller lika många protoner och elektroner kallas den en jon. Eftersom antalet elektroner inte motsvarar antalet protoner har varje jon en nettoladdning. Positiva joner bildas genom att förlora elektroner och kallas katjoner., Negativa joner bildas genom att få elektroner och kallas anjoner.
natrium har till exempel endast en elektron i sitt yttersta skal. Det tar mindre energi för natrium att donera den en elektron än den gör för att acceptera sju elektroner för att fylla det yttre skalet. Om natrium förlorar en elektron, har den nu 11 protoner och endast 10 elektroner och lämnar den med en total laddning på +1. Det kallas nu en natriumjon.
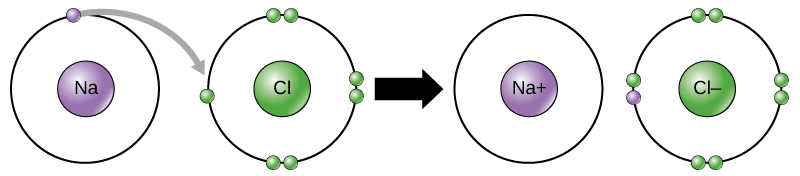
kloratomen har sju elektroner i sitt yttre skal. Återigen är det mer energieffektivt för klor att få en elektron än att förlora sju., Därför tenderar det att få en elektron för att skapa en jon med 17 protoner och 18 elektroner, vilket ger en netto negativ (-1) laddning. Det kallas nu en kloridjon. Denna rörelse av elektroner från ett element till ett annat kallas elektronöverföring. Som Figur 1 illustrerar har en natriumatom (Na) endast en elektron i sitt yttersta skal, medan en kloratom (Cl) har sju elektroner i sitt yttersta skal. En natriumatom kommer att donera sin en elektron för att tömma sitt skal, och en kloratom kommer att acceptera att elektron fyller sitt skal och blir klorid., Båda jonerna uppfyller nu oktettregeln och har fullständiga yttersta skal. Eftersom antalet elektroner inte längre är lika med antalet protoner, är var och en nu en jon och har en +1 (natrium) eller -1 (klorid) laddning.

jonbindningar
det finns fyra typer av bindningar eller interaktioner: Joniska, kovalenta, vätebindningar och van der Waals interaktioner. Joniska och kovalenta bindningar är starka interaktioner som kräver en större energiinmatning för att bryta ihop. När ett element donerar en elektron från sitt yttre skal, som i natriumatomen exemplet ovan, bildas en positiv jon (Figur 2). Elementet som accepterar elektronen är nu negativt laddat., Eftersom positiva och negativa laddningar lockar, håller dessa joner ihop och bildar en jonbindning eller en bindning mellan joner. Elementen binds tillsammans med elektronen från ett element som huvudsakligen vistas med det andra elementet. När Na + och Cl– joner kombineras för att producera NaCl, stannar en elektron från en natriumatom med de andra sju från kloratomen, och natrium-och kloridjonerna lockar varandra i en gitter av joner med en netto nollladdning.,
kovalenta bindningar
en annan typ av stark kemisk bindning mellan två eller flera atomer är en kovalent bindning. Dessa bindningar bildas när en elektron delas mellan två element och är den starkaste och vanligaste formen av kemisk bindning i levande organismer. Kovalenta bindningar bildar mellan de element som utgör de biologiska molekylerna i våra celler., Till skillnad från Joniska bindningar dissocierar inte kovalenta bindningar i vatten.
intressant nog mäter kemister och biologer bindningsstyrkan på olika sätt. Kemister mäter den absoluta styrkan hos en bindning (den teoretiska styrkan) medan biologer är mer intresserade av hur bindningen beter sig i ett biologiskt system, som vanligtvis är vattenhaltigt (vattenbaserat). I vatten kommer jonbindningar mycket lättare än kovalenta bindningar, så biologer skulle säga att de är svagare än kovalenta bindningar. Om du tittar i en Kemi lärobok, ser du något annat., Detta är ett bra exempel på hur samma information kan leda till olika svar beroende på det perspektiv som du tittar på det från.
väte-och syreatomerna som kombineras för att bilda vattenmolekyler binds samman av kovalenta bindningar. Elektronen från väteatomen delar sin tid mellan väteatomens yttre skal och syreatomens ofullständiga yttre skal. För att helt fylla det yttre skalet av en syreatom behövs två elektroner från två väteatomer, därav prenumerationen ” 2 ” i H2O., Elektronerna delas mellan atomerna och delar sin tid mellan dem för att” fylla ” det yttre skalet av varje. Denna delning är ett lägre energitillstånd för alla inblandade atomer än om de existerade utan deras yttre skal fyllda.
det finns två typer av kovalenta bindningar: polära och icke-polära. Icke-polära kovalenta bindningar bildar mellan två atomer av samma element eller mellan olika element som delar elektronerna lika. Till exempel kan en syreatom binda med en annan syreatom för att fylla sina yttre skal., Denna förening är nonpolär eftersom elektronerna kommer att fördelas lika mellan varje syreatom. Två kovalenta bindningar bildar mellan de två syreatomerna eftersom syre kräver två delade elektroner för att fylla sitt yttersta skal. Kväveatomer kommer att bilda tre kovalenta bindningar (även kallad trippelkovalent) mellan två kväveatomer eftersom varje kväveatom behöver tre elektroner för att fylla sitt yttersta skal. Ett annat exempel på en icke-polär kovalent bindning finns i metan (CH4) – molekylen. Kolatomen har fyra elektroner i sitt yttersta skal och behöver fyra mer för att fylla den., Det får dessa fyra från fyra väteatomer, varje atom ger en. Dessa element delar alla elektronerna lika, vilket skapar fyra icke-polära kovalenta bindningar (Figur 3).
i en polär kovalent bindning spenderar elektronerna som delas av atomerna mer tid närmare en kärna än den andra kärnan. På grund av den ojämna fördelningen av elektroner mellan de olika kärnorna utvecklas en något positiv (δ+) eller något negativ (δ–) laddning. Kovalenta bindningar mellan väte och syreatomer i vatten är polära kovalenta bindningar., De delade elektronerna spenderar mer tid nära syrekärnan, vilket ger en liten negativ laddning än de spenderar nära vätekärnorna, vilket ger dessa molekyler en liten positiv laddning.

vätebindningar
Joniska och kovalenta bindningar är starka bindningar som kräver stor energi att bryta. Men inte alla bindningar mellan element är joniska eller kovalenta bindningar. Svagare obligationer kan också bildas. Dessa är attraktioner som uppstår mellan positiva och negativa avgifter som inte kräver mycket energi att bryta. Två svaga bindningar som förekommer ofta är vätebindningar och van der Waals interaktioner. Dessa bindningar ger upphov till de unika egenskaperna hos vatten och de unika strukturerna av DNA och proteiner.,
När polära kovalenta bindningar som innehåller en väteatomform har väteatomen i den bindningen en något positiv laddning. Detta beror på att den delade elektronen dras starkare mot det andra elementet och bort från vätekärnan. Eftersom väteatomen är något positiv (δ+), kommer den att lockas till närliggande negativa partiella laddningar (δ–). När detta händer uppträder en svag interaktion mellan δ+ – laddningen av väteatomen i en molekyl och δ– laddningen av den andra molekylen. Denna interaktion kallas en vätebindning., Denna typ av bindning är vanligt; till exempel, den flytande naturen av vatten orsakas av vätebindningar mellan vattenmolekyler (Figur 4). Vätebindningar ger vatten de unika egenskaperna som upprätthåller livet. Om det inte vore för väte bindning, skulle vatten vara en gas snarare än en vätska vid rumstemperatur.

vätebindningar kan bildas mellan olika molekyler och de behöver inte alltid inkludera en vattenmolekyl. Väteatomer i polära bindningar inom vilken molekyl som helst kan bilda bindningar med andra intilliggande molekyler. Till exempel håller vätebindningar ihop två långa strängar av DNA för att ge DNA-molekylen sin karakteristiska dubbelsträngade struktur. Vätebindningar är också ansvariga för en del av proteins tredimensionella struktur.,
van der Waals interaktioner
som vätebindningar, van der Waals interaktioner är svaga attraktioner eller interaktioner mellan molekyler. De förekommer mellan polära, kovalent bundna, atomer i olika molekyler. Några av dessa svaga attraktioner orsakas av tillfälliga partiella avgifter som bildas när elektroner rör sig runt en kärna. Dessa svaga interaktioner mellan molekyler är viktiga i biologiska system.