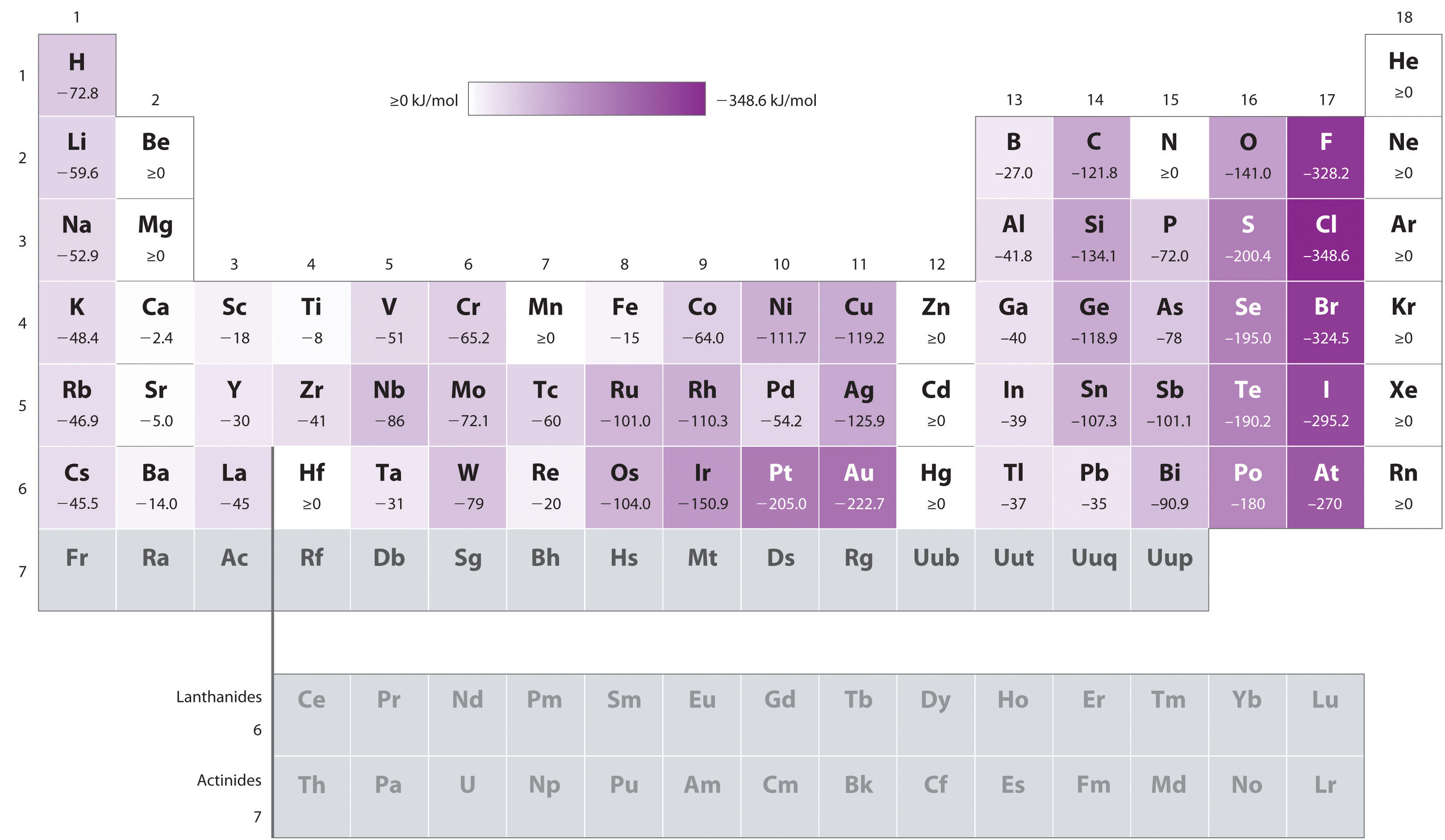
Atome mit den größten Radien, die die niedrigsten Ionisationsenergien (Affinität zu ihren eigenen Valenzelektronen) aufweisen, haben ebenfalls die niedrigste Affinität für ein hinzugefügtes Elektron. Es gibt jedoch zwei wichtige Ausnahmen von diesem Trend:
- Die Elektronenaffinitäten der Elemente B bis F in der zweiten Zeile des Periodensystems sind weniger negativ als die der Elemente unmittelbar darunter in der dritten Zeile., Anscheinend überwinden die erhöhten Elektronen–Elektronen–Abstoßungen, die von Elektronen erfahren werden, die auf die relativ kleinen 2p-Orbitale beschränkt sind, die erhöhte Elektronen-Kern-Anziehung bei kurzen nuklearen Entfernungen. Fluor hat daher eine geringere Affinität für ein hinzugefügtes Elektron als Chlor. Folglich haben die Elemente der dritten Reihe (n = 3) die negativsten Elektronenaffinitäten. Weiter unten in einer Säule nimmt die Anziehungskraft für ein hinzugefügtes Elektron ab, da das Elektron in ein vom Kern entfernteres Orbital eintritt., Elektronen-Elektronen-Abstoßungen nehmen ebenfalls ab, weil die Valenzelektronen ein größeres Raumvolumen einnehmen. Diese Effekte neigen dazu, sich gegenseitig aufzuheben, so dass die Änderungen der Elektronenaffinität innerhalb einer Familie viel kleiner sind als die Änderungen der Ionisationsenergie.
- Die Elektronenaffinitäten der Erdalkalimetalle werden von Be bis Ba negativer. Die Energietrennung zwischen den gefüllten ns2 und den leeren np-Unterschalen nimmt mit zunehmendem n ab, so dass die Bildung eines Anions aus den schwereren Elementen energetisch günstiger wird.,
Die Gleichungen für zweite und höhere Elektronenaffinitäten sind analog zu denen für zweite und höhere Ionisationsenergien:
\
\
Wie wir gesehen haben, kann die erste Elektronenaffinität je nach Elektronenkonfiguration des Atoms größer oder gleich Null oder negativ sein. Im Gegensatz dazu ist die zweite Elektronenaffinität immer positiv, da die erhöhten Elektronen-Elektronen-Abstoßungen in einem Dianion weitaus größer sind als die Anziehungskraft des Kerns für die zusätzlichen Elektronen., Zum Beispiel ist die erste Elektronenaffinität von Sauerstoff -141 kJ/mol, aber die zweite Elektronenaffinität ist +744 kJ/mol:
\
\
Somit ist die Bildung eines gasförmigen Oxids (\(O^{2−}\)) Ion energetisch ziemlich ungünstig (geschätzt durch Addieren beider Schritte):
\
Während das erste Elektron affinitäten können negativ, positiv oder Null sein, zweite Elektronenaffinitäten sind immer positiv.,
Wenn Energie benötigt wird, um sowohl positiv geladene Kationen als auch einatomige Polyanionen zu bilden, warum bilden sich ionische Verbindungen wie \(MgO\), \(Na_2S\) und \(Na_3P\) überhaupt? Der Schlüsselfaktor bei der Bildung stabiler ionischer Verbindungen sind die günstigen elektrostatischen Wechselwirkungen zwischen den Kationen und den Anionen im kristallinen Salz.
Beispiel \(\paeindex{1}\): Kontrastierende Elektronenaffinitäten von Sb, Se und Te
Basierend auf ihren Positionen im Periodensystem, welche von Sb, Se oder Te würden Sie vorhersagen, um die negativste Elektronenaffinität zu haben?,
Gegeben: drei Elemente
Gefragt: Element mit der meisten negativen Elektronenaffinität
Strategie:
- Suchen Sie die Elemente im Periodensystem. Verwenden Sie die Trends in Elektronenaffinitäten, die in einer Spalte für Elemente derselben Gruppe nach unten gehen. Verwenden Sie in ähnlicher Weise die Trends der Elektronenaffinitäten von links nach rechts für Elemente in derselben Zeile.
- Ordnen Sie die Elemente in der Reihenfolge an und listen Sie zuerst das Element mit der negativsten Elektronenaffinität auf.,
Lösung:
A Wir wissen, dass Elektronenaffinitäten in einer Spalte weniger negativ werden (mit Ausnahme der anomal niedrigen Elektronenaffinitäten der Elemente der zweiten Zeile), sodass wir vorhersagen können, dass die Elektronenaffinität von Se negativer ist als die von Te. Wir wissen auch, dass Elektronenaffinitäten von links nach rechts in einer Zeile negativer werden und dass die Elemente der Gruppe 15 tendenziell Werte haben, die weniger negativ als erwartet sind., Da sich Sb links von Te befindet und zur Gruppe 15 gehört, sagen wir voraus, dass die Elektronenaffinität von Te negativer ist als die von Sb. Die Gesamtreihenfolge ist Se < Te < Sb, daher hat Se die negativste Elektronenaffinität unter den drei Elementen.