Allgemein
Muskarinrezeptoren, die auf den natürlichen Liganden Acetylcholin reagieren, haben eine weit verbreitete Gewebeverteilung und sind an der Kontrolle zahlreicher zentraler und peripherer physiologischer Reaktionen beteiligt sowie ein wichtiges Arzneimittelziel bei menschlichen Erkrankungen. Es ist seit einiger Zeit bekannt, dass diese Familie von G-Protein-gekoppelten Rezeptoren aus fünf Mitgliedern besteht, die M1-M5 bezeichnet werden . Die Genfamilie als Ganzes zeigt 26.,3% Gesamtaminosäureidentität, wobei die Variation zwischen den Rezeptorsubtypen weitgehend innerhalb der intrazellulären Schleifen zu sehen ist. Die dritte intrazelluläre Schleife ist besonders variabel und zeigt nur 2,7% Identität zwischen Rezeptor, verglichen mit einem Durchschnitt von 66% Identität in den konservierten Transmembrandomänen gefunden. Klassisch werden diese Rezeptoren in zwei große Gruppen unterteilt, basierend auf ihrer primären Kopplungseffizienz an G-Proteine., Daher sind M2 – und M4-Muskarinrezeptoren in der Lage, sich an die Pertusiss-Toxin-empfindlichen Gi/o-Proteine und M1 -, M3-und M5-Muskarinrezeptoren an Gq/11-Proteine zu koppeln . Es ist jedoch klar, dass sich die Muscarin-Rezeptorfamilie an eine Vielzahl verschiedener Signalwege koppeln kann, von denen einige durch G-Proteine und andere, die G-Protein-unabhängig sind, vermittelt werden .
Muskarinrezeptorpharmakologie
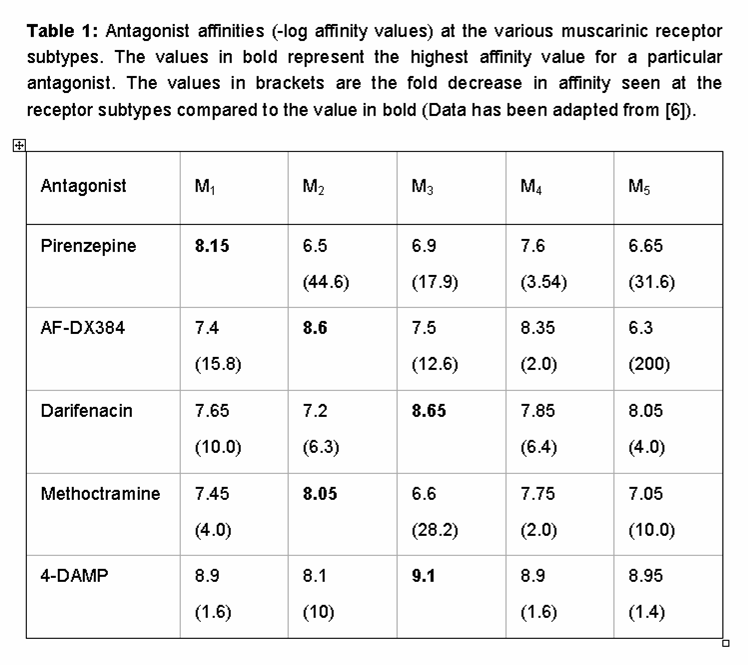
Die orthosterische Bindungsstruktur der Muskarinrezeptorfamilie ist stark konserviert, was die Entwicklung subtypspezifischer Agonisten und Antagonisten sehr erschwert., Tabelle 1 zeigt die Bindungsaffinitäten einiger der am häufigsten verwendeten Muskarinrezeptorliganden und betont das bescheidene Ausmaß der Subtypspezifität dieser Wirkstoffe. Im Falle von Pirenzepin weist dieser Antagonist beispielsweise eine 44-fache Selektivität für den M1-Muskarinrezeptor über den M2 auf, jedoch nur eine 17,9-und 3,5-fache Selektivität für die M3-bzw. In ähnlicher Weise hat Darifenacin, das weithin als M3-selektiv angesehen wird und für die klinische Anwendung bei der Behandlung von überaktiver Blase zugelassen ist, eine ≤10-fache Selektivität gegenüber M1/M4/M5-Rezeptoren .,
Versuche zur Erzeugung neuartiger muskarinischer Liganden konzentrierten sich in jüngerer Zeit auf die Entwicklung allosterischer Regulatoren, die an nicht konservierten Standorten wirken und daher die Aussicht auf Subtypselektivität bieten . Durch das Targeting allosterischer Stellen muskarinischer Rezeptoren, die in den extrazellulären Schleifen und extrazellulären Regionen der Transmembranhelices enthalten sind, können allosterische Modulatoren die Bindungsaffinität von Liganden an der orthosterischen Stelle regulieren., Zum Beispiel ist in Gegenwart des allosterischen Modulators Thiochrom die Affinität von Acetylcholin am M4-Muskarinrezeptor erhöht, aber die Affinität von Acetylcholin zu den anderen Muskarinrezeptorsubtypen ist unberührt . Darüber hinaus wurden auch subtypselektive Agonisten berichtet, die über von der orthosterischen Bindungsstelle unterschiedliche Bindungsdomänen an den Rezeptor binden und diesen aktivieren. Dazu gehören die hoch M1-selektiven allosterischen Agonisten AC-42 und TBPB ., Diese neuartigen Agonisten haben ein beträchtliches therapeutisches Potenzial, aber wie ihre Signaleigenschaften mit orthosterisch wirkenden Wirkstoffen verglichen werden, wird erst langsam erforscht .
Somit besteht der potenzielle therapeutische Nutzen von allosterischen Modulatoren/Agonisten darin, dass sie Subtypselektivität in einer Weise zeigen, die mit orthosterischen Liganden nicht erreichbar ist. Darüber hinaus können die allosterischen Modulatoren, die durch Regulierung der Affinität des natürlichen Liganden wirken, nur dann aktiv sein, wenn und wo Acetylcholin vorhanden ist, und daher potenzielle Nebenwirkungen reduzieren .,
Muskarinrezeptor physiologische Rolle
Die Rolle der Muskarinrezeptoren bei der Kontraktion der glatten Muskulatur, insbesondere der Atemwege, des Ileums, der Iris und der Blase, wird als klassische Muskarinreaktion angesehen, die hauptsächlich durch M3-Muskarinrezeptoren vermittelt wird, die auf den glatten Muskelzellen exprimiert werden . Co-exprimiert mit den M3-Muskarinrezeptoren in der glatten Muskulatur ist eine oft größere Population von M2-Muskarinrezeptoren, die eine viel kleinere Rolle bei der kontraktilen Reaktion der glatten Muskulatur zu spielen scheinen ., Im Gegensatz dazu spielen M2-Muskarinrezeptoren, die im Herzen exprimiert werden, eine tiefgreifende Rolle bei der Kontrolle der Herzmyozytenkontraktion . Hier reduziert die Freisetzung von Acetylcholin aus vagalen parasympathischen Neuronen die Herzschlagfrequenz fast ausschließlich, indem sie an M2-muskarinischen Rezeptoren wirkt . Die exokrine Sekretion, insbesondere von Speichel, und wie in jüngerer Zeit gezeigt , Insulin, wird hauptsächlich durch M3-Muskarinrezeptoren vermittelt, wobei M1-Rezeptoren insbesondere bei Kindern eine geringere Rolle spielen .,
Die Erzeugung von transgenen Muskarinrezeptor-Knockout-Mäusen, bei denen M1-M5-Gene abgetrennt wurden, hat zahlreiche neuartige Muskarinrezeptorfunktionen aufgedeckt . Muskarinrezeptor-Knockout-Mäuse sind lebensfähig und fruchtbar ohne größere physiologische Defekte, was die Untersuchung der physiologischen Rolle dieser Rezeptoren bei erwachsenen Mäusen in vivo ermöglicht. Besonders faszinierend waren die zahlreichen beobachteten verhaltens-und neurologischen Phänotypen, die die wichtige neuromodulatorische Rolle dieser Rezeptorfamilie aufdeckten., M1-Muskarinrezeptor-Knockout-Mäuse zeigen einen ausgeprägten Anstieg der Bewegungsaktivität, von dem vorgeschlagen wurde, dass er sich auf das Gedächtnis und das Lernen auswirkt, und können ein Modell für Lerndefizite unter Bedingungen wie Aufmerksamkeitsdefizit-Hyperaktivitätsstörung liefern . Weitere lokomotorische Phänotypen werden bei M4-muskarinischen Rezeptor-Knockout-Tieren beobachtet, bei denen angenommen wird, dass dieser Rezeptor-Subtyp einen hemmenden Einfluss auf die striatale Dopamin-vermittelte lokomotorische Aktivität vermittelt ., M2-Muskarinrezeptoren, die in den thermoregulatorischen Zentren des Hypothalamus exprimiert werden, sind wahrscheinlich an der Regulation der Körpertemperatur beteiligt , während M3-Muskarinrezeptoren Berichten zufolge den Appetit durch die Regulation der melaninkonzentrierenden Hormon (MCH)-Neurone im hypothalamischen Fütterungszentrum modulieren .,
Muskarinrezeptoren als Medikamentenziele
Im Einklang mit einem besseren Verständnis der neuromodulatorischen Rolle von Muskarinrezeptoren ist ein größerer Fokus auf die Möglichkeit gelegt worden, dass diese Rezeptorfamilie wirksame therapeutische Ziele bei einer Reihe von neurologischen und psychiatrischen Erkrankungen sein kann . In der Vergangenheit konzentrierte sich dieser Fokus auf die Alzheimer-Krankheit, die mit einem Verlust der cholinergen Innervation in der Großhirnrinde und im Hippocampus einhergeht, und wird derzeit durch Verbesserung der cholinergen Übertragung über pharmakologische Hemmung der Cholinesterase-Aktivität behandelt., Während seit vielen Jahren angenommen wurde , dass diese Behandlung ihre positiven Auswirkungen durch Stimulation des M1-muskarinischen Rezeptor-Subtyps hat, hat die Arbeit an den M1-Rezeptor-Knockout-Mäusen vorgeschlagen, dass dieser Rezeptor-Subtyp möglicherweise keine so wichtige Rolle in der Kognition spielt wie bisher angenommen . Daher werden neuartige Anti-Alzheimer-Medikamente, die auf andere Muskarinrezeptor-Subtypen abzielen, wie die M2 -, M4-und M5-Muskarinrezeptoren, jetzt intensiver untersucht., Interessanterweise hat die Muskarinrezeptormodulation der dopaminergen Übertragung den Anstoß für die Entwicklung muskarinischer Rezeptorliganden bei der Behandlung von Schizophrenie und Parkinson gegeben . In beiden Fällen lag der Fokus auf den M1-und M4-Muskarinrezeptoren, wobei angegeben wurde, dass Agonisten für diese Rezeptoren bei Schizophrenie von Vorteil sein könnten und Antagonisten bei der Parkinson-Krankheit wahrscheinlich von Vorteil sind.,
Neben dem therapeutischen Potenzial, spezifische Muskarinrezeptoren bei ZNS-Erkrankungen anzusprechen, besteht noch ein erhebliches therapeutisches Potenzial bei der Entwicklung muskarinischer Liganden zu den klassischeren muskarinisch-zentrierten Krankheitszielen. Bei chronisch obstruktiver Lungenerkrankung (COPD) und Asthma, die derzeit mit den nichtselektiven muskarinischen Antagonisten Ipratropium und Tiotropium behandelt werden , könnte beispielsweise ein signifikanter klinischer Nutzen aus der Entwicklung selektiver M2-und M3-Muskarinrezeptorliganden resultieren., In ähnlicher Weise würde in der überaktiven Blase eine verbesserte Selektivität der Muskarinrezeptorliganden dazu beitragen, unerwünschte Nebenwirkungen zu reduzieren . Tabelle 2 (angepasst von ref) enthält eine Liste der potenziellen therapeutischen Anwendungen von Verbindungen, die spezifisch auf Muskarinrezeptor-Subtypen abzielen.
