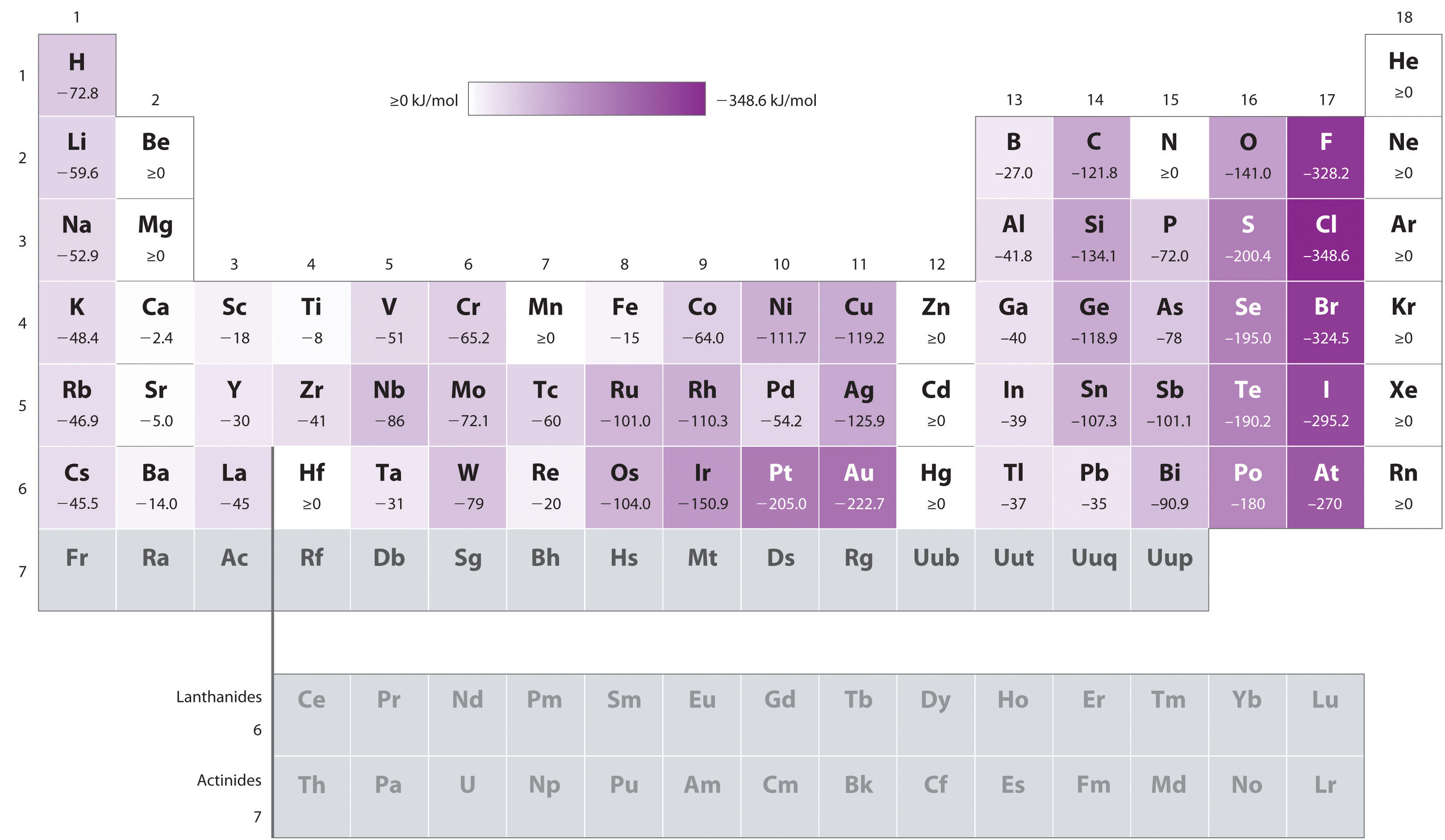
Atomer med den største radier, der har den laveste ionisering energi (affinitet for deres egen valence elektroner), der også har den laveste tilknytning til en ekstra elektron. Der er dog to store undtagelser fra denne tendens:
- elektronaffiniteterne af elementer B til F i den anden række i det periodiske bord er mindre negative end elementerne umiddelbart under dem i den tredje række., Tilsyneladende overvinder de øgede elektron–elektronafstødninger, der opleves af elektroner, begrænset til de relativt små 2p–orbitaler den øgede elektron-kernetiltrækning ved korte nukleare afstande. Fluor har derfor en lavere affinitet for en tilsat elektron end klor. Følgelig har elementerne i den tredje række (n = 3) de mest negative elektronaffiniteter. Længere ned ad en søjle falder tiltrækningen for en tilføjet elektron, fordi elektronen kommer ind i en orbital fjernere fra kernen., Elektron-elektronafstødninger falder også, fordi valenselektronerne optager et større rumfang. Disse effekter har en tendens til at annullere hinanden, så ændringerne i elektronaffinitet i en familie er meget mindre end ændringerne i ioniseringsenergi.
- elektronaffiniteterne af jordalkalimetallerne bliver mere negative fra Be til Ba. Den energi adskillelse mellem det fyldte ns2 og den tomme np subshells falder med stigende n, således at dannelsen af en anion fra de tungere grundstoffer bliver energisk mere gunstige.,
De ligninger, der for anden og højere elektron tilhørsforhold, er analoge til dem for anden og højere ionisering energi:
\
\
Som vi har set, den første elektron affinitet kan være større end eller lig med nul eller negativ, afhængig af den elektron konfiguration af atomet. I modsætning hertil er den anden elektronaffinitet altid positiv, fordi de øgede elektron–elektronafstødninger i en dianion er langt større end tiltrækningen af kernen for de ekstra elektroner., For eksempel, den første elektron affinitet for ilt er -141 kJ/mol, men den anden elektron affinitet +744 kJ/mol:
\
\
Dermed dannelsen af et gasformigt oxid (\(O^{2−}\)) ion er energisk ganske ugunstige (anslået ved at tilføje både trin):
\
Mens første elektron tilhørsforhold kan være negativt, positivt eller nul, anden elektron tilhørsforhold er altid positiv.,
Hvis energi er forpligtet til at danne både positivt ladede kationer og monatomic polyanions, hvorfor ionforbindelser, f.eks. \(MgO\), \(Na_2S\), og \(Na_3P\) form på alle? Nøglefaktoren i dannelsen af stabile ionforbindelser er de gunstige elektrostatiske interaktioner mellem kationerne og anionerne i det krystallinske salt.
Eksempel \(\PageIndex{1}\): Kontrasterende Elektron Tilhørsforhold af Sb, Se, Te
Baseret på deres positioner i den periodiske tabel, som af Sb, Se, eller Te, vil du forudsige, at det har den mest negative elektron affinitet?,
i Betragtning af: tre elementer
Bedt om: – element med mest negativ elektron affinitet
Strategi:
- Find de elementer i det periodiske system. Brug tendenser i elektron affiniteter går ned en kolonne for elementer i samme gruppe. Tilsvarende skal du bruge tendenserne i elektronaffiniteter fra venstre mod højre for elementer i samme række.
- Placer elementerne i rækkefølge, og angiv elementet med den mest negative elektronaffinitet først.,
Løsning:
A Vi ved, at en elektron tilhørsforhold blevet mindre negativ gå ned i en kolonne (undtagen for anomalt lave elektron tilhørsforhold af elementerne i den anden række), så kan vi forudsige, at en elektron affinitet af Se-selskabet er mere negativ end Te. Vi ved også, at elektronaffiniteter bliver mere negative fra venstre mod højre på tværs af en række, og at Gruppe 15-elementerne har en tendens til at have værdier, der er mindre negative end forventet., Fordi Sb er placeret til venstre for Te og tilhører gruppe 15, forudsiger vi, at elektronaffiniteten af Te er mere negativ end Sb. Den samlede rækkefølge er se < Te < Sb, så Se har den mest negative elektronaffinitet blandt de tre elementer.