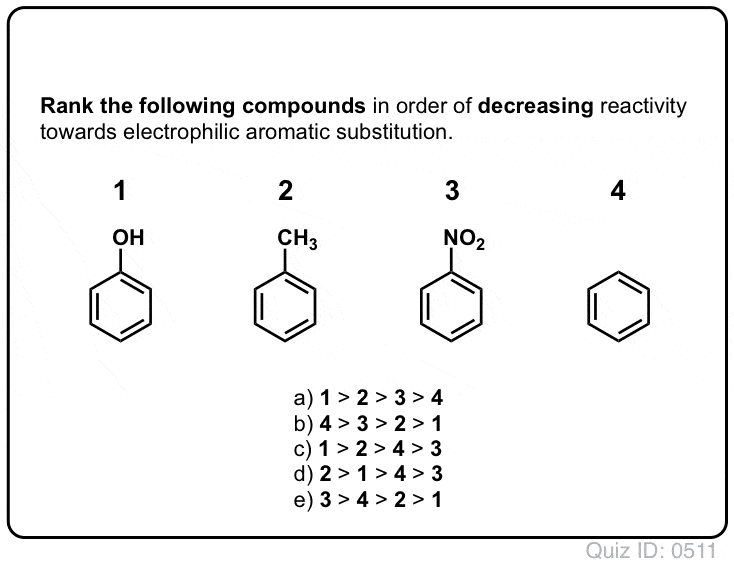
I tidligere indlæg har vi indført ortho- ,para – og meta – direktører i elektrofile aromatiske substitution. Tidligere dækkede vi mekanismen for elektrofil aromatisk substitution og viste, at mekanismen fortsætter gennem et carbocation-mellemprodukt.,
i Dag, vi kommer til at binde de to begreber sammen, og forsøge at vise, at uanset om en substituent er en ortho-, para – eller meta – direktør, afhænger af, hvordan substituent påvirker stabiliteten af carbocation mellemliggende.
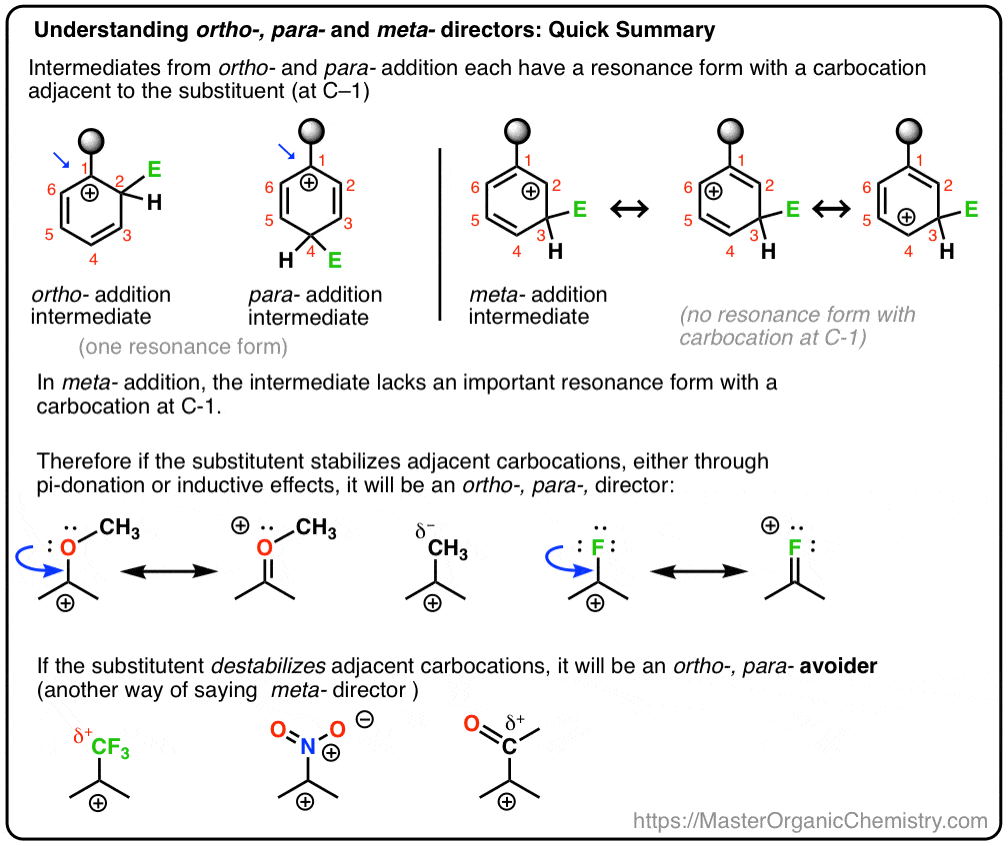
Og vi vil også se, hvorfor et alternativt navn for meta – direktør kan være, “ortho-, para – have”. : – )
Indholdsfortegnelse
- vigtige forbindelser er gan Er Stabiliseret Af Tilstødende Atomer Med Lone Pairs
- Undersøgelse #1: En ortho-,para – Direktør (OCH3)
- Ja, Ilt Er Elektronegative., Men Donation Af Sin Enlige Par Mere End Gør Op For Det!
- Reaktionsenergidiagrammet For en Ortho Para-direktør
- casestudie #2: en meta – direktør (CF3).
- Hvad Vi Kalder “meta– Bestyrelsen” Er Mere Som “ortho-, para– unddrager sig”
- Reaktionen Energi Diagram For En meta – Direktør
- Så Hvorfor Er Halogener Ortho-, Para – Direktører?
- noter
- Quui Yourself dig selv!,
- (avancerede) referencer og yderligere læsning
karbokationer stabiliseres af tilstødende atomer med ensomme par
lad os tænke tilbage på hvilke faktorer der øger stabiliteten af karbokationer. Carbocations er elektronfattige arter med seks elektroner i deres valensskal. Så enhver substituent, der kan donere elektrondensitet mod carbocation, vil stabilisere sig. Dette omfatter:
- elektronfrigivende substituenter, der kan fungere som “Sigma-donorer” (f. eks., mange alkyl-grupper, som donere elektron densitet gennem induktiv effekter )
- tilstødende atomer med enlige par, der kan fungere som “pi donorer” til carbocation
- tilstødende C–C pi obligationer, der kan stabilisere carbocation gennem afgift delocalization (“resonans ” stabilisering”, med andre ord).
og faktorer, der destabiliserer carbocations?
- enhver substituent, der fjerner elektrondensitet fra en carbocation, såsom stærke elektronudtrækkende grupper.
så her er en hurtig quui.., I betragtning af alt skrevet ovenfor, hvilken af de to carbocations nedenfor vil være mere stabil?
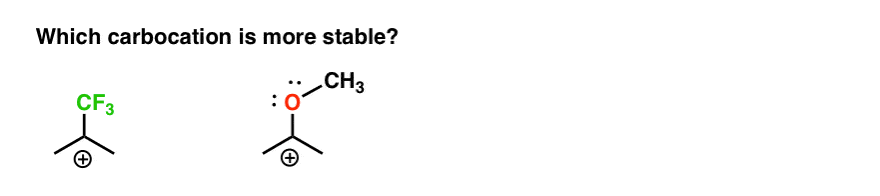
Hvis du kan besvare dette spørgsmål godt, er du mest på vej mod at forstå forskellen mellem ortho-, para – og meta – direktører.
lad os undersøge to casestudier. Vi vil se på en generisk elektrofile aromatiske substitution reaktion af benzen med en ortho-, para – direktør (methoxybenzen), og undersøge de mellemprodukter, der er fremstillet af angreb på ortho, meta og para positioner., Så udfører vi den samme øvelse med en meta– direktør (trifluormethylben .en).
i processen håber vi at forstå, hvorfor metho .yben .en favoriserer ortho – og para– produkter, mens trifluormethylben .en favoriserer meta – produktet.
Undersøgelse #1: En ortho-,para – Direktør (OCH3)
Elektrofile aromatiske substitution af methoxybenzen tendens til at give ortho – og para – produkter med meget lidt meta- ., Her er, hvad der sker i nitrering, for eksempel:
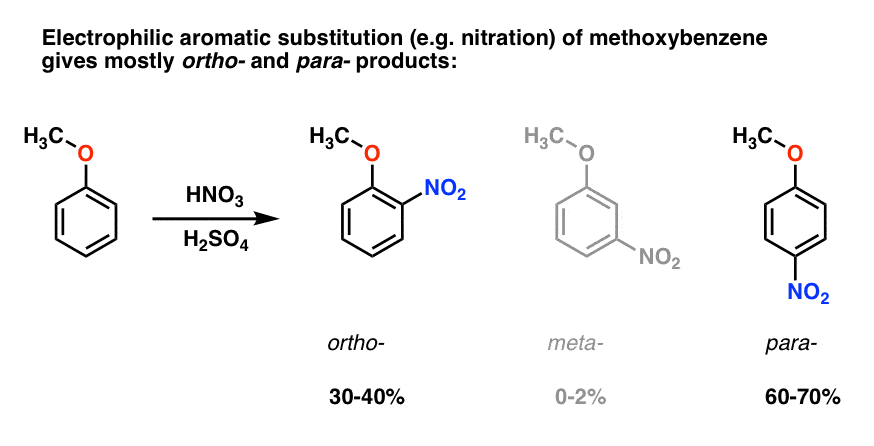
para – produkt, der dominerer (60-70%), med ortho – tæt bag (30-40%) og kun et spor af meta– .
hvorfor?
3. Ja, Ilt Er Elektronegativt. Men Donation Af Sin Enlige Par Mere End Gør Op For Det!
Her er vejen, der fører til ortho – produktet., Vi bryde en C–C pi bond og danne en ny C–E bond (hvor E er beregnet til at repræsentere et generisk electrophile), skaber en resonans-stabiliseret carbocation:
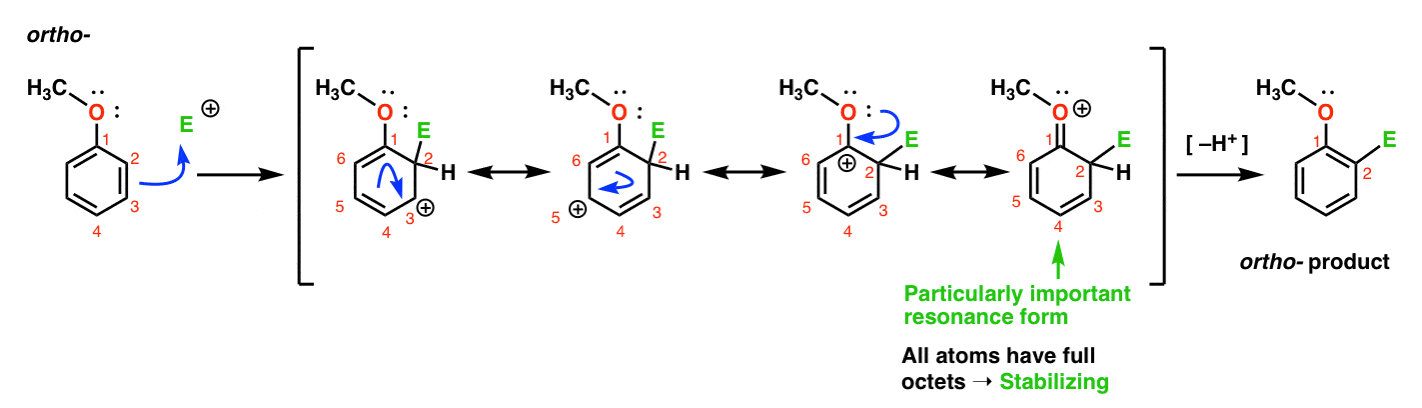
Hvis du ser nøje, bør du bemærke at vi kan danne fire resonans former . Tre af dem bærer fulde karbokationer (på C1, C3 og C5), men det er den fjerde – resonansformen, hvor der er en C=O pi – binding-hvilket er særlig vigtigt. Hvorfor? I denne resonansform har alle carbonatomer en fuld oktet af elektroner., Det skyldes, at iltet, der er direkte bundet til ringen, kan donere et ensomt par til den tilstødende carbocation, der danner en pi-binding. Dette er et eksempel på pi donation.
Her er vejen for angreb af elektrofil ved metapositionen. Bemærk forskellen!
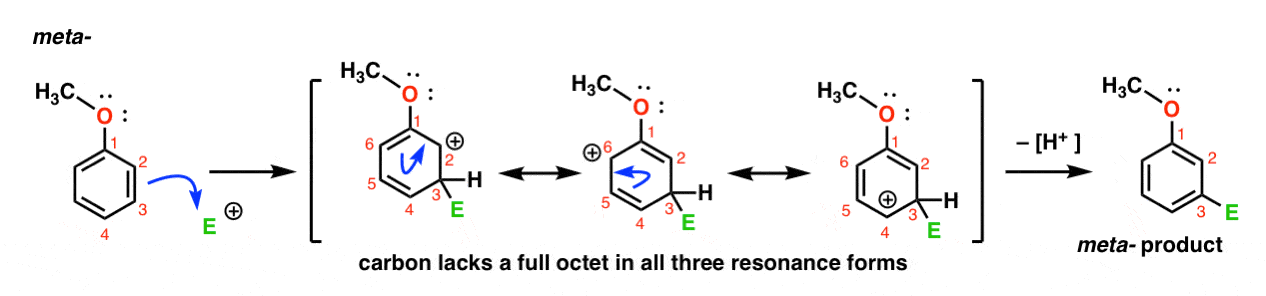
angreb af elektrofil ved C-3 resulterer i en carbocation, som kan delokaliseres via resonans til C2, C4 og C6. Der er dog ingen måde at” flytte ” carbocation til C1, hvilket betyder, at der ikke er nogen rimelig resonansformular, hvor alle atomer har fulde oktetter.,dette gør meta-carbocation-mellemproduktet meget mindre stabilt end ortho – carbocation-mellemproduktet.
Endelig, her er den reaktion, der fører til de para – produkt:
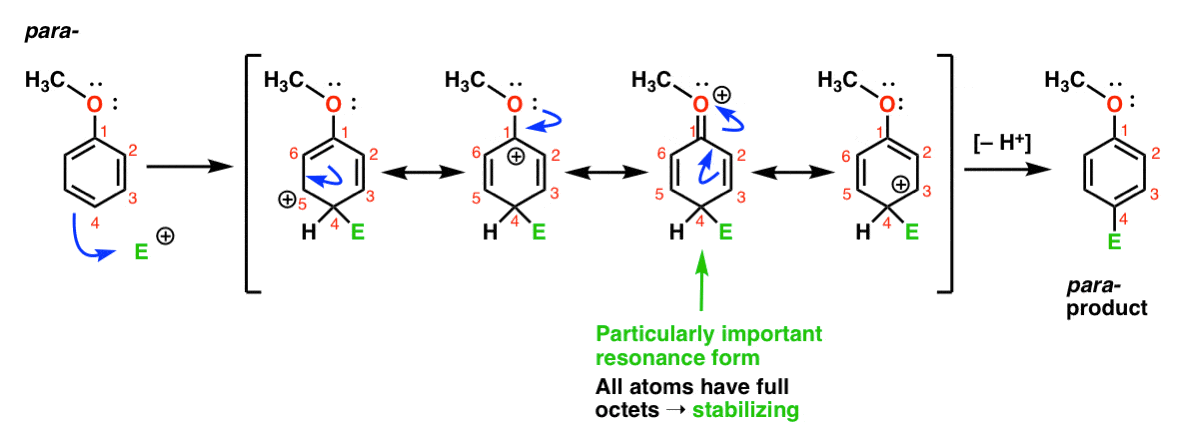
Her kan vi igen trække resonans former med vigtige forbindelser er gan på C1, C3 og C5, samt en fjerde resonans form, hvor den er knyttet ilt atom donerer en elektron par til carbocation på C1, hvilket resulterer i en fuld oktet i carbon. Dette er en situation, der i det væsentlige er den samme som ortho – intermediate.,
Så, ved hjælp af analyse af den resonans, former (og mærk dem mine ord, du kan blive bedt om at gøre det samme på en prøve i den nærmeste fremtid) kan vi se, at de mellemliggende vigtige forbindelser er gan som følge af ortho – og para– desuden er væsentlig mere stabil end den mellemliggende fra meta– over.
Dette forklarer, hvorfor ortho – og para – produkter dominerer, og meta – produktet er mindre.
det kan være nyttigt at visualisere dette ved at tegne et reaktionsenergidiagram.
4., Reaktionsenergidiagrammet for en Ortho Para-direktør
overgangstilstanden, der fører til ortho – og para – addition– produkterne, er meget lavere i energi end meta -.
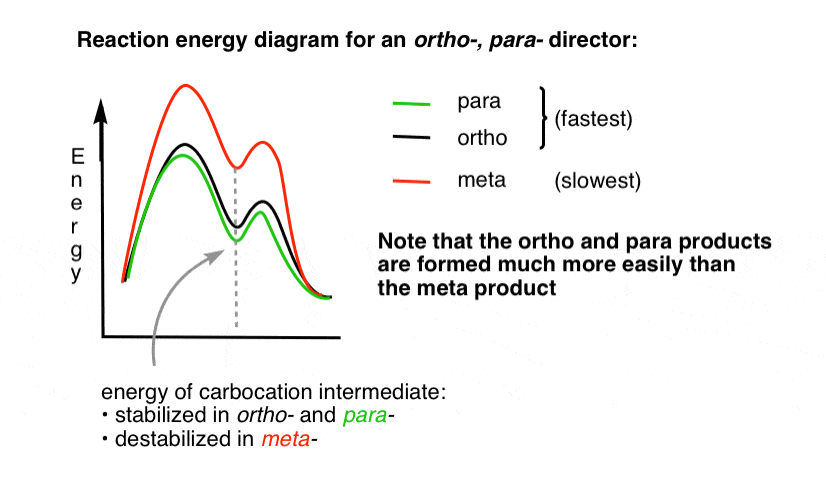
Et spørgsmål, – hvorfor tror du, at para – kan blive begunstiget (fx 60%-70% af udbyttet for para– produkt af nitrering frem mod 30-40% for ortho-) selv om der er to ortho – positioner, og kun en para- ?
tænk over det i et øjeblik, og vi adresserer det nedenfor.
5. Casestudie # 2: en meta-direktør (CF3).
Så hvad med CF3?, Hvorfor giver det meta-produkter? Lad os lave den samme type analyse.
Her er vejen, der fører til ortho – produktet. Som med ortho-intermediate ovenfor kan vi tegne tre resonansformer, der placerer carbocation på henholdsvis C1, C3 og C5.
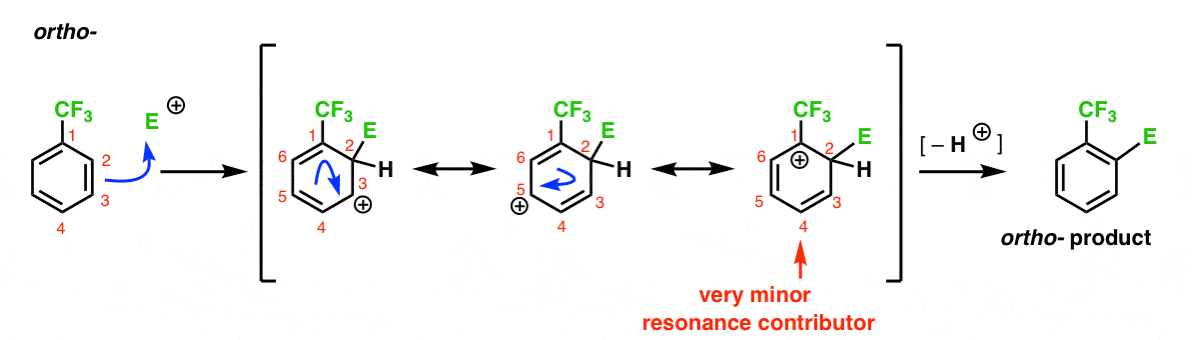
Så hvad er anderledes i dette tilfælde?
hvad der er anderledes er tilstedeværelsen af en stærk elektronudtrædende gruppe (CF3) ved C1, og dette ændrer helt boldspillet.
som vi har sagt, er carbocations destabiliseret af naboer, der trækker elektrondensitet., Derfor forventer vi, at dette vil være en meget mindre resonansindbyder, med det resultat, at den positive ladning kun er delokaliseret over C3 og C5.
Vi har bemærket, at CF3 er en meta – direktør. Det er rimeligt at tro, at der er noget om meta– der gør det særligt stabilt. Ved at analysere mellemproduktet for metaproduktet nedenfor, kan du se hvorfor?
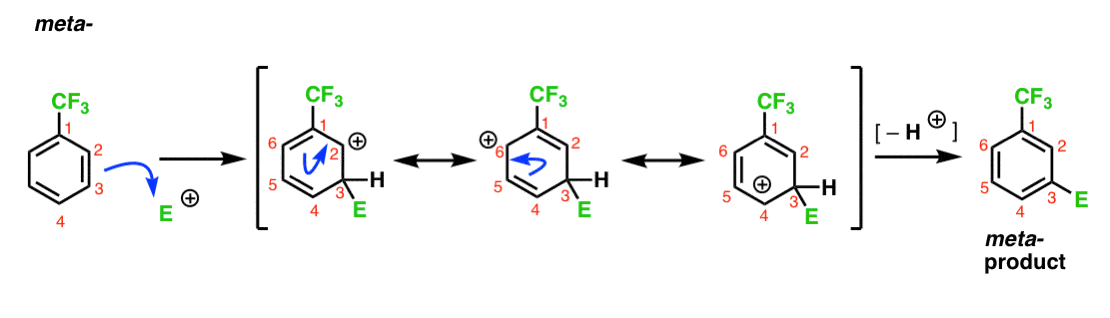
Hmmm. Der er ingen mellemprodukt, hvor et kulstof har en fuld oktet. Der er ingen særlig stabile resonansformer.
det er slags “meh”, er det ikke?
6., Hvad vi kalder ” meta-direktører “er mere som”ortho-, para– Avoiders”
på den anden side er der heller ikke nogen særlig ustabile resonansformer. Da den positive ladning er lokaliseret på C2, C4 og C6, undgås en situation, hvor den positive ladning støder direkte op til den elektronudtrædende CF3-gruppe. Og den positive ladning er således delokaliseret pænt i hele ringen, i modsætning til i ortho – situationen ovenfor.
så det er et “mindre dårligt” mellemprodukt end ortho-.,
endelig har para – mellemproduktet det samme problem som ortho- ; et mellemprodukt med en positiv ladning på C1, der støder op til CF3.
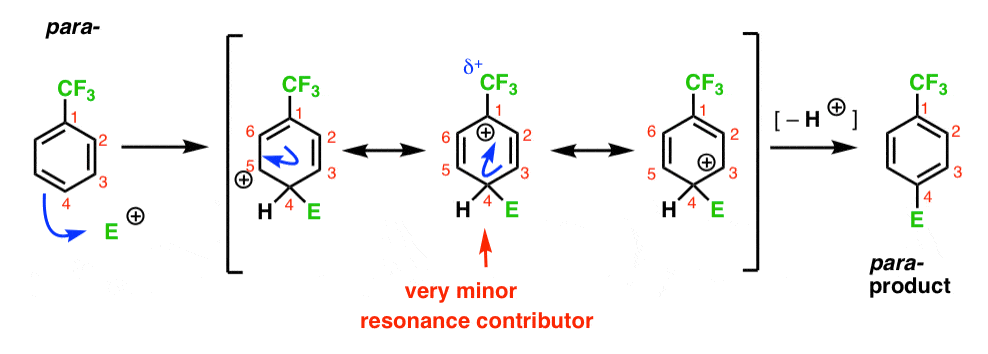
dette resulterer i kun to vigtige resonansformer, hvilket fører til et mindre delokaliseret (og derfor mindre stabilt) carbocation-mellemprodukt.
bundlinie: meta carbocation– mellemproduktet er mere stabilt end enten ortho – eller para-mellemprodukterne.
men det er ikke fordi substituenten selv har nogen stabiliserende virkning på meta– mellemproduktet. .,
Jeg vil hævde, at det er mere nyttigt at tænke på meta – som mindre ustabil end ortho – og para– .
På denne måde, er det ikke så meget, at CF3 er en meta – direktør, så meget, at det er en “ortho– , para– have. “
7. Reaktionsenergidiagrammet for en meta – instruktør
Her er en skitse af reaktionsenergidiagrammet:
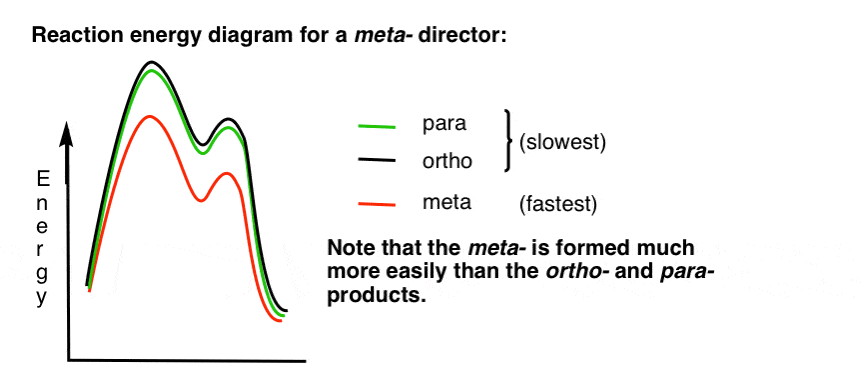
okay.
Tilbage til vores oprindelige spørgsmål. Så hvilken carbocation er mere stabil?,
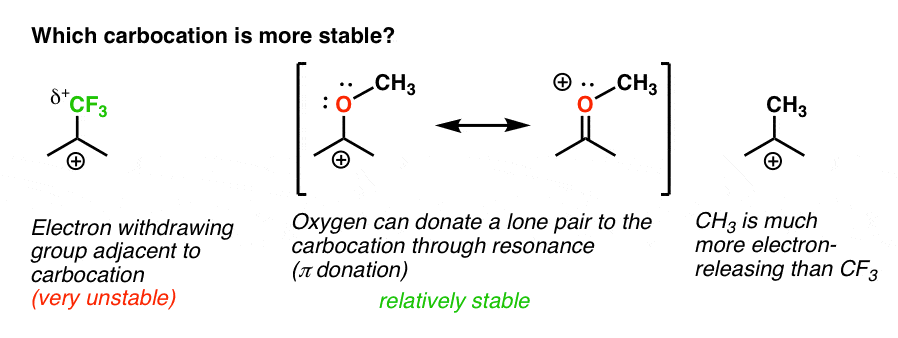
det er Klart, carbocation med en tilstødende ilt forsynet med en enlig par er langt mere stabil, end en carbocation der støder op til et elektron-fratagelse af gruppen som CF3.
og det omfatter forskellen mellem en ortho-, para – instruktør som OCH3 og en meta – instruktør som CF3.
det er værd at bemærke, at de fleste alkylgrupper (såsom CH3 ) mangler et ensomt par, men stadig er ortho -, para – direktører., Dette er i overensstemmelse med alt, hvad vi har lært om, hvordan alkyl-grupper generelt stabiliserende for vigtige forbindelser er gan – husk på, at carbocation stabilitet generelt stiger med substitution
Så om disse para– produkter…
Hvorfor er para – produkter, der er fremstillet med en større hastighed end ortho- ?
svaret er sterisk hindring.
angreb på para – positionen er mindre belastet af substituenten end angreb på ortho-positionerne er.
så hvorfor er halogener Ortho-, Para – direktører?
dette efterlader os det noget vanskelige eksempel på halogener.,
hvorfor er fluor, chlor, brom og jod ortho-, para – direktører, selvom de deaktiverer grupper?
svaret bør ikke komme som nogen overraskelse, hvis du har fulgt med, men vi vil forlade dette indtil næste indlæg, fordi denne er lang nok allerede.Næste indlæg: Hvorfor er halogener ortho -, para-direktører?
noter
Note 1. Det er mere korrekt at sige, at ortho – og para – produkter dominerer, fordi overgangstilstandene, der fører til disse produkter, er lavere i energi, snarere end energierne fra mellemprodukterne selv., Det er trods alt energien i overgangstilstandene, der bestemmer aktiveringsbarrieren og dermed reaktionshastigheden.
Note 2. Eller hyperconjugation, som de fleste lærebøger (med den bemærkelsesværdige undtagelse af Maitland Jones) generelt undgår.
Quui Yourself dig selv!,/div>
 Klik for at Flip
Klik for at Flip

 Klik for at Flip
Klik for at Flip 
 Klik for at Flip
Klik for at Flip 
 Klik for at Flip
Klik for at Flip 
(Avanceret), Referencer og Yderligere Læsning
- A., F. Holleman, Die direct Einf vonhrung von Substituenten in den Ben .olkern
Rec. Trav. Chim. Betaler-Bas 1910, 12, 455-456
DOI: 10.1002/recl.19100291205
A. F Holleman fra 1910 sagde, at ortho–para orientering er forbundet med aktivering og meta orientering med deaktivering. - —arten af den vekslende virkning i carbonkæder. Del, XXIII. Anomale orientering af halogener, og dens indflydelse på problemet af ortho–para-forhold, i aromatiske substitution
Christopher Kelk Ingold og Charles Cyril Norrey Vass
J. Chem. Soc. 1928, 417-425
DOI: 10.,1039/JR9280000417
Dette papir diskuterer lede effekter i 1,2-dihalobenzenes. - nogle observationer vedrørende sterisk hindring og virkningerne af substituenter på ortho : para-forholdet i aromatisk substitution
P. B. D. De la Mare
J. Chem. Soc. 1949, 2871-2874
TO: 10.1039/JR9490002871
I dette papir, de la Mare diskuterer forskellige faktorer, der kan udgøre en overvægt af para over ortho selektivitet, efter at dividere udbytte af ortho produkt af 2 (da der er 2 ortho positioner, men kun 1, stk position i monosubstituted benzenes)., - Volumeneffekter af alkylgrupper i aromatiske forbindelser. Del V. monosulfonering af p-cymene
R. J. Le. Le f Levre
J. Chem. Soc. 1934, 1501-1502
DOI: 10.1039/JR9340001501
I p-cymen er hovedproduktet opnået ved elektrofil sulfonering 2-produktet (ortho til methylgruppen), sandsynligvis på grund af sterik. - Effekter af Alkyl-Grupper i Elektrofile Tilføjelser og Udskiftninger
COHN, H., HUGHES, E., BAK, M. og PEELING, M. G.
Natur 1952, 169, 291
TO: 1038/169291a0
Dette papir har data at sammenligne nitrering af t-butylbenzen og toluen., T-butylbenzen er meget mere p-lede end toluen (79.5% para for t-butylbenzen vs. 40% para for toluen), hvilket sandsynligvis skyldes at sterics (ortho tilgang er blokeret af tykkere t-butyl-gruppen). - fordeling af isomerer ved Mononitration af Ethyl – og Isopropylben .en. Yderligere Beviser for en Steriske Effekt i Isomer Distribution
Herbert C. Brun og W. Hallam Bonner
Journal of the American Chemical Society 1954, 76 (2), 605-606
DOI: 10.,1021/ja01631a084
Tabel II i dette papir viser, at ortho produkt fremstillet af nitrering af monoalkylbenzenes falder, efterhånden som alkyl gruppen bliver større (fx t-butylbenzen udbytter meget lidt ortho produktet ved nitrering i forhold til toluen). - —arten af den vekslende virkning i carbonkæder. Del XIIII. et forsøg på yderligere at definere den sandsynlige mekanisme for orientering i aromatisk substitution
Christopher Kelk Ingold og Florence Ruth Sha.
J. Chem. Soc. 1927, 2918-2926
DOI: 10.,1039/JR9270002918
En tidlig papir af den indflydelsesrige Fysisk Organisk Kemiker, Prof. C. K. Ingold, om, at halogenobenzenes er induktivt elektron-fratagelse men samtidig resonans-stabiliserende. - Fluorbeneneens uregelmæssige reaktivitet ved elektrofil aromatisk Substitution og beslægtede fænomener
Joel Rosenthal og David I., Schuster
Journal of Chemical Education 2003, 80 (6), 679
TO: 1021/ed080p679
En meget interessant papir, der er egnet for nysgerrige bachelorstuderende, og diskuterer noget, som de fleste praktiserende organiske kemikere vil vide empirisk – fluorobenzene er næsten som reaktiv som benzen i EAS eller Friedel-Håndværk reaktioner, hvilket er ulogisk, når man mener, elektroniske effekter! - Organisk kemi
N. Haworth, C. K. Ingold, T. A. Henry
Ann. Rep. Prog. Chem. 1926, 23, 74-185
DOI: 10.1039/AR9262300074
et tidligt papir, der diskuterer direkte effekter i EAS. PP., 136 og 137 indeholder tal, der skildrer strømmen af elektroner. Pg. 140 diskuterer meta-retning, som forekommer af de ‘modsatte’ grunde som o/p-retning af alkylgrupper.