først er du nødt til at kende antallet af valenselektroner. Du kan gøre dette ved (1)at tegne elektronkonfigurationen pr.,
Hvis du vælger at tegne den elektron konfiguration per element, du vil have noget som dette:
#N# (atomnummer = 7) : #1s^2# #farve (rød) (2^2)# #farve (rød) (2p^3)# (5 yderste elektroner)
#O# (atomnummer = 8) : #1s^2# #farve (rød) (2^2)# #farve (rød) (2p – ^4)# (6 yderste elektroner)
Hvis du vælger at konsultere din periodiske tabel, skal du blot bemærke, at #N# tilhøre Gruppe 5A, mens #O# tilhører Gruppen 6A. Gruppen tal angiver antallet af yderste elektroner.,
nu hvor du kender antallet af valenselektroner pr.
5 + (3 6 6) = 23 elektroner
Men da hele molekylet har en -1 ladning, skal du også tilføje dette. Så det samlede antal valenselektroner er 24.
Den næste ting at gøre er at tegne. Normalt er det første element i den kemiske formel det centrale atom. I dette tilfælde er# n #atom omgivet af tre# O # atomer.,
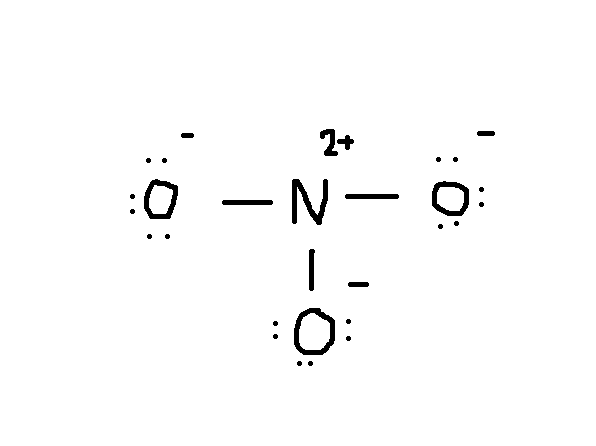
Bemærk, at det ensomme par elektroner fra #o# også er inkluderet i diagrammet. Hvis du tæller det samlede antal elektroner på ovenstående tegning, er det allerede 24 elektroner (enkeltlinie tæller som 2 elektroner). Men denne tegning har overtrådt oktetreglen, da det centrale atom kun har 6 elektroner i stedet for det korrekte nummer 8. Så hvad skal man gøre?
Tilføj en anden obligation,men hvor?,
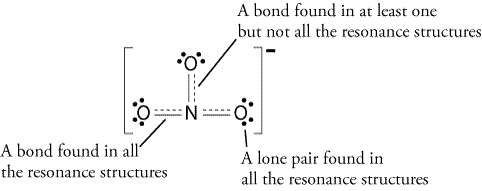
Derfor, resonans struktur vil se ud som dette: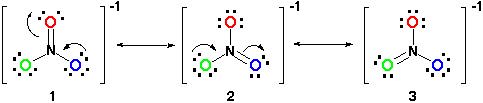
Alle resonans strukturer er korrekte, da det hele følger oktet-reglen, og alle har et samlet antal af 24 elektroner. Bare vær opmærksom på, at den eneste binding, der bevæger sig, er pi (#pi#) bindingen eller i lægmandsbetegnelsen, dobbeltbindingen og et af elektronpar fra #O# atom.