læringsmål
- Sammenlign mutationer, og frameshift-mutationer
- Beskrive forskellene mellem missense, nonsens, og lydløs mutationer
- Beskrive forskelle mellem lys og mørke reparation
- Forklare, hvordan forskellige mutagene handle
- Forklare, hvorfor Ames test kan bruges til at registrere, kræftfremkaldende stoffer
- Analysere sekvenser af DNA og identificere eksempler på typer af mutationer
En mutation er arvelige ændringer i DNA-sekvens i en organisme., Den resulterende organisme, kaldet en mutant, kan have en genkendelig ændring i fænotype sammenlignet med den vilde type, som er den fænotype, der oftest observeres i naturen. En ændring i DNA-sekvensen tildeles mRNA gennem transkription, og kan føre til en ændret aminosyresekvens i et protein ved oversættelse. Fordi proteiner udfører langt de fleste cellulære funktioner, kan en ændring i aminosyresekvens i et protein føre til en ændret fænotype for cellen og organismen.,
virkninger af mutationer på DNA-sekvens
Der er flere typer mutationer, der klassificeres efter, hvordan DNA-molekylet ændres. En type, kaldet en punktmutation, påvirker en enkelt base og forekommer oftest, når en base erstattes eller erstattes af en anden. Mutationer skyldes også tilføjelsen af en eller flere baser, kendt som en indsættelse, eller fjernelse af en eller flere baser, kendt som en deletion.
tænk over det
- hvilken type mutation opstår, når et gen har to færre nukleotider i sin sekvens?,
virkninger af mutationer på Proteinstruktur og funktion
punktmutationer kan have en lang række effekter på proteinfunktion (Figur 1). Som en konsekvens af degenerationen af den genetiske kode, en punktmutation vil ofte resultere i, at den samme aminosyre inkorporeres i det resulterende polypeptid på trods af sekvensændringen. Denne ændring ville ikke have nogen effekt på proteinets struktur og kaldes således en stille mutation. En missense-mutation resulterer i, at en anden aminosyre inkorporeres i det resulterende polypeptid., Virkningen af en missense-mutation afhænger af, hvor kemisk forskellig den nye aminosyre er fra den vildtype aminosyre. Placeringen af den ændrede aminosyre i proteinet er også vigtig. For eksempel, hvis den ændrede aminosyre er en del af en .ymets aktive sted, kan effekten af missense-mutationen være signifikant. Mange missense-mutationer resulterer i proteiner, der stadig er funktionelle, i det mindste til en vis grad. Undertiden kan virkningerne af missense-mutationer kun ses under visse miljøforhold; sådanne missense-mutationer kaldes betingede mutationer., Sjældent kan en missense-mutation være gavnlig. Under de rigtige miljøforhold kan denne type mutation give den organisme, der har den, en selektiv fordel. Endnu en anden type punktmutation, kaldet en nonsens-mutation, omdanner et kodon, der koder for en aminosyre (en sense codon), til et stopkodon (en nonsens codon). Nonsensmutationer resulterer i syntese af proteiner, der er kortere end den vilde type og typisk ikke funktionelle.
sletninger og indsættelser forårsager også forskellige effekter., Fordi kodoner er tripletter af nukleotider, kan indsættelser eller deletioner i grupper af tre nukleotider føre til indsættelse eller sletning af en eller flere aminosyrer og må ikke forårsage signifikante virkninger på det resulterende proteins funktionalitet. Imidlertid er rammeskiftmutationer forårsaget af indsættelser eller sletninger af et antal nukleotider, der ikke er et multiplum af tre, ekstremt problematiske, fordi et skift i læserammen resulterer (Figur 1). Fordi ribosomer læser mRNA i tripletkodoner, kan frameshift-mutationer ændre enhver aminosyre efter mutationspunktet., Den nye læseramme kan også indeholde et stopkodon inden udgangen af kodningssekvensen. Følgelig er proteiner fremstillet af gener, der indeholder rammeskiftmutationer, næsten altid ikke-funktionelle.
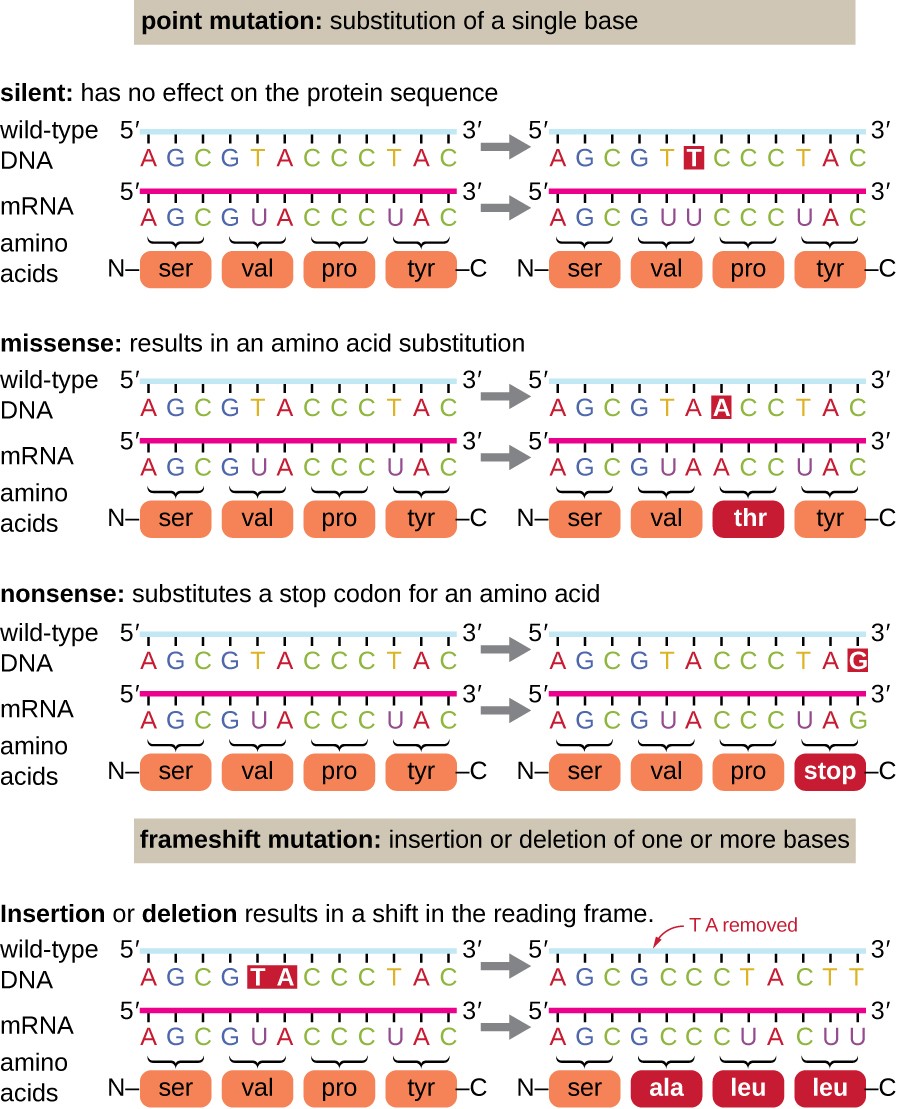
Figur 1. Klik for større billede. Mutationer kan føre til ændringer i proteinsekvensen kodet af DNA ‘ et.
tænk over det
- hvad er årsagerne til, at en nukleotidændring i et gen for et protein muligvis ikke har nogen effekt på fænotypen af dette gen?,
- er det muligt for en indsættelse af tre nukleotider sammen efter det femte nukleotid i et proteinkodende Gen at producere et protein, der er kortere end normalt? Hvordan eller hvordan ikke?
En Gavnlig Mutation
Da det første tilfælde af infektion med human immundefekt virus (HIV) blev rapporteret i 1981, næsten 40 millioner mennesker er døde af HIV, den virus, der forårsager erhvervet immundefekt syndrom (AIDS)., Virussen er målrettet hjælper T-celler, der spiller en nøglerolle i at bygge bro over det medfødte og adaptive immunrespons, inficere og dræbe celler, der normalt er involveret i kroppens reaktion på infektion. Der er ingen kur mod HIV-infektion, men mange lægemidler er udviklet til at bremse eller blokere virussens progression. Selvom individer over hele verden kan være inficeret, er den højeste forekomst blandt mennesker 15-49 år i Afrika syd for Sahara, hvor næsten en person ud af 20 er inficeret, hvilket tegner sig for mere end 70% af infektionerne over hele verden (figur 2)., Desværre er dette også en del af verden, hvor forebyggelsesstrategier og lægemidler til behandling af infektionen mangler mest.

Figur 2. HIV er meget udbredt i Afrika syd for Sahara, men dens udbredelse er ret lav i nogle andre dele af verden.
i de senere år er videnskabelig interesse blevet pikeret af opdagelsen af et par individer fra Nordeuropa, der er resistente over for HIV-infektion. I 1998 blev den amerikanske genetiker Stephen J., O ‘ Brien ved National Institutes of Health (NIH) og kolleger offentliggjorde resultaterne af deres genetiske analyse af mere end 4.000 individer. Disse indikerede, at mange individer af eurasisk afstamning (op til 14% i nogle etniske grupper) har en deletionsmutation, kaldet CCR5-delta 32, i genet, der koder for CCR5. CCR5 er en coreceptor, der findes på overfladen af T-celler, der er nødvendig for, at mange stammer af virussen kommer ind i værtscellen. Mutationen fører til produktion af en receptor, som HIV ikke effektivt kan binde og dermed blokerer viral indgang., Folk homozygot for denne mutation har i høj grad reduceret følsomhed over for HIV-infektion, og dem, der er heterozygote har en vis beskyttelse mod infektion samt.
det er ikke klart, hvorfor folk af nordeuropæisk afstamning specifikt bærer denne mutation, men dens udbredelse ser ud til at være højest i Nordeuropa og falder støt i populationer, når man bevæger sig sydpå. Forskning viser, at mutationen har været til stede siden før HIV dukkede op og kan være blevet udvalgt til i europæiske befolkninger som følge af udsættelse for pest eller kopper., Denne mutation kan beskytte enkeltpersoner mod pest (forårsaget af bakterien Yersinia pestis) og kopper (forårsaget af variolavirus), fordi denne receptor også kan være involveret i disse sygdomme. Alderen for denne mutation er et spørgsmål om debat, men estimater antyder, at den optrådte mellem 1875 år til 225 år siden og kan have været spredt fra Nordeuropa gennem Vikingeinvasioner.
dette spændende fund har ført til nye veje inden for HIV-forskning, herunder at lede efter medicin til at blokere CCR5-binding til HIV hos personer, der mangler mutationen., Selvom DNA-test for at bestemme, hvilke individer der bærer CCR5-delta 32-mutationen, er det muligt, der er dokumenterede tilfælde af individer, der er Homo .ygote til mutationen, der kontraherer HIV. Af denne grund anbefales DNA-test for mutationen ikke bredt af folkesundhedsembedsmænd for ikke at tilskynde til risikabel adfærd hos dem, der bærer mutationen. Ikke desto mindre er hæmning af bindingen af HIV til CCR5 fortsat en gyldig strategi for udvikling af lægemiddelterapier for dem, der er inficeret med HIV.,
årsager til mutationer
fejl i processen med DNA-replikation kan forårsage spontane mutationer. Fejlfrekvensen for DNA-polymerase er en forkert base pr. Eksponering for mutagener kan forårsage inducerede mutationer, som er forskellige typer kemiske stoffer eller stråling (tabel 1). Eksponering for et mutagen kan øge mutationshastigheden mere end 1000 gange. Mutagener er ofte også kræftfremkaldende stoffer, midler, der forårsager kræft. Mens næsten alle kræftfremkaldende stoffer er mutagene, er ikke alle mutagener nødvendigvis kræftfremkaldende.,
| Tabel 1., to AT base pair | Point | |||
|---|---|---|---|---|
| Intercalating agents | ||||
| Acridine orange, ethidium bromide, polycyclic aromatic hydrocarbons | Distorts double helix, creates unusual spacing between nucleotides | Introduces small deletions and insertions | Frameshift | |
| Ionizing radiation | ||||
| X-rays, γ-rays | Forms hydroxyl radicals | Causes single- and double-strand DNA breaks | Repair mechanisms may introduce mutations | |
| X-rays, γ-rays | Modifies bases (e.,g., deaminating C, U) | Konverterer GC PÅ basepar | Punkt | |
| Nonionizing stråling | ||||
| Ultraviolet | Former pyrimidin (normalt thymin) dimerer | Forårsager DNA-replikation fejl | Frameshift eller punkt | |
Kemiske Mutagener
Forskellige typer af kemiske mutagener interagere direkte med DNA-enten ved at fungere som nukleosid-analoger, eller ved at ændre nukleotid baser., Kemikalier kaldet nukleosidanaloger ligner strukturelt normale nukleotidbaser og kan inkorporeres i DNA under replikation (figur 3). Disse baseanaloger inducerer mutationer, fordi de ofte har forskellige basisparringsregler end de baser, de erstatter. Andre kemiske mutagener kan ændre normale DNA-baser, hvilket resulterer i forskellige baseparringsregler. For eksempel deaminerer salpetersyre cytosin, der omdanner det til uracil. Uracil parrer derefter med adenin i en efterfølgende replikationsrunde, hvilket resulterer i omdannelsen af et GC-basepar til et AT-basepar., Salpetersyre deaminerer også adenin til hypo .anthin, som basepar med cytosin i stedet for thymin, hvilket resulterer i omdannelse af et TA-basepar til et CG-basepar.

Figur 3. Klik for større billede. (a) 2-aminopurinnukleosid (2AP) strukturelt er et nukleosidanalog til adeninnukleosid, mens 5-bromouracil (5BU) er et nukleosidanalog til thyminnukleosid. 2AP basepar med C, konvertering af et AT-basepar til et GC-basepar efter flere replikationsrunder., 5BU par med G, konvertere en at base par til en GC base par efter flere runder af replikation. (B) salpetersyre er en anden type kemisk mutagen, der modificerer allerede eksisterende nukleosidbaser som C til at producere U, hvilke basepar med A. Denne kemiske modifikation, som vist her, resulterer i omdannelse af et CG-basepar til et TA-basepar.
kemiske mutagener kendt som interkalaterende midler virker forskelligt., Disse molekyler glider mellem de stablede nitrogenholdige baser af DNA-dobbelt Heli .en, forvrænger molekylet og skaber atypisk afstand mellem nukleotidbasepar (figur 4). Som et resultat kan DNA-polymerase under DNA-replikation enten springe over replikering af flere nukleotider (oprettelse af en deletion) eller indsætte ekstra nukleotider (oprettelse af en indsættelse). Enten resultatet kan føre til en rammeskift mutation. Forbrændingsprodukter som polycykliske aromatiske kulbrinter er særligt farlige intercalaterende midler, der kan føre til mutationsfremkaldende kræftformer., Interkalateringsmidlerne ethidiumbromid og acridinorange bruges ofte i laboratoriet til at plette DNA til visualisering og er potentielle mutagener.

Figur 4. Interkalaterende midler, såsom acridin, indfører atypisk afstand mellem basepar, hvilket resulterer i DNA-polymerase, der introducerer enten en deletion eller en indsættelse, hvilket fører til en potentiel rammeskiftmutation.
stråling
eksponering for enten ioniserende eller nonioniserende stråling kan hver inducere mutationer i DNA, skønt ved forskellige mekanismer., Stærk ioniserende stråling som røntgenstråler og gammastråler kan forårsage enkelt – og dobbeltstrenget brud i DNA-rygraden gennem dannelse af hydro .ylradikaler på strålingseksponering (figur 5). Ioniserende stråling kan også ændre baser; for eksempel deaminering af cytosin til uracil, analog med virkningen af salpetersyre. Ioniserende strålingseksponering bruges til at dræbe mikrober til sterilisering af medicinsk udstyr og fødevarer på grund af dets dramatiske uspecifikke virkning ved skadelig DNA, proteiner og andre cellulære komponenter (Se brug af fysiske metoder til kontrol af mikroorganismer).,
Nonioniserende stråling, som ultraviolet lys, er ikke energisk nok til at indlede disse typer kemiske ændringer. Imidlertid, nonioniserende stråling kan inducere dimerdannelse mellem to tilstødende pyrimidinbaser, ofte to thyminer, inden for en nukleotidstreng. Under dannelse af thymindimer bliver de to tilstødende thyminer kovalent forbundet, og hvis de ikke bliver repareret, stoppes både DNA-replikation og transkription på dette tidspunkt. DNA-polymerase kan fortsætte og replikere dimeren forkert, hvilket potentielt fører til rammeskift eller punktmutationer.,

Figur 5. (a) ioniserende stråling kan føre til dannelse af enkeltstrenget og dobbeltstrenget brud i sukker-fosfat rygraden i DNA, samt til ændring af baser (ikke vist). (B) Nonioniserende stråling som ultraviolet lys kan føre til dannelse af thymindimere, som kan stoppe replikation og transkription og indføre rammeskift eller punktmutationer.
tænk over det
- hvordan introducerer en baseanalog en mutation?,
- hvordan introducerer et interkalaterende middel en mutation?
- hvilken type mutagen forårsager thymindimere?
DNA-reparation
processen med DNA-replikation er meget nøjagtig, men fejl kan forekomme spontant eller induceres af mutagener. Ukorrigerede fejl kan føre til alvorlige konsekvenser for fænotypen. Celler har udviklet flere reparationsmekanismer for at minimere antallet af mutationer, der vedvarer.,
korrekturlæsning
de fleste af de fejl, der introduceres under DNA-replikation, korrigeres straks af de fleste DNA-polymeraser gennem en funktion kaldet korrekturlæsning. Ved korrekturlæsning læser DNA-polymerasen den nyligt tilføjede base, hvilket sikrer, at den er komplementær til den tilsvarende base i skabelonstrengen, før den næste tilføjes. Hvis der er tilføjet en forkert base, foretager en .ymet et snit for at frigive det forkerte nukleotid, og en ny base tilføjes.,
fejlmatch reparation
nogle fejl, der blev introduceret under replikation, korrigeres kort efter, at replikeringsmaskineriet er flyttet. Denne mekanisme kaldes mismatch reparation. De en .ymer, der er involveret i denne mekanisme, genkender det forkert tilsatte nukleotid, udskærer det og erstatter det med den korrekte base. Et eksempel er den methyl-rettede mismatch reparation i E. coli. DNA ‘ et er hæmimethyleret. Dette betyder, at forældrestrengen methyleres, mens den nyligt syntetiserede datterstreng ikke er det. Det tager flere minutter, før den nye streng er methyleret., Proteiner MutS, MutL og MutH binder til det hemimethylerede sted, hvor det forkerte nukleotid findes. MutH skærer den ikke-methylerede streng (den nye streng). En e .onuclease fjerner en del af strengen (inklusive det forkerte nukleotid). Det dannede hul udfyldes derefter ved hjælp af DNA pol III og ligase.
reparation af Thymindimere
fordi produktionen af thymindimere er almindelig (mange organismer kan ikke undgå ultraviolet lys), har mekanismer udviklet sig til at reparere disse læsioner., Ved nukleotid e .cision reparation (også kaldet mørk reparation) fjerner en .ymer pyrimidindimeren og erstatter den med de korrekte nukleotider (figur 6). I E. coli scannes DNA ‘ et af et en .ymkompleks. Hvis en forvrængning i double helix er fundet, der blev introduceret af pyrimidin-dimer, det enzym kompleks skærer sukker-phosphat-rygraden flere baser opstrøms og nedstrøms dimer, og det segment af DNA mellem disse to snit er derefter enzymatisk fjernet. DNA pol i erstatter de manglende nukleotider med de korrekte, og DNA-ligase forsegler spalten i sukker-fosfat-rygraden.,
den direkte reparation (også kaldet lysreparation) af thymindimerer sker gennem processen med fotoreaktivering i nærvær af synligt lys. Et en .ym kaldet fotolyase genkender forvrængningen i DNA-Heli .en forårsaget af thymindimeren og binder til dimeren. Derefter, i overværelse af synligt lys photolyase enzymet ændrer konformation og pauser fra hinanden thymin-dimer, så thymines til igen korrekt basepar med adenines på den komplementære streng., Fotoreaktivering ser ud til at være til stede i alle organismer, med undtagelse af placentale pattedyr, inklusive mennesker. Photoreactivation er især vigtigt for organismer kronisk udsættes for ultraviolet stråling, som planter, fotosyntetiske bakterier, alger og koraller, for at forhindre ophobning af mutationer, der er forårsaget af thymin-dimer-dannelse.

Figur 6. Klik for større billede. Bakterier har to mekanismer til reparation af thymindimerer., (A) ved nukleotidudskæringsreparation genkender et en .ymkompleks forvrængningen i DNA-komplekset omkring thymindimeren og skærer og fjerner den beskadigede DNA-streng. De korrekte nukleotider erstattes af DNA-pol i, og nukleotidstrengen forsegles med DNA-ligase. b) ved fotoreaktivering binder en .ymfotolyasen sig til thymindimeren og bryder i nærvær af synligt lys dimeren fra hinanden og gendanner baseparringen af thyminerne med komplementære adeniner på den modsatte DNA-streng.,
tænk over det
- under mismatch reparation, Hvordan genkender en ?ymet, hvilket er det nye, og hvilket er den gamle streng?
- hvordan introducerer et interkalaterende middel en mutation?
- hvilken type mutation reparerer fotolyase?
identifikation af bakterielle mutanter
en almindelig teknik, der anvendes til at identificere bakterielle mutanter kaldes replika plating., Denne teknik bruges til at detektere ernæringsmæssige mutanter, kaldet AU .otrophs, som har en mutation i et gen, der koder for et en .ym i biosyntesevejen for et specifikt næringsstof, såsom en aminosyre. Som et resultat, mens vildtypeceller bevarer evnen til at vokse normalt på et medium, der mangler det specifikke næringsstof, er Au .otrophs ikke i stand til at vokse på et sådant medium. 7) mutageniseres en population af bakterieceller og derefter udplades som individuelle celler på en kompleks ernæringsmæssigt komplet plade og får lov til at vokse til kolonier., Celler fra disse kolonier fjernes fra denne masterplade, ofte ved hjælp af steril fløjl. Denne fløjl, der indeholder celler, presses derefter i samme orientering på plader af forskellige medier. Mindst en plade skal også være ernæringsmæssigt komplet for at sikre, at celler overføres korrekt mellem pladerne. De andre plader mangler specifikke næringsstoffer, så forskeren kan opdage forskellige AU .otrofe mutanter, der ikke er i stand til at producere specifikke næringsstoffer. Celler fra den tilsvarende koloni på den ernæringsmæssigt komplette plade kan bruges til at genvinde mutanten til yderligere undersøgelse.,

Figur 7. Identifikation af Au .otrofiske mutanter, som histidin AU .otrophs, sker ved hjælp af replika plating. Efter mutagenese identificeres kolonier, der vokser på ernæringsmæssigt komplet medium, men ikke på medium, der mangler histidin, som histidin AU .otrophs.
tænk over det
- Hvorfor er celler belagt på en ernæringsmæssigt komplet plade ud over næringsfattige plader, når de leder efter en mutant?,
Ames– testen
Ames-testen, udviklet af Bruce Ames (1928 -) i 1970 ‘ erne, er en metode, der bruger bakterier til hurtig og billig screening af kræftfremkaldende potentiale i nye kemiske forbindelser. Testen måler mutationshastigheden forbundet med eksponering for forbindelsen, som, hvis den er forhøjet, kan indikere, at eksponering for denne forbindelse er forbundet med større kræftrisiko., Ames-testen bruger som testorganisme en stamme af Salmonella typhimurium, der er en histidin AU .otroph, der ikke er i stand til at syntetisere sit eget histidin på grund af en mutation i et essentielt gen, der kræves til dets syntese. Efter udsættelse for en potentiel mutagen, disse bakterier er belagt på en mellemlang mangler histidin, og antallet af mutanter genvinde evnen til at syntetisere histidin er registreret og sammenlignet med antallet af sådanne mutanter, der opstår i mangel af potentielle mutagen (Figur 8)., Kemikalier, der er mere mutagene, vil medføre flere mutanter med restaureret histidinsyntese i Ames-testen. Da mange kemikalier ikke er direkte mutagene, men metaboliseres til mutagene former af leveren .ymer, indgår rotteleverekstrakt ofte i starten af dette forsøg for at efterligne levermetabolisme. Efter Ames testen er udført, testes stoffer identificeret som mutagene yderligere for deres potentielle kræftfremkaldende egenskaber ved anvendelse af andre modeller, herunder dyremodeller som mus og rotter.
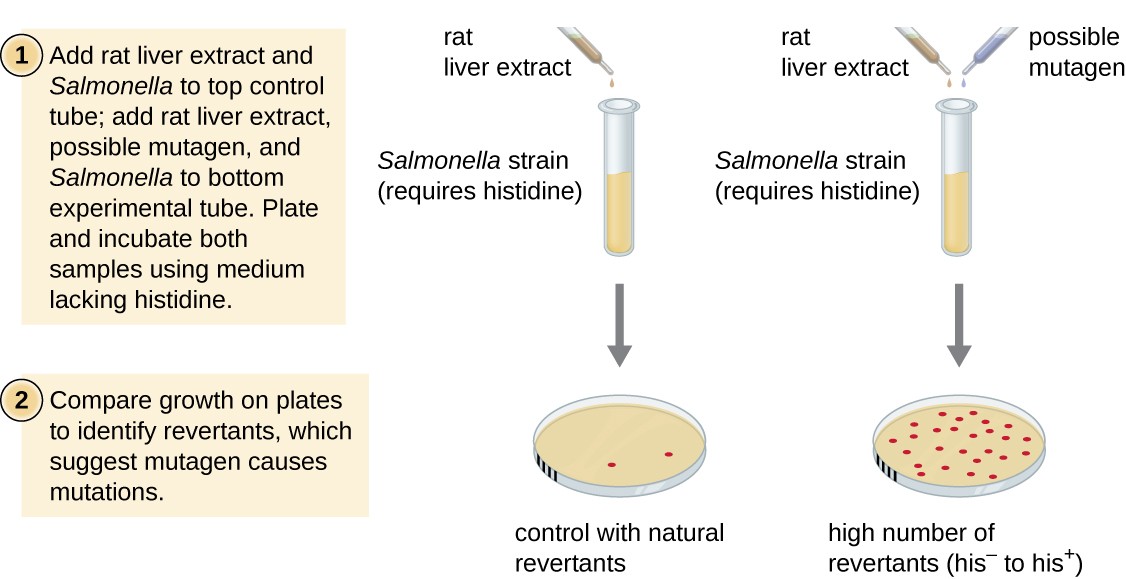
Figur 8., Ames-testen bruges til at identificere mutagene, potentielt kræftfremkaldende kemikalier. En Salmonella histidin AU .otroph anvendes som teststamme, der udsættes for et potentielt mutagen/kræftfremkaldende stof. Antallet af reversionsmutanter, der er i stand til at vokse i fravær af leveret histidin, tælles og sammenlignes med antallet af naturlige reversionsmutanter, der opstår i fravær af det potentielle mutagen.
tænk over det
- hvilken mutation bruges som indikator for mutationshastighed i Ames-testen?
- Hvorfor kan Ames-testen fungere som en test for carcinogenicitet?,
nøglebegreber og resum.
- en mutation er en arvelig ændring i DNA. En mutation kan føre til en ændring i aminosyresekvensen af et protein, hvilket muligvis påvirker dets funktion.
- en punktmutation påvirker et enkelt basepar. Et punkt mutation kan forårsage en tavs mutation, hvis de mRNA-codon koder for den samme aminosyre, en missense mutation, hvis de mRNA-codon koder for en anden aminosyre, eller en nonsense mutation, hvis mRNA ‘ et codon, bliver et stop codon.,
- Missense-mutationer kan bevare funktionen afhængigt af kemien af den nye aminosyre og dens placering i proteinet. Nonsensmutationer producerer afkortede og ofte ikke-funktionelle proteiner.
- en frameshift-mutation skyldes en indsættelse eller deletion af et antal nukleotider, der ikke er et multiplum af tre. Ændringen i læserammen ændrer hver aminosyre efter mutationspunktet og resulterer i et ikke-funktionelt protein.
- spontane mutationer forekommer gennem DNA-replikationsfejl, hvorimod inducerede mutationer forekommer ved eksponering for et mutagen.,
- mutagene stoffer er ofte kræftfremkaldende, men ikke altid. Imidlertid er næsten alle kræftfremkaldende stoffer mutagene.
- kemiske mutagener omfatter baseanaloger og kemikalier, der modificerer eksisterende baser. I begge tilfælde introduceres mutationer efter flere runder af DNA-replikation.
- ioniserende stråling, såsom røntgenstråler og Y-stråler, fører til brud på phosphodiester-rygraden i DNA og kan også kemisk ændre baser for at ændre deres baseparringsregler.,
- Nonioniserende stråling som ultraviolet lys kan introducere pyrimidin (thymin) dimerer, som under DNA-replikation og transkription kan indføre rammeskift eller punktmutationer.
- celler har mekanismer til at reparere naturligt forekommende mutationer. DNA-polymerase har korrekturlæsningsaktivitet. Mismatch reparation er en proces til at reparere forkert inkorporerede baser efter DNA-replikation er afsluttet.
- Pyrimidindimerer kan også repareres., Ved nukleotid e .cisionsreparation (mørk reparation) genkender en .ymer forvrængningen indført af pyrimidindimeren og erstatter den beskadigede streng med de korrekte baser ved hjælp af den ubeskadigede DNA-streng som en skabelon. Bakterier og andre organismer kan også anvende direkte reparation, hvor fotolyaseen .ymet i nærvær af synligt lys bryder pyrimidinerne fra hinanden.
- ved sammenligning af vækst på den komplette plade og manglende vækst på medier, der mangler specifikke næringsstoffer, kan specifikke tab af funktionsmutanter kaldet AU .otrophs identificeres.,Ames-testen er en billig metode, der bruger AU .otrofe bakterier til at måle mutagenicitet af en kemisk forbindelse. Mutagenicitet er en indikator for kræftfremkaldende potentiale.
Multiple Choice
hvilket af følgende er en ændring i sekvensen, der fører til dannelse af et stopkodon?
- missense mutation
- nonsense mutation
- silent mutation
- sletning mutation
dannelsen af pyrimidindimerer skyldes hvilket af følgende?
- spontan fejl ved DNA-polymerase
- eksponering for gamma-stråling
- eksponering for ultraviolet stråling
- eksponering til intercalating agenter
hvilket af følgende er et eksempel på en rammeskiftmutation?
- en sletning af et codon
- missense mutation
- silent mutation
- sletning af en nukleotid
hvilket af følgende er typen af DNA-reparation, hvor thymindimerer direkte nedbrydes af en ?ymet fotolyase?,
- direkte reparere
- nukleotid excision repair
- mismatch repair
- korrekturlæsning
hvilket af følgende vedrørende Ames-testen er sandt?
- det bruges til at identificere nydannede AU .otrofiske mutanter.
- det bruges til at identificere mutanter med restaureret biosyntetisk aktivitet.
- det bruges til at identificere spontane mutanter.,
- det bruges til at identificere mutanter, der mangler fotoreaktiveringsaktivitet.
udfyld det tomme
et kemisk mutagen, der strukturelt ligner et nukleotid, men har forskellige baseparringsregler, kaldes en ________.,
en .ymet, der bruges til lysreparation til at opdele thymindimerer, kaldes ________.
fænotypen af en organisme, der oftest observeres i naturen, kaldes ________.,
True / False
kræftfremkaldende stoffer er typisk mutagene.
Tænke på Det
Hvorfor er det mere sandsynligt, at indrykninger eller udeladelser vil være mere ødelæggende for en celle end punktmutationer?,
hvorfor tror du, at Ames-testen er at foretrække frem for brugen af dyremodeller til at screene kemiske forbindelser til mutagenicitet?
kritisk tænkning
nedenfor er flere DNA-sekvenser, der er muterede sammenlignet med vildtypesekvensen: 3′-T A C T G A C T G A C G A T C-5′. Forestil dig, at hver enkelt er et afsnit af et DNA-molekyle, der er adskilt som forberedelse til transskription, så i kun ser skabelonstrengen., Konstruere den komplementære DNA-sekvenser (med angivelse af 5′ – og 3′ – ender) for hver muteret DNA-sekvens, så transskribere (med angivelse af 5′ – og 3′ – ender) den skabelon, tråde, og oversætte den mRNA-molekyler ved hjælp af den genetiske kode, registrering resulterer aminosyre sekvens (med angivelse af N og C termini). Hvilken type mutation er hver?,>
Komplementære DNA-sekvens:
mRNA-sekvens transskriberet fra skabelon:
aminosyre sekvens af peptid:
Type af mutation:
Komplementære DNA-sekvens:
mRNA-sekvens transskriberet fra skabelon:
aminosyre sekvens af peptid:
Type af mutation: