Hvordan elementer, der interagerer med hinanden, afhænger af, hvordan deres elektroner er arrangeret, og hvordan mange muligheder for, at elektroner eksisterer på den region i den yderste periferi, hvor elektroner er til stede i et atom. Elektroner findes på energiniveauer, der danner skaller omkring kernen. Den nærmeste skal kan rumme op til to elektroner. Den nærmeste skal til kernen fyldes altid først, før en anden skal kan fyldes. Hydrogen har en elektron; derfor har den kun et sted besat inden for den laveste skal., Helium har to elektroner; derfor kan det helt fylde den laveste skal med sine to elektroner. Hvis du ser på det periodiske bord, vil du se, at brint og helium er de eneste to elementer i første række. Dette skyldes, at de kun har elektroner i deres første skal. Brint og helium er de eneste to elementer, der har den laveste skal og ingen andre skaller.
det andet og tredje energiniveau kan rumme op til otte elektroner. De otte elektroner er arrangeret i fire par, og en position i hvert par er fyldt med en elektron, før nogen par er afsluttet.,når du ser på det periodiske bord igen (Figur 1), vil du bemærke, at der er syv rækker. Disse rækker svarer til antallet af skaller, som elementerne i den række har. Elementerne inden for en bestemt række har et stigende antal elektroner, da kolonnerne fortsætter fra venstre mod højre. Selvom hvert element har det samme antal skaller, er ikke alle skaller helt fyldt med elektroner. Hvis man ser på den anden række af de periodiske tabel, du vil finde lithium (Li), beryllium (Be), bor (B), kulstof (C), nitrogen (N), ilt (O), fluor (F), og neon (Ne)., Disse har alle elektroner, der kun optager den første og anden skal. Lithium har kun én elektron i sin yderste skal, beryllium har to elektroner, bor er der tre, og så videre, indtil hele skallen er fyldt med otte elektroner, som det er tilfældet med neon.
ikke alle elementer har nok elektroner til at fylde deres yderste skaller, men et atom er mest stabilt, når alle elektronpositionerne i den yderste skal er fyldt., På grund af disse ledige stillinger i de yderste skaller ser vi dannelsen af kemiske bindinger eller interaktioner mellem to eller flere af de samme eller forskellige elementer, der resulterer i dannelse af molekyler. For at opnå større stabilitet, atomer vil have en tendens til helt at fylde deres ydre skaller og vil obligation med andre elementer for at opnå dette mål ved at dele elektroner, accept af elektroner fra et andet atom, eller donere elektroner til et andet atom., Fordi de yderste skaller af elementerne med lave atomnumre (op til calcium, med atomnummer 20) kan indeholde otte elektroner, kaldes dette oktetreglen. Et element kan donere, acceptere eller dele elektroner med andre elementer for at udfylde dets ydre skal og tilfredsstille octet-reglen.
Når et atom ikke indeholder lige mange protoner og elektroner, kaldes det en ion. Da antallet af elektroner ikke svarer til antallet af protoner, har hver ion en netladning. Positive ioner dannes ved at miste elektroner og kaldes kationer., Negative ioner dannes ved at få elektroner og kaldes anioner.for eksempel har natrium kun en elektron i sin yderste skal. Det tager mindre energi for natrium at donere den ene elektron end det gør for at acceptere syv flere elektroner for at fylde den ydre skal. Hvis natrium mister en elektron, har den nu 11 protoner og kun 10 elektroner, hvilket efterlader det med en samlet ladning på +1. Det kaldes nu en natriumion.
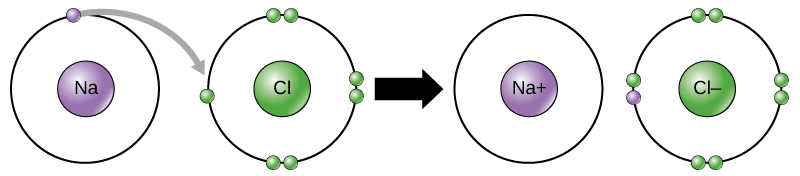
kloratomet har syv elektroner i sin ydre skal. Igen er det mere energieffektivt for klor at få en elektron end at tabe syv., Derfor har det en tendens til at få en elektron til at skabe en ion med 17 protoner og 18 elektroner, hvilket giver den en netto negativ (-1) ladning. Det kaldes nu en chloridion. Denne bevægelse af elektroner fra et element til et andet kaldes elektronoverførsel. Som Figur 1 illustrerer, har et natriumatom (Na) kun en elektron i sin yderste skal, mens et kloratom (Cl) har syv elektroner i sin yderste skal. Et natriumatom vil donere sin ene elektron for at tømme sin skal, og et kloratom vil acceptere, at elektronen fylder sin skal og bliver chlorid., Begge ioner opfylder nu octet-reglen og har komplette yderste skaller. Fordi antallet af elektroner ikke længere er lig med antallet af protoner, er hver nu en ion og har en +1 (natrium) eller -1 (chlorid) ladning.

Ioniske Obligationer
Der findes fire typer af obligationer eller interaktioner: ionisk, kovalente, hydrogen-bindinger, og van der Waals-interaktioner. Ioniske og kovalente bindinger er stærke interaktioner, der kræver en større energiindgang for at bryde fra hinanden. Når et element donerer en elektron fra sin ydre skal, som i natriumatomeksemplet ovenfor, dannes en positiv ion (figur 2). Elementet, der accepterer elektronen, er nu negativt ladet., Fordi positive og negative ladninger tiltrækker, forbliver disse ioner sammen og danner en ionbinding eller en binding mellem ioner. Elementerne binder sammen med elektronen fra et element, der overvejende forbliver med det andet element. Når Na + og Cl-ioner kombineres for at producere NaCl, forbliver en elektron fra et natriumatom med de andre syv fra kloratomet, og natrium-og chloridionerne tiltrækker hinanden i et gitter af ioner med en netto nulladning.,
Kovalente bindinger
en Anden type af stærk kemisk binding mellem to eller flere atomer er en kovalent binding. Disse bindinger dannes, når en elektron deles mellem to elementer og er den stærkeste og mest almindelige form for kemisk binding i levende organismer. Kovalente bindinger dannes mellem de elementer, der udgør de biologiske molekyler i vores celler., I modsætning til ionbindinger dissocierer kovalente bindinger ikke i vand.
interessant nok måler kemikere og biologer bindingsstyrke på forskellige måder. Kemikere måler den absolutte styrke af en binding (den teoretiske styrke), mens biologer er mere interesserede i, hvordan bindingen opfører sig i et biologisk system, som normalt er vandigt (vandbaseret). I vand adskilles ionbindinger meget lettere end kovalente bindinger, så biologer vil sige, at de er svagere end kovalente bindinger. Hvis du ser i en Kemi lærebog, vil du se noget andet., Dette er et godt eksempel på, hvordan de samme oplysninger kan føre til forskellige svar afhængigt af det perspektiv, du ser det fra.
hydrogen-og O oxygenygenatomerne, der kombineres for at danne vandmolekyler, er bundet sammen af kovalente bindinger. Elektronen fra hydrogenatomet deler sin tid mellem den ydre skal af hydrogenatomet og den ufuldstændige ydre skal af O .ygenatomet. For fuldstændigt at fylde den ydre skal af et O oxygenygenatom er der brug for to elektroner fra to hydrogenatomer, dermed underskriften “2” i H2O., Elektronerne deles mellem atomerne og deler deres tid mellem dem for at “fylde” den ydre skal af hver. Denne deling er en lavere energitilstand for alle de involverede atomer, end hvis de eksisterede uden deres ydre skaller fyldt.
Der er to typer kovalente bindinger: polære og ikke-polære. Ikke-polære kovalente bindinger dannes mellem to atomer af det samme element eller mellem forskellige elementer, der deler elektronerne lige. For eksempel kan et O oxygenygenatom binde med et andet o .ygenatom for at fylde deres ydre skaller., Denne forening er ikke-polær, fordi elektronerne vil blive ligeligt fordelt mellem hvert o .ygenatom. To kovalente bindinger dannes mellem de to O oxygenygenatomer, fordi ilt kræver to delte elektroner for at fylde dens yderste skal. Nitrogenatomer vil danne tre kovalente bindinger (også kaldet tredobbelt kovalent) mellem to nitrogenatomer, fordi hvert nitrogenatom har brug for tre elektroner for at fylde sin yderste skal. Et andet eksempel på en ikke-polær kovalent binding findes i methan (CH4) molekylet. Carbonatomet har fire elektroner i sin yderste skal og har brug for fire mere for at fylde det., Det får disse fire fra fire hydrogenatomer, hvert atom giver en. Disse elementer deler alle elektronerne lige og skaber fire ikke-polære kovalente bindinger (figur 3).
i en polær kovalent binding bruger elektronerne, der deles af atomerne, mere tid tættere på en kerne end den anden kerne. På grund af den ulige fordeling af elektroner mellem de forskellige kerner udvikles en lidt positiv (+ + ) eller lidt negativ (– – ) ladning. De kovalente bindinger mellem hydrogen og O oxygenygenatomer i vand er polære kovalente bindinger., De delte elektroner bruger mere tid nær iltkernen, hvilket giver den en lille negativ ladning, end de bruger nær hydrogenkernerne, hvilket giver disse molekyler en lille positiv ladning.

hydrogenbindinger
Ioniske og kovalente bindinger er stærke bindinger, der kræver betydelig energi for at bryde. Imidlertid er ikke alle bindinger mellem elementer ioniske eller kovalente bindinger. Svagere obligationer kan også danne. Disse er attraktioner, der opstår mellem positive og negative ladninger, der ikke kræver meget energi til at bryde. To svage bindinger, der forekommer hyppigt, er hydrogenbindinger og Van der .aals-interaktioner. Disse bindinger giver anledning til de unikke egenskaber ved vand og de unikke strukturer af DNA og proteiner.,
når polære kovalente bindinger, der indeholder en hydrogenatomform, har hydrogenatomet i denne binding en lidt positiv ladning. Dette skyldes, at den delte elektron trækkes stærkere mod det andet element og væk fra brintkernen. Fordi hydrogenatomet er lidt positivt (+ + ), vil det blive tiltrukket af nærliggende negative delladninger (– -). Når dette sker, opstår der en svag interaktion mellem hydrogen+– ladningen af hydrogenatomet i et molekyle og charge-ladningen af det andet molekyle. Denne interaktion kaldes en hydrogenbinding., Denne type binding er almindelig; for eksempel er vandets flydende natur forårsaget af hydrogenbindingerne mellem vandmolekyler (figur 4). Hydrogenbindinger giver vand de unikke egenskaber, der opretholder livet. Hvis det ikke var til hydrogenbinding, ville vand være en gas snarere end en væske ved stuetemperatur.

kan danne hydrogenbindinger mellem forskellige molekyler, og de behøver ikke altid at indeholde et vand-molekyle. Hydrogenatomer i polære bindinger inden for ethvert molekyle kan danne bindinger med andre tilstødende molekyler. For eksempel holder hydrogenbindinger to lange DNA-strenge sammen for at give DNA-molekylet dets karakteristiske dobbeltstrengede struktur. Hydrogenbindinger er også ansvarlige for nogle af den tredimensionelle struktur af proteiner.,
van der deraals interaktioner
ligesom hydrogenbindinger er van der .aals interaktioner svage attraktioner eller interaktioner mellem molekyler. De forekommer mellem polære, kovalent bundne atomer i forskellige molekyler. Nogle af disse svage attraktioner er forårsaget af midlertidige delvise ladninger dannet, når elektroner bevæger sig rundt om en kerne. Disse svage interaktioner mellem molekyler er vigtige i biologiske systemer.