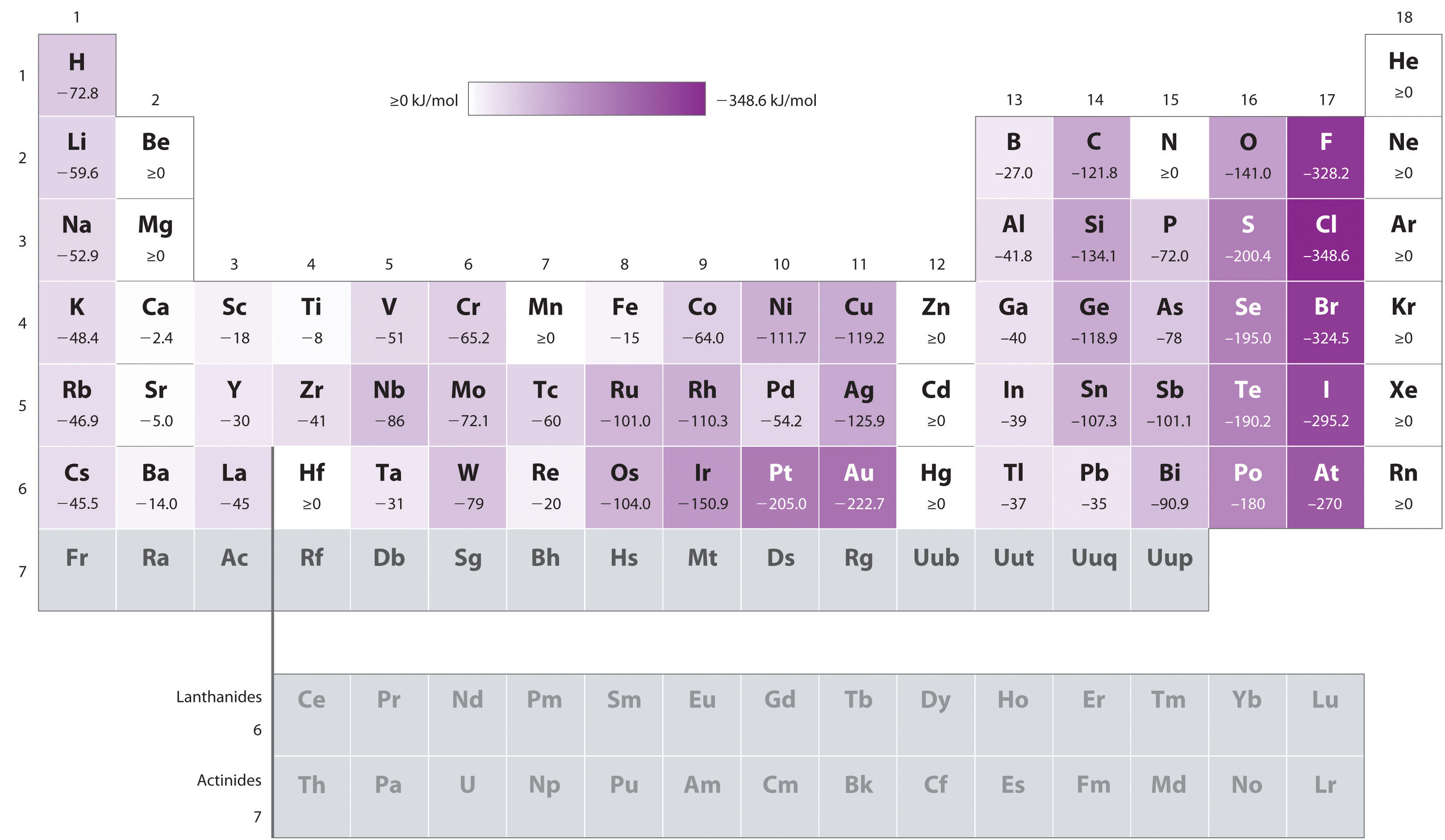
Los átomos con los radios más grandes, que tienen las energías de ionización más bajas (afinidad por sus propios electrones de Valencia), también tienen la afinidad más baja por un electrón agregado. Hay, sin embargo, dos excepciones principales a esta tendencia:
- Las afinidades electrónicas de los elementos B A F en la segunda fila de la Tabla periódica son menos negativas que las de los elementos inmediatamente debajo de ellos en la tercera fila., Aparentemente, el aumento de las repulsiones electrón-electrón experimentadas por los electrones confinados a los orbitales 2P relativamente pequeños superan el aumento de la atracción electrón–núcleo a distancias nucleares cortas. El flúor, por lo tanto, tiene una afinidad más baja para un electrón añadido que el cloro. En consecuencia, los elementos de la tercera fila (n = 3) tienen las afinidades electrónicas más negativas. Más abajo en una columna, la atracción por un electrón agregado disminuye porque el electrón está entrando en un orbital más distante del núcleo., Las repulsiones electrón-electrón también disminuyen porque los electrones de Valencia ocupan un mayor volumen de espacio. Estos efectos tienden a anularse entre sí, por lo que los cambios en la afinidad electrónica dentro de una familia son mucho más pequeños que los cambios en la energía de ionización.
- Las afinidades electrónicas de los metales alcalinotérreos se vuelven más negativas de Be A Ba. La separación de energía entre las subcapas NS2 llenas y las subcapas NP vacías disminuye con el aumento de n, de modo que la formación de un anión a partir de los elementos más pesados se vuelve energéticamente más favorable.,
Las ecuaciones para afinidades electrónicas segundas y superiores son análogas a las de energías de ionización segundas y superiores:
\
\
Como hemos visto, la primera afinidad electrónica puede ser mayor o igual a cero o negativa, dependiendo de la configuración electrónica del átomo. En contraste, la segunda afinidad electrónica es siempre positiva porque el aumento de las repulsiones electrón-electrón en un dianión son mucho mayores que la atracción del núcleo por los electrones adicionales., Por ejemplo, la primera afinidad electrónica del oxígeno es -141 kJ/mol, pero la segunda afinidad electrónica es +744 kJ/mol:
\
\
por lo tanto, la formación de un óxido gaseoso (\(o^{2−}\)) ion es energéticamente bastante desfavorable (estimado mediante la adición de ambos pasos):
\
mientras que las afinidades del primer electrón pueden ser negativas, positivas o cero, las afinidades del segundo electrón son siempre positivas.,
Si se requiere energía para formar tanto cationes cargados positivamente como polianiones monatómicos, ¿por qué se forman compuestos iónicos como \(MgO\), \(Na_2S\) y \(Na_3P\)? El factor clave en la formación de compuestos iónicos estables son las interacciones electrostáticas favorables entre los cationes y los aniones en la sal cristalina.
Ejemplo \(\PageIndex{1}\): afinidades electrónicas contrastantes de Sb, Se y Te
basadas en sus posiciones en la Tabla periódica, ¿cuál de Sb, Se o Te predeciría que tiene la afinidad electrónica más negativa?,
Dado: tres elementos
Pidió: elemento más negativo de la afinidad electrónica
Estrategia:
- Localizar los elementos en la tabla periódica. Utilice las tendencias en afinidades electrónicas que van abajo de una columna para los elementos en el mismo grupo. Del mismo modo, utilice las tendencias en afinidades electrónicas de izquierda a derecha para los elementos en la misma fila.
- coloque los elementos en orden, listando primero el elemento con la afinidad electrónica más negativa.,
solución:
a sabemos que las afinidades electrónicas se vuelven menos negativas al bajar una columna (excepto por las afinidades electrónicas anómalas bajas de los elementos de la segunda fila), por lo que podemos predecir que la afinidad electrónica de Se es más negativa que la de Te. También sabemos que las afinidades electrónicas se vuelven más negativas de izquierda a derecha a través de una fila, y que los elementos del grupo 15 tienden a tener valores que son menos negativos de lo esperado., Debido a que Sb se encuentra a la izquierda de Te y pertenece al grupo 15, predecimos que la afinidad electrónica de Te es más negativa que la de Sb. El orden general es Se < Te < Sb, por lo que Se tiene la afinidad electrónica más negativa entre los tres elementos.