primero es que necesita saber el número de electrones de Valencia. Puede hacer esto (1) dibujando la configuración electrónica por elemento o (2) consultando su tabla periódica.,
si elige dibujar la configuración electrónica por elemento, tendrá algo como esto:
#N# (número atómico = 7) : #1s^2# #color (Rojo) (2s^2)# #color (Rojo) (2P^3)# (5 electrones más externos)
#O# (número atómico = 8) : #1s^2# #color (Rojo) (2S^2)# #color (Rojo) (2p^4)# (6 electrones más externos)
si elige consultar su tabla periódica, solo observe que #n# pertenece al grupo 5a mientras que #o# pertenece al grupo 6a. el número de grupo denota el número de electrones más externos.,
ahora que conoce el número de electrones de Valencia por elemento, necesita calcular el total de electrones de Valencia para el ion #no_3^»-1″#.
5 + (3 x 6) = 23 electrones
pero como toda la molécula tiene una carga de -1, también debe agregar esto. Así que el número total de electrones de Valencia es 24.
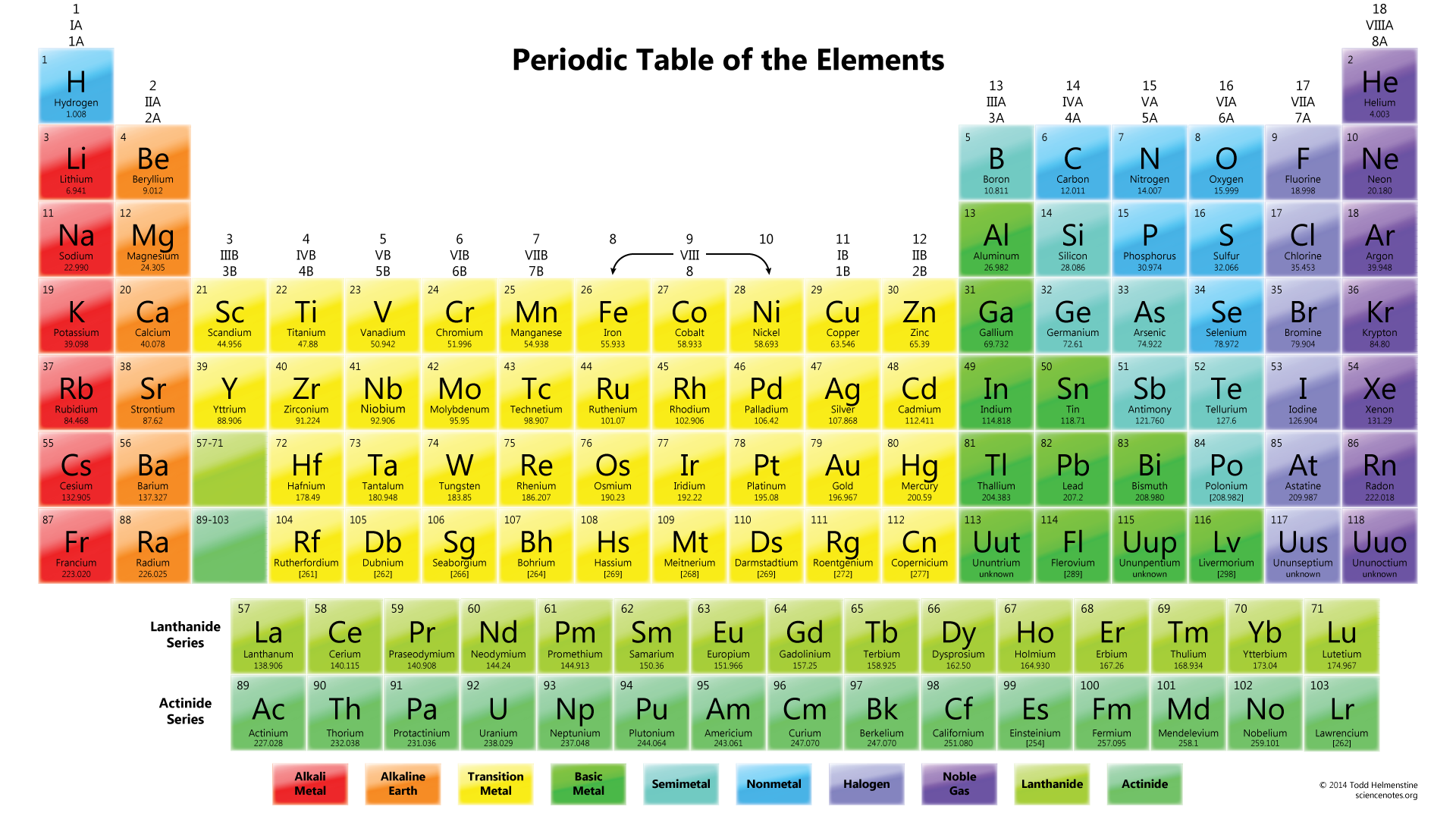
lo siguiente que hay que hacer es dibujar. Normalmente, el primer elemento de la fórmula química es el átomo central. En este caso, el átomo #N# está rodeado por tres átomos #O#.,
observe que el par solitario de electrones de #O# también se incluye en el diagrama. Si cuenta el número total de electrones en el dibujo anterior, ya son 24 electrones (una sola línea cuenta como 2 electrones). Pero este dibujo ha violado la regla del octeto ya que el átomo central solo tiene 6 electrones en lugar del número correcto 8. Entonces, ¿qué hacer?
añadir otro vínculo, pero ¿dónde?,
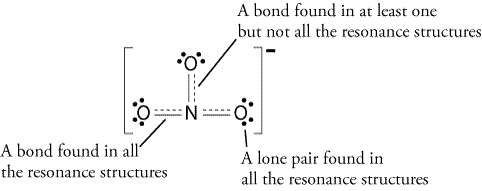
por lo tanto, la estructura de resonancia se vería así:
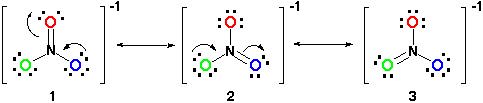
todas las estructuras de resonancia son correctas ya que todas siguen la regla del octeto y todas tienen un número total de 24 electrones. Solo tome nota de que el único enlace en movimiento es el enlace pi (#pi#) o en términos sencillos, el enlace doble y uno de los pares de electrones del átomo# o#.