cómo interactúan los elementos entre sí depende de cómo están dispuestos sus electrones y cuántas aberturas para electrones existen en la región más externa donde los electrones están presentes en un átomo. Los electrones existen en niveles de energía que forman capas alrededor del núcleo. La capa más cercana puede contener hasta dos electrones. La cáscara más cercana al núcleo siempre se llena primero, antes de que se pueda llenar cualquier otra cáscara. El hidrógeno tiene un electrón; por lo tanto, solo tiene un punto ocupado dentro de la capa más baja., El helio tiene dos electrones; por lo tanto, puede llenar completamente la capa más baja con sus dos electrones. Si nos fijamos en la Tabla periódica, verá que el hidrógeno y el helio son los dos únicos elementos en la primera fila. Esto se debe a que solo tienen electrones en su primera capa. El hidrógeno y el helio son los únicos dos elementos que tienen la capa más baja y ninguna otra capa.
el segundo y tercer nivel de energía pueden contener hasta ocho electrones. Los ocho electrones están dispuestos en cuatro pares y una posición en cada par se llena con un electrón antes de que se completen los pares.,
mirando de nuevo la Tabla periódica (Figura 1), notará que hay siete filas. Estas filas corresponden al número de conchas que tienen los elementos dentro de esa fila. Los elementos dentro de una fila particular tienen un número creciente de electrones a medida que las columnas avanzan de izquierda a derecha. Aunque cada elemento tiene el mismo número de conchas, no todas las conchas están completamente llenas de electrones. Si observa la segunda fila de la Tabla periódica, encontrará litio (Li), berilio (Be), boro (B), carbono (C), nitrógeno (N), oxígeno (O), flúor (F) y neón (Ne)., Todos estos tienen electrones que ocupan solo la primera y segunda envoltura. El litio tiene solo un electrón en su capa exterior, el berilio tiene dos electrones, el boro tiene tres, y así sucesivamente, hasta que toda la capa está llena de ocho electrones, como es el caso del neón.
no todos los elementos tienen suficientes electrones para llenar sus capas más externas, pero un átomo es más estable cuando todas las posiciones de electrones en la capa más externa están llenas., Debido a estas vacantes en las capas más externas, vemos la formación de enlaces químicos, o interacciones entre dos o más de los mismos o diferentes elementos que resultan en la formación de moléculas. Para lograr una mayor estabilidad, los átomos tenderán a llenar completamente sus capas externas y se unirán con otros elementos para lograr este objetivo compartiendo electrones, aceptando electrones de otro átomo o donando electrones a otro átomo., Debido a que las capas más externas de los elementos con números atómicos bajos (hasta el calcio, con número atómico 20) pueden contener ocho electrones, esto se conoce como la regla del octeto. Un elemento puede donar, aceptar o compartir electrones con otros elementos para llenar su capa exterior y satisfacer la regla del octeto.
Cuando un átomo no contiene el mismo número de protones y electrones, se llama ion. Debido a que el número de electrones no es igual al número de protones, cada ion tiene una carga neta. Los iones positivos se forman por la pérdida de electrones y se llaman cationes., Los iones negativos se forman al ganar electrones y se llaman aniones.
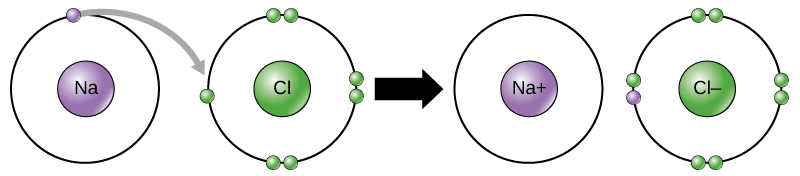
por ejemplo, el sodio solo tiene un electrón en su capa exterior. Se necesita menos energía para que el sodio done ese electrón que para aceptar siete electrones más para llenar la capa exterior. Si el sodio pierde un electrón, ahora tiene 11 protones y solo 10 electrones, dejándolo con una carga total de + 1. Ahora se llama ion de sodio.
El átomo de cloro tiene siete electrones en su capa exterior. Una vez más, es más eficiente energéticamente para el cloro ganar un electrón que perder siete., Por lo tanto, tiende a ganar un electrón para crear un ion con 17 protones y 18 electrones, dándole una carga negativa neta (-1). Ahora se llama ion cloruro. Este movimiento de electrones de un elemento a otro se conoce como transferencia de electrones. Como ilustra la Figura 1, un átomo de sodio (Na) solo tiene un electrón en su capa exterior, mientras que un átomo de cloro (Cl) tiene siete electrones en su capa exterior. Un átomo de sodio donará su electrón para vaciar su caparazón, y un átomo de cloro aceptará ese electrón para llenar su caparazón, convirtiéndose en cloruro., Ambos iones ahora satisfacen la regla del octeto y tienen capas externas completas. Debido a que el número de electrones ya no es igual al número de protones, cada uno es ahora un ion y tiene una carga de +1 (sodio) o -1 (cloruro).

enlaces Iónicos
Hay cuatro tipos de vínculos o interacciones medicamentosas: iónicos, covalentes, enlaces de hidrógeno, van der Waals interacciones. Los enlaces iónicos y covalentes son interacciones fuertes que requieren un mayor aporte de energía para romperse. Cuando un elemento dona un electrón de su capa exterior, como en el ejemplo del átomo de sodio anterior, se forma un ion positivo (Figura 2). El elemento que acepta el electrón ahora está cargado negativamente., Debido a que las cargas positivas y negativas se atraen, estos iones permanecen juntos y forman un enlace iónico, o un enlace entre iones. Los elementos se unen con el electrón de un elemento permaneciendo predominantemente con el otro elemento. Cuando los iones Na+ y Cl– se combinan para producir NaCl, un electrón de un átomo de sodio permanece con los otros siete del átomo de cloro, y los iones de sodio y cloruro se atraen entre sí en una red de iones con una carga neta cero.,
enlaces covalentes
otro tipo de enlace químico fuerte entre dos o más átomos es un enlace covalente. Estos enlaces se forman cuando un electrón se comparte entre dos elementos y son la forma más fuerte y común de enlace químico en los organismos vivos. Los enlaces covalentes se forman entre los elementos que componen las moléculas biológicas en nuestras células., A diferencia de los enlaces iónicos, los enlaces covalentes no se disocian en el agua.
curiosamente, los químicos y biólogos miden la fuerza del enlace de diferentes maneras. Los químicos miden la fuerza absoluta de un enlace (la fuerza teórica), mientras que los biólogos están más interesados en cómo se comporta el enlace en un sistema biológico, que generalmente es acuoso (a base de agua). En el agua, los enlaces iónicos se separan mucho más fácilmente que los enlaces covalentes, por lo que los biólogos dirían que son más débiles que los enlaces covalentes. Si miras en un libro de química, verás algo diferente., Este es un gran ejemplo de cómo la misma información puede llevar a diferentes respuestas dependiendo de la perspectiva desde la que la estés viendo.
los átomos de hidrógeno y oxígeno que se combinan para formar moléculas de agua están unidos entre sí por enlaces covalentes. El electrón del átomo de hidrógeno divide su tiempo entre la capa exterior del átomo de hidrógeno, y la incompleta cáscara externa del átomo de oxígeno. Para llenar completamente la capa exterior de un átomo de oxígeno, se necesitan dos electrones de dos átomos de hidrógeno, de ahí el subíndice «2» en H2O., Los electrones se comparten entre los átomos, dividiendo su tiempo entre ellos para «llenar» la capa exterior de cada uno. Este Compartir es un estado de energía más bajo para todos los átomos involucrados que si existieran sin sus caparazones exteriores llenos.
Hay dos tipos de enlaces covalentes: polares y no polares. Los enlaces covalentes no polares se forman entre dos átomos del mismo elemento o entre diferentes elementos que comparten los electrones por igual. Por ejemplo, un átomo de oxígeno puede unirse con otro átomo de oxígeno para llenar sus capas externas., Esta asociación es no polar porque los electrones se distribuirán equitativamente entre cada átomo de oxígeno. Dos enlaces covalentes se forman entre los dos átomos de oxígeno porque el oxígeno requiere dos electrones compartidos para llenar su capa más externa. Los átomos de nitrógeno formarán tres enlaces covalentes (también llamados triple covalente) entre dos átomos de nitrógeno porque cada átomo de nitrógeno necesita tres electrones para llenar su capa más externa. Otro ejemplo de un enlace covalente no polar se encuentra en la molécula de metano (CH4). El átomo de carbono tiene cuatro electrones en su capa exterior y necesita cuatro más para llenarlo., Obtiene estos cuatro de cuatro átomos de hidrógeno, cada átomo proporciona uno. Todos estos elementos comparten los electrones por igual, creando cuatro enlaces covalentes no polares (Figura 3).
en un enlace covalente polar, los electrones compartidos por los átomos pasan más tiempo más cerca de un núcleo que del otro núcleo. Debido a la distribución desigual de electrones entre los diferentes núcleos, se desarrolla una carga ligeramente positiva (δ+) o ligeramente negativa (δ–). Los enlaces covalentes entre átomos de hidrógeno y oxígeno en el agua son enlaces covalentes polares., Los electrones compartidos pasan más tiempo cerca del núcleo de oxígeno, dándole una pequeña carga negativa, que pasan cerca de los núcleos de hidrógeno, dando a estas moléculas una pequeña carga positiva.

los enlaces de hidrógeno
los enlaces iónicos y covalentes son enlaces fuertes que requieren una energía considerable para romperse. Sin embargo, no todos los enlaces entre elementos son enlaces iónicos o covalentes. También se pueden formar lazos más débiles. Estas son atracciones que ocurren entre cargas positivas y negativas que no requieren mucha energía para romperse. Dos enlaces débiles que ocurren con frecuencia son los enlaces de hidrógeno y las interacciones de van der Waals. Estos enlaces dan lugar a las propiedades únicas del agua y las estructuras únicas del ADN y las proteínas.,
cuando se forman enlaces covalentes polares que contienen un átomo de hidrógeno, el átomo de hidrógeno en ese enlace tiene una carga ligeramente positiva. Esto se debe a que el electrón compartido se tira más fuertemente hacia el otro elemento y se aleja del núcleo de hidrógeno. Debido a que el átomo de hidrógeno es ligeramente positivo (δ+), será atraído por cargas parciales negativas vecinas (δ–). Cuando esto sucede, se produce una interacción débil entre la carga δ+ del átomo de hidrógeno de una molécula y la carga δ de la otra molécula. Esta interacción se llama enlace de hidrógeno., Este tipo de enlace es común; por ejemplo, la naturaleza líquida del agua es causada por los enlaces de hidrógeno entre moléculas de agua (Figura 4). Los enlaces de hidrógeno le dan al agua las propiedades únicas que sostienen la vida. Si no fuera por el enlace de hidrógeno, el agua sería un gas en lugar de un líquido a temperatura ambiente.

los enlaces de Hidrógeno se forma entre moléculas diferentes y que no siempre tienen que incluir una molécula de agua. Los átomos de hidrógeno en enlaces polares dentro de cualquier molécula pueden formar enlaces con otras moléculas adyacentes. Por ejemplo, los enlaces de hidrógeno mantienen juntas dos largas hebras de ADN para dar a la molécula de ADN su característica estructura de doble cadena. Los enlaces de hidrógeno también son responsables de parte de la estructura tridimensional de las proteínas.,
interacciones de van der Waals
Al igual que los enlaces de hidrógeno, las interacciones de van der Waals son atracciones débiles o interacciones entre moléculas. Ocurren entre átomos polares, unidos covalentemente, en diferentes moléculas. Algunas de estas atracciones débiles son causadas por cargas parciales temporales formadas cuando los electrones se mueven alrededor de un núcleo. Estas interacciones débiles entre moléculas son importantes en los sistemas biológicos.