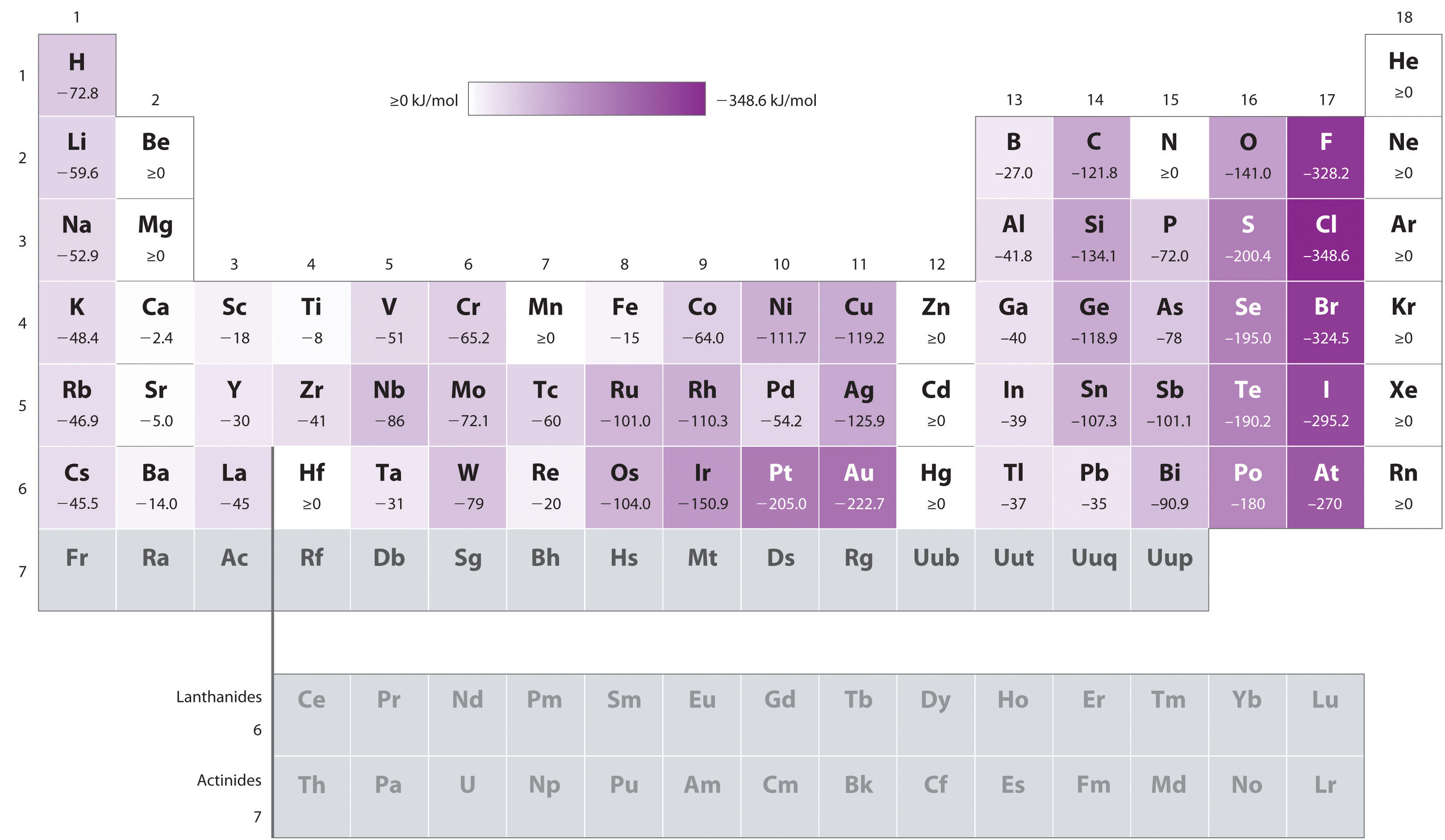
Les atomes ayant les rayons les plus grands, qui ont les énergies d’ionisation les plus faibles (affinité pour leurs propres électrons de valence), ont également la plus faible affinité pour un électron ajouté. Il existe cependant deux exceptions majeures à cette tendance:
- Les affinités électroniques des éléments B à F dans la deuxième ligne du tableau périodique sont moins négatives que celles des éléments immédiatement en dessous d’eux dans la troisième ligne., Apparemment, l’augmentation des répulsions électron–électron subies par les électrons confinés aux orbitales 2P relativement petites surmonte l’attraction accrue électron–noyau à de courtes distances nucléaires. Le fluor a donc une affinité plus faible pour un électron ajouté que le chlore. Par conséquent, les éléments de la troisième rangée (n = 3) ont les affinités électroniques les plus négatives. Plus loin dans une colonne, l’attraction pour un électron ajouté diminue parce que l’électron entre dans une orbitale plus éloignée du noyau., Les répulsions électron–électron diminuent également car les électrons de valence occupent un plus grand volume d’espace. Ces effets ont tendance à s’annuler les uns les autres, de sorte que les changements dans l’affinité électronique au sein d’une famille sont beaucoup plus petits que les changements dans l’énergie d’ionisation.
- Les affinités électroniques des métaux alcalino-terreux deviennent plus négatives de Be à Ba. La séparation d’énergie entre les sous-cellules ns2 remplies et les sous-cellules np vides diminue avec l’augmentation de n, de sorte que la formation d’un anion à partir des éléments plus lourds devient énergétiquement plus favorable.,
Les équations pour les secondes affinités électroniques et supérieures sont analogues à celles pour les secondes énergies d’ionisation et supérieures:
\
\
Comme nous l’avons vu, la première affinité électronique peut être supérieure ou égale à zéro ou négative, selon la configuration électronique de l’atome. En revanche, la deuxième affinité électronique est toujours positive parce que les répulsions électron-électron accrues dans un dianion sont beaucoup plus grandes que l’attraction du noyau pour les électrons supplémentaires., Par exemple, la première affinité électronique de l’oxygène est de -141 kJ/mol, mais la seconde affinité électronique est de +744 kJ/mol:
\
\
ainsi la formation d’un ion oxyde gazeux (\(O^{2−}\)) est énergétiquement assez défavorable (estimée en ajoutant les deux étapes):
\
alors que les premières affinités électroniques peuvent être négatives, positives ou nulles, les secondes affinités électroniques sont toujours positives.,
Si de l’énergie est nécessaire pour former à la fois des cations chargés positivement et des polyanions monatomiques, pourquoi des composés ioniques tels que \(MgO\), \(Na_2S\) et \(Na_3P\) se forment-ils? Le facteur clé dans la formation de composés ioniques Stables est les interactions électrostatiques favorables entre les cations et les anions dans le sel cristallin.
exemple \(\PageIndex{1}\): affinités électroniques contrastées de Sb, Se et Te
en fonction de leurs positions dans le tableau périodique, laquelle de Sb, Se ou Te préviendriez-vous d’avoir l’affinité électronique la plus négative?,
etant Donné: trois éléments
Demandé: élément le plus négatif affinité électronique
Stratégie:
- Trouver les éléments dans le tableau périodique. Utilisez les tendances des affinités électroniques dans une colonne pour les éléments du même groupe. De même, utilisez les tendances des affinités électroniques de gauche à droite pour les éléments de la même ligne.
- placez les éléments dans l’ordre, en énumérant d’abord l’élément ayant l’affinité électronique la plus négative.,
Solution:
A Nous savons que les affinités électroniques deviennent moins négatives en descendant une colonne (à l’exception des affinités électroniques anormalement basses des éléments de la deuxième ligne), nous pouvons donc prédire que L’affinité électronique de Se est plus négative que celle de Te. Nous savons également que les affinités électroniques deviennent plus négatives de gauche à droite sur une ligne, et que les éléments du groupe 15 ont tendance à avoir des valeurs moins négatives que prévu., Étant donné que Sb est situé à gauche de Te et appartient au groupe 15, nous prédisons que L’affinité électronique de Te est plus négative que celle de SB. L’ordre global est Se <Te < Sb, donc Se a l’affinité électronique la plus négative parmi les trois éléments.